1 . 工业上用Fe(Ⅲ)作为可再生氧化剂回收工业废气中的H2S,生产单质硫。
(1)铁元素属于_______ 区(填“s”、“d”、“ds”、“p”)。
(2)Fe3+生化氧化再生法分为吸收和再生两部分。
①吸收:用Fe3+将H2S氧化为S,该反应的离子方程式是_______ 。
②再生:O2在氧化亚铁硫杆菌作用下再生Fe3+。
缺点:氧化亚铁硫杆菌生长的最佳pH范围是1.4~3.0,但酸性条件不利于H2S的吸收,结合平衡移动原理解释原因_______ 。
(3)络合铁法脱硫技术吻合节能减排、经济高效的工业化指导思想。
①碱性条件有利于H2S的吸收,但Fe3+极易形成氢氧化物和硫化物沉淀,请在图中用“↑”或“↓”补全Fe3+的电子分布图。从图中可以看出Fe3+有空轨道,可以形成溶于水的Fe3+Ln(配合物,L表示配体,n表示配位数)。_______
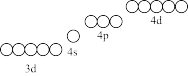
②ⅰ.写出碱性条件下Fe3+Ln氧化H2S生成S8的离子方程式_______ 。
ⅱ.O2氧化再生Fe3+Ln的离子方程式:4Fe2+Ln+O2+2H2O=4Fe3+Ln+4OH−
写出总反应的化学方程式_______ 。
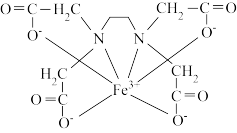
③下图是EDTA与Fe3+形成配合物的结构示意图,Fe3+外层空轨道采取sp3d2杂化,1mol该配合物中配位键有_______ mol。
(1)铁元素属于
(2)Fe3+生化氧化再生法分为吸收和再生两部分。
①吸收:用Fe3+将H2S氧化为S,该反应的离子方程式是
②再生:O2在氧化亚铁硫杆菌作用下再生Fe3+。
缺点:氧化亚铁硫杆菌生长的最佳pH范围是1.4~3.0,但酸性条件不利于H2S的吸收,结合平衡移动原理解释原因
(3)络合铁法脱硫技术吻合节能减排、经济高效的工业化指导思想。
①碱性条件有利于H2S的吸收,但Fe3+极易形成氢氧化物和硫化物沉淀,请在图中用“↑”或“↓”补全Fe3+的电子分布图。从图中可以看出Fe3+有空轨道,可以形成溶于水的Fe3+Ln(配合物,L表示配体,n表示配位数)。
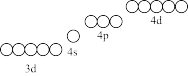
②ⅰ.写出碱性条件下Fe3+Ln氧化H2S生成S8的离子方程式
ⅱ.O2氧化再生Fe3+Ln的离子方程式:4Fe2+Ln+O2+2H2O=4Fe3+Ln+4OH−
写出总反应的化学方程式
③下图是EDTA与Fe3+形成配合物的结构示意图,Fe3+外层空轨道采取sp3d2杂化,1mol该配合物中配位键有

您最近一年使用:0次
2022-04-02更新
|
385次组卷
|
2卷引用:北京市石景山区2022届高三一模化学试题



