名校
解题方法
1 . NaClO2在工业生产中常用作漂白剂、脱色剂、消毒剂、拔染剂等。实验室中可用H2O2和NaOH混合溶液吸收ClO2的方法制取NaClO2,现利用如下装置及试剂制备NaClO2晶体:
已知:①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2气体浓度较大时易发生爆炸。
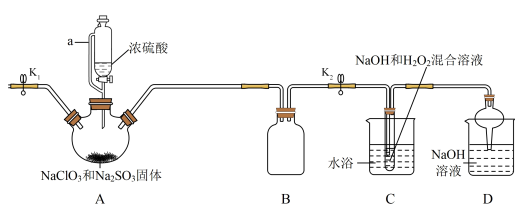
(1)A装置中仪器a的名称为______ 。装置D中NaOH溶液的作用是______ 。
(2)装置A中生成ClO2的化学方程式为______ 。
(3)关于装置C及后续操作的下列说法中,错误的是______ 。
(4)仪器A中NaClO3需稍微过量,原因是______ 。
(5)实验过程中,常需要打开K1,鼓入一定量空气。该操作的目的是______ 。
(6)Cl和O可形成另一种化合物Cl2O,中心原子为O,Cl2O的VSEPR模型是______ ;Cl2O键角比F2O键角______ (填“大”“小”或“相等”)。
(7)NaClO2纯度的测定:用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品1.810g配制成250mL溶液,从中取出25.00mL;加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O =S4O
=S4O +2I-)。样品中NaClO2的纯度为
+2I-)。样品中NaClO2的纯度为______ %(用含c、V的代数式表示)。
已知:①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2气体浓度较大时易发生爆炸。

(1)A装置中仪器a的名称为
(2)装置A中生成ClO2的化学方程式为
(3)关于装置C及后续操作的下列说法中,错误的是
| A.装置C中H2O2作氧化剂 |
| B.为获得NaClO2晶体,可将C试管中的溶液在55℃蒸发浓缩结晶并趁热过滤 |
| C.用50℃左右温水洗涤所得晶体 |
| D.高温烘干过滤后所得滤渣即可得到产物 |
(4)仪器A中NaClO3需稍微过量,原因是
(5)实验过程中,常需要打开K1,鼓入一定量空气。该操作的目的是
(6)Cl和O可形成另一种化合物Cl2O,中心原子为O,Cl2O的VSEPR模型是
(7)NaClO2纯度的测定:用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品1.810g配制成250mL溶液,从中取出25.00mL;加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O =S4O
=S4O +2I-)。样品中NaClO2的纯度为
+2I-)。样品中NaClO2的纯度为
您最近一年使用:0次
2023-10-27更新
|
1110次组卷
|
5卷引用:广西部分高中2024届高三第一次摸底测试化学试题
广西部分高中2024届高三第一次摸底测试化学试题(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)广西南宁市2024届高三上学期毕业班摸底测试化学试题江西省赣州市全南中学2023-2024学年高三上学期11月期中考试化学试题河北省衡水市武邑中学2023-2024学年高三上学期12月期中考试化学试题



