2021年新高考山东化学高考真题
山东
高三
高考真题
2021-06-30
24645次
整体难度:
适中
考查范围:
化学与STSE、有机化学基础、物质结构与性质、化学实验基础、常见无机物及其应用、化学反应原理、认识化学科学
2021年新高考山东化学高考真题
山东
高三
高考真题
2021-06-30
24645次
整体难度:
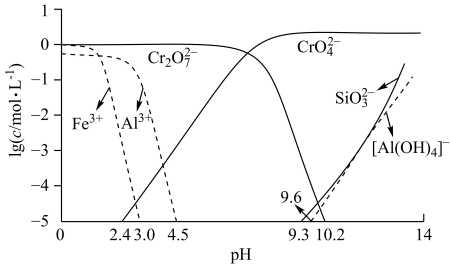
适中
考查范围:
化学与STSE、有机化学基础、物质结构与性质、化学实验基础、常见无机物及其应用、化学反应原理、认识化学科学
一、单选题 添加题型下试题
1. 有利于实现“碳达峰、碳中和”的是
| A.风能发电 | B.粮食酿酒 | C.燃煤脱硫 | D.石油裂化 |
【知识点】 大气污染的治理原理及方法解读 能源开发利用新理念 煤的综合利用解读
您最近一年使用:0次
2021-06-29更新
|
7842次组卷
|
24卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)课时01 化学与生产、生活和环境-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题14 海水资源的综合利用 环境保护与绿色化学 (限时精炼)-2022年高三毕业班化学常考点归纳与变式演练江苏省如皋中学2021-2022学年高三上学期期初测试化学试题(已下线)专题01 STSE 化学用语-备战2022年高考化学真题及地市好题专项集训【山东专用】福建省长汀县第一中学2021-2022学年高三上学期第二次月考化学试题2021年山东高考化学试题变式题1-10上海市长宁区2022届高三一模化学试题(已下线)专题01 化学与STSE—2022年高考化学二轮复习讲练测-练习上海市宝山区2022届高三一模化学试题(已下线)秘籍02 化学与STSE-备战2022年高考化学抢分秘籍(全国通用)(已下线)押新高考卷01题 化学与STSE、传统文化-备战2022年高考化学临考题号押题(新高考通版)上海市敬业中学2021-2022学年高三下学期5月在线教学质量检测化学试题河南省荥阳市京城高中2022-2023学年高三上学期开学考试化学试题(已下线)专题01 STSE 物质的分类、性质与变化(练)-2023年高考化学二轮复习讲练测(新高考专用)上海市大同中学2022-2023学年高二上学期期中考试化学试题江苏省扬州市宝应县2022-2023学年高三上学期期末模拟化学试题(已下线)【2022】【高二上】【期中考】【高中化学】59第四章 非金属及其化合物 热点强化10 绿色化学与环境保护(已下线)【2022】【高二化学】【期中考】-178山东省聊城市第四中学2022-2023学年高二下学期5月月考化学试题(已下线)考点12 硅及其无机非金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江苏省泰州中学2023-2024学年高三上学期期初调研考试化学试题天津市和平区2023-2024学年高三下学期第三次质量调查化学学科试卷
2. 下列物质应用错误的是
| A.石墨用作润滑剂 | B.氧化钙用作食品干燥剂 |
| C.聚乙炔用作绝缘材料 | D.乙二醇溶液用作汽车防冻液 |
您最近一年使用:0次
2021-06-29更新
|
7109次组卷
|
5卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)专题05 元素及其化合物-备战2022年高考化学真题及地市好题专项集训【山东专用】2021年山东高考化学试题变式题1-10(已下线)押新高考卷01题 化学与STSE、传统文化-备战2022年高考化学临考题号押题(新高考通版)江苏省苏州市苏州高新区第一中学2022-2023学年高一下学期5月月考化学试题
单选题
|
较易(0.85)
3. 关于下列仪器使用的说法错误的是
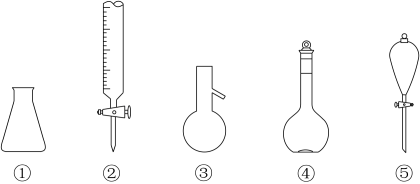

| A.①、④不可加热 | B.②、④不可用作反应容器 |
| C.③、⑤可用于物质分离 | D.②、④、⑤使用前需检漏 |
您最近一年使用:0次
2021-06-29更新
|
11291次组卷
|
37卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)课时51 实验仪器的使用及安全操作-2022年高考化学一轮复习小题多维练(全国通用)江苏省连云港市灌云县第一中学2021-2022学年高三上学期第一次学情检测化学试题(已下线)专题11 化学实验基础-备战2022年高考化学真题及地市好题专项集训【山东专用】辽宁省东北育才学校2021-2022学年高二上学期期中考试化学试题湖北省石首市第一中学2021-2022学年高三上学期10月月考化学试题2021年山东高考化学试题变式题1-10(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题05 化学基础实验—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)卷09 物质的分离、提纯-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)秘籍04 实验仪器使用与基本操作-备战2022年高考化学抢分秘籍(全国通用)(已下线)卷04 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)卷01 小题素养卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押新高考卷05题 化学实验基础-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题11 基本实验专练湖南省邵阳市第二中学2022-2023学年高三上学期第三次月考化学试题(已下线)第25讲 常见仪器使用和实验基本操作(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第25讲 常见仪器使用和实验基本操作 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题江西省樟树航天中学高三年级2021-2022学年高三上学期10月调研考试化学试题(已下线)易错点31 化学实验常用仪器-备战2023年高考化学考试易错题山东省威海乳山市银滩高级中学2021-2022学年高二下学期3月月考化学试题四川省成都外国语学校2022-2023学年高二上学期12月月考化学试题(已下线)专题23 化学实验基础性选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)第二章 物质的量化学实验基本技能 第9讲 化学实验基础知识和技能(已下线)专题05 突破化学实验基础(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)专题13 化学实验基础(已下线)专题13 化学实验基础(已下线)考点07 物质的量浓度(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第14讲化学实验常用仪器及基本操作(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)(已下线)考点44 化学实验基础(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点1 常见仪器使用和实验基本操作(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点2 物质的分离、提纯、检验与鉴别 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第1讲 常用的仪器及基本操作辽宁省鞍山市普通高中2023-2024学年高三上学期期末联考化学试题
单选题
|
较难(0.4)
4. X、Y为第三周期元素、Y最高正价与最低负价的代数和为6,二者形成的一种化合物能以[XY4]+[XY6]-的形式存在。下列说法错误的是
| A.原子半径:X>Y | B.简单氢化物的还原性:X>Y |
| C.同周期元素形成的单质中Y氧化性最强 | D.同周期中第一电离能小于X的元素有4种 |
您最近一年使用:0次
2021-06-29更新
|
13111次组卷
|
35卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)课时25 原子结构-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第36讲 原子结构与性质(精练)-2022年一轮复习讲练测(已下线)专题06 物质结构 元素周期律-备战2022年高考化学真题及地市好题专项集训【山东专用】江苏省如皋中学2021-2022学年高三上学期第一次阶段考试化学试题辽宁省渤海大学附属高级中学2021-2022学年高三上学期第二次月考化学试题辽宁省沈阳市第一二〇中学2021-2022学年高二上学期期中考试化学试题2021年湖北高考化学试题变式题11-192021年山东高考化学试题变式题1-10福建省福州第三中学2021-2022学年高三上学期第五次质量检测化学试题(已下线)查补易混易错点06 物质结构 元素周期律-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷06题 元素周期表元素周期律-备战2022年高考化学临考题号押题(新高考通版)浙江省温州新力量联盟2021-2022学年高二下学期期末联考化学试题(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第14讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(新教材新高考)北京市清华大学附属中学2022-2023学年高三9月月考化学试题四川省遂宁市射洪中学2022-2023学年高二上学期第一次月考(10月)化学试题湖南省长沙市卓华高级中学2021-2022学年高二下学期期末考试化学试题四川省内江市第六中学2022-2023学年高二上学期期中考试化学试题四川省遂宁中学校2022-2023学年高二上学期期中考试化学试题山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破天津市第四十七中学2022—2023学年高三上学期期末 阶段性学习检测化学试题天津市第四十七中学2022-2023学年高三上学期期末考试化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第五章 物质结构与性质 元素周期律 第27讲 元素周期表和元素周期律湖北省武汉市洪山高级中学2022-2023学年高二下学期2月考试化学试题安徽省安庆市第一中学2022-2023学年高二下学期第一次月考化学试题黑龙江省哈尔滨市第三中学2022-2023学年高二下学期第一次验收考试化学试题(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(选择题1-5)(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)(已下线)题型08 元素周期律推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
单选题
|
适中(0.65)
5. 下列由实验现象所得结论错误的是
A.向NaHSO3溶液中滴加氢硫酸,产生淡黄色沉淀,证明HSO 具有氧化性 具有氧化性 |
| B.向酸性KMnO4溶液中加入Fe3O4粉末,紫色褪去,证明Fe3O4中含Fe(Ⅱ) |
| C.向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2 |
| D.向NaClO溶液中滴加酚酞试剂,先变红后褪色,证明NaClO在溶液中发生了水解反应 |
您最近一年使用:0次
2021-06-29更新
|
9665次组卷
|
21卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题山东省临沂市兰山区2020-2021学年高一下学期期末考试化学试题(已下线)课时23 氮及其化合物-2022年高考化学一轮复习小题多维练(全国通用)吉林省松原市实验高级中学2020-2021学年高一下学期期末考试化学试题(已下线)专题05 元素及其化合物-备战2022年高考化学真题及地市好题专项集训【山东专用】内蒙古北京八中乌兰察布分校2021-2022学年高三上学期学科素养评估一化学试题2021年山东高考化学试题变式题1-10(已下线)专题07 非金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)秘籍05 微型实验方案设计与评价-备战2022年高考化学抢分秘籍(全国通用)(已下线)押新高考卷05题 化学实验基础-备战2022年高考化学临考题号押题(新高考通版)天津市第一中学2021-2022学年高三下学期4月月考化学试题山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题新疆乌鲁木齐市第八中学2022-2023学年高三上学期第一次月考化学试题河北省石家庄市第十五中学2022-2023学年高三上学期阶段性考试化学试题山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型182 综合实验突破(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)河北省唐山市第一中学2022-2023学年高三上学期11月期中考试化学试题
单选题
|
适中(0.65)
6. X、Y均为短周期金属元素,同温同压下,0.1molX的单质与足量稀盐酸反应,生成H2体积为V1L;0.1molY的单质与足量稀硫酸反应,生成H2体积为V2L。下列说法错误的是
A.X、Y生成H2的物质的量之比一定为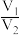 |
B.X、Y消耗酸的物质的量之比一定为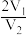 |
C.产物中X、Y化合价之比一定为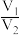 |
D.由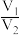 一定能确定产物中X、Y的化合价 一定能确定产物中X、Y的化合价 |
您最近一年使用:0次
2021-06-29更新
|
8052次组卷
|
25卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)课时11 物质的量、气体摩尔体积-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题02 化学计量与化学计算-备战2022年高考化学真题及地市好题专项集训【山东专用】江西省宜春市第九中学2021-2022学年高三上学期10月月考化学试题河北省石家庄市第二中学2021-2022学年高三上学期10月联考化学试题山东省烟台市第二中学2021-2022学年高一10月月考化学试题2021年山东高考化学试题变式题1-10湖北省武汉市汉阳、江夏2021-2022学年高一上学期12月联考化学试题河南省濮阳市第一高级中学2022-2023学年高三上学期第一次月考化学试题(已下线)第04讲 物质的量 气体摩尔体积 (练)-2023年高考化学一轮复习讲练测(新教材新高考)山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题湖南攸县长鸿实验中学2022-2023学年高三上学期第二次月考化学试题黑龙江省哈尔滨市第九中学校2022-2023学年高一上学期11月月考化学试题(已下线)热点情景汇编-专题三 氧化还原中的化学武汉市第一中学2021-2022学年高三上学期10月月考化学试题(已下线)专题02 阿伏加德罗常数及其化学计算 (练)-2023年高考化学二轮复习讲练测(新高考专用)江苏省苏州市常熟中学2022-2023学年高一上学期末测试卷一化学试题(已下线)第一章 物质的量 第1讲 物质的量 气体摩尔体积山东省齐鲁名师联盟2023-2024学年高三上学期第一次诊断考试化学试题(已下线)考点08 物质的量在化学方程式计算中的应用(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点02 物质的量 气体摩尔体积(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题03 化学计量-2023年高考化学真题题源解密(全国通用)(已下线)专题03 阿伏加德罗常数与化学计算 -2023年高考化学真题题源解密(新高考专用)辽宁省沈阳市五校协作体2023-2024学年高一上学期11月期中考试化学试题(已下线)题型01 以物质的量为中心的计算-【好题汇编】备战2023-2024学年高一化学期末真题分类汇编(江苏专用)
单选题
|
适中(0.65)
真题
解题方法
7. 某同学进行蔗糖水解实验,并检验产物中的醛基,操作如下:向试管Ⅰ中加入1mL20%蔗糖溶液,加入3滴稀硫酸,水浴加热5分钟。打开盛有10%NaOH溶液的试剂瓶,将玻璃瓶塞倒放,取1mL溶液加入试管Ⅱ,盖紧瓶塞;向试管Ⅱ中加入5滴2%CuSO4溶液。将试管Ⅱ中反应液加入试管Ⅰ,用酒精灯加热试管Ⅰ并观察现象。实验中存在的错误有几处?
| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
2021-06-29更新
|
7966次组卷
|
25卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)课时60 醛 羧酸和酯-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题11 化学实验基础-备战2022年高考化学真题及地市好题专项集训【山东专用】2021年山东高考化学试题变式题1-10(已下线)解密12 有机化学基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密12 有机化学基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)押新高考卷05题 化学实验基础-备战2022年高考化学临考题号押题(新高考通版)(已下线)第23讲 糖类(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)(已下线)第23讲 糖类(下)(word讲义)-【帮课堂】2021-2022学年高二化学同步精品讲义(人教2019选择性必修3)(已下线)考点40 糖类-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第56练 糖类-2023年高考化学一轮复习小题多维练(全国通用)第四章 第一~三节综合拔高练山东省菏泽市单县第二中学2021-2022学年高三下学期开学考试化学试题山东省菏泽市单县第一中学2021-2022学年高二下学期四月月考化学试题(已下线)第32讲 有机化合物的结构特点与研究方法(讲)-2023年高考化学一轮复习讲练测(新教材新高考)山东省菏泽市单县二中-2021-2022学年高二下学期5月月考化学试题(已下线)易错点29 烃的衍生物-备战2023年高考化学考试易错题山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题(已下线)专题23 化学实验基础性选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题19 有机选择题题型分析(已下线)【知识图鉴】单元讲练测选择性必修3第4单元03巩固练(已下线)第九章 有机化学基础 第61讲 生命中的基础有机化学物质 合成有机高分子第四章 生物大分子(B卷·能力提升练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修3)(已下线)考点37 营养物质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第5讲 生物大分子 合成高分子
单选题
|
较难(0.4)
真题
名校
8. 工业上以SO2和纯碱为原料制备无水NaHSO3的主要流程如图,下列说法错误的是
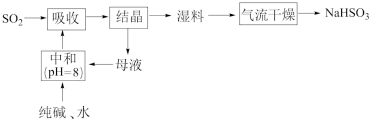
| A.吸收过程中有气体生成 | B.结晶后母液中含有NaHCO3 |
| C.气流干燥湿料时温度不宜过高 | D.中和后溶液中含Na2SO3和NaHCO3 |
您最近一年使用:0次
2021-06-29更新
|
13382次组卷
|
39卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)课时22 硫及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题12 硫及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练江西省赣县第三中学2021-2022学年高二上学期入学考试化学试题(已下线)专题12 工艺流程选择题-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)第四单元 非金属及其化合物(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)安徽省合肥市第一中学2021-2022学年高三上学期10月月考化学试题内蒙古北京八中乌兰察布分校2021-2022学年高三上学期学科素养评估一化学试题2021年山东高考化学试题变式题1-10(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)卷09 物质的分离、提纯-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)卷05 工艺流程型选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)卷05 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押新高考卷03题 元素化合物的性质-备战2022年高考化学临考题号押题(新高考通版)上海市奉贤区2022届高三下学期等级考二模化学试题(已下线)微专题21 二氧化硫性质四重性探究-备战2023年高考化学一轮复习考点微专题(已下线)第13讲 硫及其化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第12练 硫及其化合物-2023年高考化学一轮复习小题多维练(全国通用)(已下线)微专题30 非金属及其化合物制备流程与实验探究(S、Se、Te、Cl、Br、I)-备战2023年高考化学一轮复习考点微专题新疆乌鲁木齐市第八中学2022-2023学年高三上学期第一次月考化学试题(已下线)易错点34 化学实验方案的设计与评价-备战2023年高考化学考试易错题山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题江苏省扬州市广陵区名校2022-2023学年高一上学期12月月考化学试题(已下线)专题14 工艺流程选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)第四章 非金属及其化合物 第20讲 硫及其氧化物(已下线)上海市静安区2022-2023学年高三下学期二模变式题(选择题11-15)(已下线)专题10 物质的反应及转化(已下线)专题10 物质的反应及转化(已下线)考点10 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第3讲 硫及其重要化合物(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)四川省宜宾市叙州区第一中学校2022-2023学年高一下学期6月期末考试化学试题新疆石河子第一中学2023-2024学年高三上学期第三次月考化学试题山东省潍坊市昌乐二中2023-2024学年高三上学期第一次月考化学试题北京市中国人民大学附属中学2023-2024学年高三上学期11月统练三 化学试题天津市第一中学2023-2024学年高二上学期11月期中考试化学试题河南省信阳高级中学2023-2024学年高三上学期1月月考理综试题-高中化学江苏省常州市田家炳2高级中学023-2024学年高一上学期12月阶段性调研化学学科试卷
单选题
|
适中(0.65)
9. 关于CH3OH、N2H4和(CH3)2NNH2的结构与性质,下列说法错误的是
| A.CH3OH为极性分子 | B.N2H4空间结构为平面形 |
| C.N2H4的沸点高于(CH3)2NNH2 | D.CH3OH和(CH3)2NNH2中C、O、N杂化方式均相同 |
您最近一年使用:0次
2021-06-29更新
|
9837次组卷
|
35卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)课时27 微粒间作用力-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第37讲 分子结构与性质(精练)-2022年一轮复习讲练测(已下线)专题13 物质结构与性质基础-备战2022年高考化学真题及地市好题专项集训【山东专用】天津市第一中学2022届高三第一次月考化学试题2021年山东高考化学试题变式题1-10(已下线)二轮拔高卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)(已下线)卷14 物质结构与性质选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押新高考卷08题 物质结构与性质-备战2022年高考化学临考题号押题(新高考通版)天津市新华中学2022届高三下学期高考校一模(统练8)化学试题广东省汕头市金山中学2021-2022学年高二上学期期末考试化学试题抚顺市第一中学2021-2022学年高二下学期开学考试化学试题(已下线)微专题51 极性、溶解性、手性、无机含氧酸酸性的判断-备战2023年高考化学一轮复习考点微专题(已下线)第30讲 分子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)重庆市璧山来凤中学校2022-2023学年高三10月月考化学试题(已下线)易错点16 分子结构与性质-备战2023年高考化学考试易错题山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破山东省菏泽市单县二中2021-2022学年高二下学期开学考试 化学试题辽宁省沈阳市东北育才学校2022-2023学年高二上学期期末测试化学试题湖北省武汉市第六中学2022~2023学年高二上学期第三次月考化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(选择题6-10)(已下线)第五章 物质结构与性质 元素周期律 第30讲 配合物 分子间作用力 超分子福建省建瓯市芝华中学2022-2023学年高二下学期第一次月考化学试题广东省东莞市东华高级中学2021-2022 学年高二下学期专题测试化学试题(已下线)考点08 微粒间相互作用力(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第5讲 分子结构与性质(已下线)第4讲 空间构型天津市宁河区芦台第一中学2022-2023学年高三上学期1月期末考试化学试题广东省潮阳一中、宝安中学等七校联考2022-2023学年高三上学期第二次(11月)联考化学试题(已下线)选择题1-5湖南省长沙市湖南师范大学附属中学2023-2024学年高三下学期第七次月考化学试题湖南省师范大学附属中学2023-2024学年高三下学期 月考化学试卷天津市南开中学2024届高三下学期第五次月检测化学试卷
单选题
|
适中(0.65)
真题
名校
10. 以KOH溶液为离子导体,分别组成CH3OH—O2、N2H4—O2、(CH3)2NNH2—O2清洁燃料电池,下列说法正确的是
| A.放电过程中,K+均向负极移动 |
| B.放电过程中,KOH物质的量均减小 |
| C.消耗等质量燃料,(CH3)2NNH2—O2燃料电池的理论放电量最大 |
| D.消耗1molO2时,理论上N2H4—O2燃料电池气体产物的体积在标准状况下为11.2L |
您最近一年使用:0次
2021-06-29更新
|
9428次组卷
|
26卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)课时30 新型原电池装置-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题08 电化学及其应用-备战2022年高考化学真题及地市好题专项集训【山东专用】黑龙江省哈尔滨市第三中学2021-2022学年高二上学期10月阶段性测试化学试题2021年山东高考化学试题变式题1-10(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题06 电化学原理应用—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押新高考卷12题 电化学基础-备战2022年高考化学临考题号押题(新高考通版)第四章 综合拔高练(已下线)第16讲 原电池 新型电源 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题05 化学能与电能的转化(练)-2023年高考化学二轮复习讲练测(新高考专用)山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题(已下线)江苏省南通市如皋市2022-2023学年高三上学期期末考试化学试题(已下线)专题16 新型电化学装置分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第六章 化学反应与能量 第35讲 原电池 化学电源(已下线)专题二 燃料电池(练习)(已下线)题型17 燃料电池的应用山东省齐鲁名师联盟2023-2024学年高三上学期第一次诊断考试化学试题章末检测卷(四) 化学反应与电能(已下线)考点18 原电池 化学电源(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第3讲 原电池 化学电源(已下线)考点2 原电池 新型电源(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)山西大学附属中学校2022-2023学年高三上学期11月期中考试化学试题辽宁省鞍山市普通高中2023-2024学年高三上学期期末联考化学试题山东省临沂市平邑县第一中学西校区2023-2024学年高二上学期元旦竞赛考试化学试题
二、多选题 添加题型下试题
多选题
|
适中(0.65)
11. 为完成下列各组实验,所选玻璃仪器和试剂均准确、完整的是(不考虑存放试剂的容器)
| 实验目的 | 玻璃仪器 | 试剂 | |
| A | 配制100mL一定物质的量浓度的NaCl溶液 | 100mL容量瓶、胶头滴管、烧杯、量筒、玻璃棒 | 蒸馏水、NaCl固体 |
| B | 制备Fe(OH)3胶体 | 烧杯、酒精灯、胶头滴管 | 蒸馏水、饱和FeCl3溶液 |
| C | 测定NaOH溶液浓度 | 烧杯、锥形瓶、胶头滴管、酸式滴定管 | 待测NaOH溶液、已知浓度的盐酸、甲基橙试剂 |
| D | 制备乙酸乙酯 | 试管、量筒、导管、酒精灯 | 冰醋酸、无水乙醇、饱和Na2CO3溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-06-29更新
|
9308次组卷
|
21卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题山东省济宁市实验中学2022届高三上学期开学考试化学试题(已下线)课时51 实验仪器的使用及安全操作-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题11 化学实验基础-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省枣庄市第三中学2022届高三第一次月考化学试题2021年山东高考化学试题变式题11-20(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题05 化学基础实验—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)秘籍05 微型实验方案设计与评价-备战2022年高考化学抢分秘籍(全国通用)(已下线)押新高考卷05题 化学实验基础-备战2022年高考化学临考题号押题(新高考通版)(已下线)查补易混易错点08 化学实验基础-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)第25讲 常见仪器使用和实验基本操作 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题(已下线)专题23 化学实验基础性选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)湖南省郴州市2022-2023学年高二上学期期末质量监测化学试题(已下线)题型165 目的—操作型实验中涉及的仪器选择与使用(已下线)第09练 微型实验设计与评价 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)(已下线)实验01 配制一定物质的量浓度的溶液-【同步实验课】2023-2024学年高一化学教材实验大盘点(人教版2019必修第一册)(已下线)考点44 化学实验基础(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
多选题
|
适中(0.65)
真题
名校
12. 立体异构包括顺反异构、对映异构等。有机物M(2—甲基—2—丁醇)存在如图转化关系,下列说法错误的是
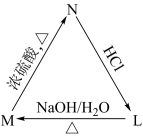

| A.N分子可能存在顺反异构 |
| B.L的任一同分异构体最多有1个手性碳原子 |
| C.M的同分异构体中,能被氧化为酮的醇有4种 |
| D.L的同分异构体中,含两种化学环境氢的只有1种 |
您最近一年使用:0次
2021-06-29更新
|
7592次组卷
|
25卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)专题讲座(十一) 同分异构体的书写与数目判断(精练)-2022年高考化学一轮复习讲练测(已下线)课时49 有机物同分异构体的判断-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题14 有机化合物基础-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)专题08 常见有机物及其应用-备战2022年高考化学学霸纠错(全国通用)2021年山东高考化学试题变式题11-20(已下线)第33讲 有机化合物的结构特点与研究方法(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)解密12 有机化学基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密12 有机化学基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)山东省烟台第二中学2021-2022学年高二3月月月考化学试题(已下线)查补易混易错点07 常见有机化合物及其应用-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷04题 有机化学基础-备战2022年高考化学临考题号押题(新高考通版)(已下线)考点44 有机综合推断-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第53练 醛与酮-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第32讲 有机化合物的结构特点与研究方法(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点29 烃的衍生物-备战2023年高考化学考试易错题山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题(已下线)专题30 有机物的结构和性质-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)山东省德州市第一中学2022-2023学年高二下学期6月月考化学试题(已下线)考点33 烃(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点32 共线共面 同分异构体(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题06 有机物的结构与性质-2023年高考化学真题题源解密(全国通用)山东省烟台莱州市第一中学2022-2023学年高二下学期3月月考化学试题(已下线)第3讲 卤代烃、醇、酚(已下线)第1讲 有机化合物的结构特点与研究方法
多选题
|
适中(0.65)
13. 实验室中利用固体KMnO4进行如图实验,下列说法错误的是
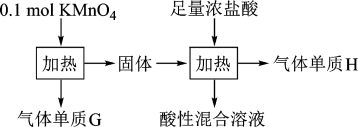

| A.G与H均为氧化产物 | B.实验中KMnO4只作氧化剂 |
| C.Mn元素至少参与了3个氧化还原反应 | D.G与H的物质的量之和可能为0.25mol |
您最近一年使用:0次
2021-06-29更新
|
8305次组卷
|
20卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题山东省济宁市实验中学2022届高三上学期开学考试化学试题(已下线)专题04 氧化还原反应-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省枣庄市第三中学2022届高三第一次月考化学试题山东省潍坊市第一中学2022届高三10月月考化学试题2021年山东高考化学试题变式题11-20(已下线)押新高考卷10题 氧化还原反应-备战2022年高考化学临考题号押题(新高考通版)河北省邯郸市大名县第一中学2021-2022学年高二下学期期末考试化学试题江西省樟树航天中学高三年级2021-2022学年高三上学期10月调研考试化学试题山东省新泰市第一中学2022—2023学年高一上学期期中考试化学试题(已下线)热点情景汇编-专题三 氧化还原中的化学贵州省遵义市第一中学2022-2023学年高一上学期期中考试化学试题(已下线)专题04 氧化还原反应及其应用(讲)-2023年高考化学二轮复习讲练测(新高考专用)湖南省株洲市第二中学2023届高三上学期第二次月考化学试题(已下线)专题08 氧化还原反应方程式的书写及计算-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考通用)(已下线)题型16 氧化还原反应基本概念的判断(已下线)第4讲 氧化还原反应的基本概念与规律(已下线)考点05 氧化还原反应方程式的配平与计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)(已下线)专题05 氧化还原反应及其计算-2023年高考化学真题题源解密(新高考专用)
三、单选题 添加题型下试题
单选题
|
适中(0.65)
14. 18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为: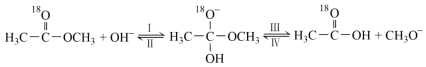 能量变化如图所示。已知
能量变化如图所示。已知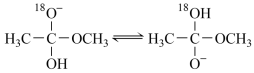 为快速平衡,下列说法正确的是
为快速平衡,下列说法正确的是
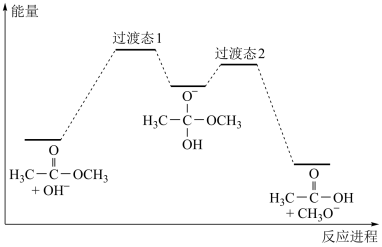
 能量变化如图所示。已知
能量变化如图所示。已知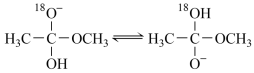 为快速平衡,下列说法正确的是
为快速平衡,下列说法正确的是
| A.反应Ⅱ、Ⅲ为决速步 |
| B.反应结束后,溶液中存在18OH- |
| C.反应结束后,溶液中存在CH318OH |
| D.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变 |
您最近一年使用:0次
2021-06-29更新
|
11810次组卷
|
34卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)课时28 焓变与热化学方程式-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题07 反应机理-备战2022年高考化学真题及地市好题专项集训【山东专用】湖南师范大学附属中学2021-2022学年高三上学期月考(三)化学试题辽宁省东北育才学校2021-2022学年高二上学期期中考试化学试题(已下线)专题09 化学反应与能量变化-备战2022年高考化学学霸纠错(全国通用)2021年山东高考化学试题变式题11-20(已下线)专题09 反应机理—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)卷05 化学能与热能-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)卷07 化学反应速率与化学平衡-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)卷15 热化学选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)秘籍08 反应历程探究与催化原理图象分析-备战2022年高考化学抢分秘籍(全国通用)(已下线)回归教材重难点05 化学反应中的能量变化-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷11题 反应机理分析-备战2022年高考化学临考题号押题(新高考通版)(已下线)第18讲 化学反应速率(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第31讲 乙醇和乙酸(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)易错点18 化学反应与能量-备战2023年高考化学考试易错题(已下线)易错点21 化学反应速率-备战2023年高考化学考试易错题黑龙江省牡丹江市第一高级中学2022-2023学年高二上学期期中考试化学试题(已下线)热点情景汇编-专题六 化学反应中的热能山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题(已下线)专题12 化学反应机理(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题13 反应微观机理分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)易错点1不熟悉模块杂糅试题而判断错误(已下线)专题08 化学反应中的能量变化(已下线)专题08 化学反应中的能量变化(已下线)专题09 化学反应中的热效应与反应机理-2023年高考化学真题题源解密(全国通用)(已下线)考点17 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第1讲 化学反应速率及其影响因素(已下线)考点1 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)湖北省武汉市东华中师范大学第一附属中学2023-2024学年高二上学期11月期中化学试题(已下线)题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)河南省济源高级中学2022-2023学年高二上学期10月月考 化学试题湖南省邵东市第三中学2023-2024学年高二上学期1月期末考试化学试卷
四、多选题 添加题型下试题
多选题
|
较难(0.4)
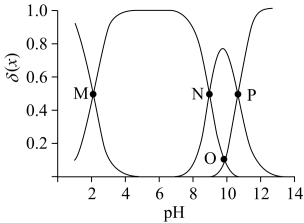
15. 赖氨酸[H3N+(CH2)4CH(NH2)COO-,用HR表示]是人体必需氨基酸,其盐酸盐(H3RCl2)在水溶液中存在如下平衡:H3R2+ H2R+
H2R+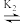 HR
HR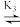 R-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数δ(x)随pH变化如图所示。已知δ(x)=
R-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数δ(x)随pH变化如图所示。已知δ(x)=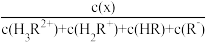 ,下列表述正确的是
,下列表述正确的是
 H2R+
H2R+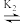 HR
HR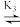 R-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数δ(x)随pH变化如图所示。已知δ(x)=
R-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数δ(x)随pH变化如图所示。已知δ(x)=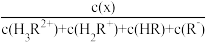 ,下列表述正确的是
,下列表述正确的是
A.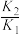 > >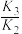 |
| B.M点,c(Cl-) +c(OH-)+c(R-)=2c(H2R+)+c(Na+)+c(H+) |
C.O点,pH=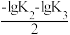 |
| D.P点,c(Na+)>c(Cl-)>c(OH-)>c(H+) |
您最近一年使用:0次
2021-06-29更新
|
10790次组卷
|
20卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)课时44 滴定曲线、分布系数曲线的分析-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题10 水溶液中的离子平衡-备战2022年高考化学真题及地市好题专项集训【山东专用】2021年山东高考化学试题变式题11-20(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点04 水溶液中的离子平衡-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)第31练 水的电离和溶液的pH-2023年高考化学一轮复习小题多维练(全国通用)(已下线)微专题41 水溶液中的三大守恒和浓度大小比较-备战2023年高考化学一轮复习考点微专题山东省临沂市兰陵县第四中学2021-2022学年高三12月月考化学试题(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题21 电解质溶液图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型135 酸溶液与碱溶液互滴图像分析甘肃省张掖市高台县第一中学2022-2023学年高二下学期2月月考化学试题(已下线)专题四 电解质溶液图象(讲)(已下线)考点26 弱电解质的电离(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
五、解答题 添加题型下试题
解答题-结构与性质
|
较难(0.4)
真题
解题方法
16. 非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态F原子核外电子的运动状态有__ 种。
(2)O、F、Cl电负性由大到小的顺序为__ ;OF2分子的空间构型为__ ;OF2的熔、沸点__ (填“高于”或“低于”)Cl2O,原因是___ 。
(3)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为___ ,下列对XeF2中心原子杂化方式推断合理的是___ (填标号)。
A.sp B.sp2 C.sp3 D.sp3d
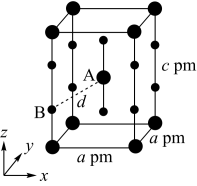
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有__ 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( ,
, ,
, )。已知Xe—F键长为rpm,则B点原子的分数坐标为
)。已知Xe—F键长为rpm,则B点原子的分数坐标为___ ;晶胞中A、B间距离d=___ pm。
(1)基态F原子核外电子的运动状态有
(2)O、F、Cl电负性由大到小的顺序为
(3)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为
A.sp B.sp2 C.sp3 D.sp3d
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有
 ,
, ,
, )。已知Xe—F键长为rpm,则B点原子的分数坐标为
)。已知Xe—F键长为rpm,则B点原子的分数坐标为
您最近一年使用:0次
2021-06-29更新
|
11188次组卷
|
13卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)专题18 物质结构与性质综合-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)2021年山东高考化学试题变式题11-20(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷15题 物质结构与性质综合题-备战2022年高考化学临考题号押题(新高考通版)山东省临沂市兰陵县第四中学2021-2022学年高三12月月考化学试题(已下线)第四部分 物质结构与性质 综合提能训练(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)
解答题-工业流程题
|
较难(0.4)
17. 工业上以铬铁矿(FeCr2O4,含Al、Si氧化物等杂质)为主要原料制备红矾钠(Na2Cr2O7•2H2O)的工艺流程如图。回答下列问题:___ ;冷却结晶所得母液中,除Na2Cr2O7外,可在上述流程中循环利用的物质还有____ 。
(4)利用膜电解技术(装置如图所示),以Na2CrO4为主要原料制备Na2Cr2O7的总反应方程式为:4Na2CrO4+4H2O 2Na2Cr2O7+4NaOH+2H2↑+O2↑。则Na2Cr2O7在
2Na2Cr2O7+4NaOH+2H2↑+O2↑。则Na2Cr2O7在___ (填“阴”或“阳”)极室制得,电解时通过膜的离子主要为___ 。

(1)焙烧的目的是将FeCr2O4转化为Na2CrO4并将Al、Si氧化物转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是
中和时pH的理论范围为
(4)利用膜电解技术(装置如图所示),以Na2CrO4为主要原料制备Na2Cr2O7的总反应方程式为:4Na2CrO4+4H2O
 2Na2Cr2O7+4NaOH+2H2↑+O2↑。则Na2Cr2O7在
2Na2Cr2O7+4NaOH+2H2↑+O2↑。则Na2Cr2O7在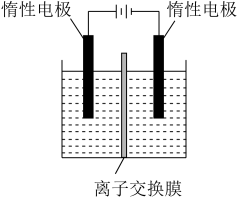
您最近一年使用:0次
2021-06-29更新
|
14293次组卷
|
22卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)微专题32 化学工艺流程题——核心反应与条件控制-备战2022年高考化学考点微专题(已下线)专题16 工艺流程综合题-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)专题讲座(六)化工流程的解题策略(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)2021年山东高考化学试题变式题11-20(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题27 无机化工流程-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)微专题17 热点金属及其化合物制备流程(V、Cr、Mn、Co、Ni)-备战2023年高考化学一轮复习考点微专题(已下线)微专题25 化学工艺流程题-----原料的预处理-备战2023年高考化学一轮复习考点微专题(已下线)微专题27 化学工艺流程题-----物质的分离与提纯-备战2023年高考化学一轮复习考点微专题山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题第二部分 热点专项突破——解题能力稳提升 专项3 结合理论的综合类工艺流程(已下线)题型39 其他过渡金属及其化合物的转化流程(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江苏省华罗庚中学2023-2024学年高三上学期12月阶段检测化学试卷湖南省邵阳市邵东市创新高级中学2023-2024学年高三上学期第四次月考化学试题
解答题-实验探究题
|
适中(0.65)
18. 六氯化钨(WCl6)可用作有机合成催化剂,熔点为283℃,沸点为340℃,易溶于CS2,极易水解。实验室中,先将三氧化钨(WO3)还原为金属钨(W)再制备WCl6,装置如图所示(夹持装置略)。回答下列问题:
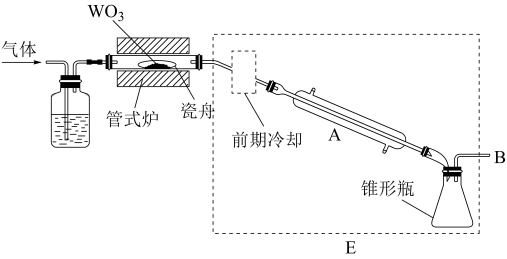
(1)检查装置气密性并加入WO3。先通N2,其目的是___ ;一段时间后,加热管式炉,改通H2,对B处逸出的H2进行后续处理。仪器A的名称为___ ,证明WO3已被完全还原的现象是___ 。
(2)WO3完全还原后,进行的操作为:①冷却,停止通H2;②以干燥的接收装置替换E;③在B处加装盛有碱石灰的干燥管;④……;⑤加热,通Cl2;⑥……。碱石灰的作用是___ ;操作④是___ ,目的是___ 。
(3)利用碘量法测定WCl6产品纯度,实验如下:
①称量:将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称重为m1g;开盖并计时1分钟,盖紧称重为m2g;再开盖加入待测样品并计时1分钟,盖紧称重为m3g,则样品质量为___ g(不考虑空气中水蒸气的干扰)。
②滴定:先将WCl6转化为可溶的Na2WO4,通过IO 离子交换柱发生反应:WO
离子交换柱发生反应:WO +Ba(IO3)2=BaWO4+2IO
+Ba(IO3)2=BaWO4+2IO ;交换结束后,向所得含IO
;交换结束后,向所得含IO 的溶液中加入适量酸化的KI溶液,发生反应:IO
的溶液中加入适量酸化的KI溶液,发生反应:IO +5I-+6H+=3I2+3H2O;反应完全后,用Na2S2O3标准溶液滴定,发生反应:I2+2S2O
+5I-+6H+=3I2+3H2O;反应完全后,用Na2S2O3标准溶液滴定,发生反应:I2+2S2O =2I-+S4O
=2I-+S4O 。滴定达终点时消耗cmol•L-1的Na2S2O3溶液VmL,则样品中WCl6(摩尔质量为Mg•mol-1)的质量分数为
。滴定达终点时消耗cmol•L-1的Na2S2O3溶液VmL,则样品中WCl6(摩尔质量为Mg•mol-1)的质量分数为___ 。称量时,若加入待测样品后,开盖时间超过1分钟,则滴定时消耗Na2S2O3溶液的体积将___ (填“偏大”“偏小”或“不变”),样品中WCl6质量分数的测定值将___ (填“偏大”“偏小”或“不变”)。

(1)检查装置气密性并加入WO3。先通N2,其目的是
(2)WO3完全还原后,进行的操作为:①冷却,停止通H2;②以干燥的接收装置替换E;③在B处加装盛有碱石灰的干燥管;④……;⑤加热,通Cl2;⑥……。碱石灰的作用是
(3)利用碘量法测定WCl6产品纯度,实验如下:
①称量:将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称重为m1g;开盖并计时1分钟,盖紧称重为m2g;再开盖加入待测样品并计时1分钟,盖紧称重为m3g,则样品质量为
②滴定:先将WCl6转化为可溶的Na2WO4,通过IO
 离子交换柱发生反应:WO
离子交换柱发生反应:WO +Ba(IO3)2=BaWO4+2IO
+Ba(IO3)2=BaWO4+2IO ;交换结束后,向所得含IO
;交换结束后,向所得含IO 的溶液中加入适量酸化的KI溶液,发生反应:IO
的溶液中加入适量酸化的KI溶液,发生反应:IO +5I-+6H+=3I2+3H2O;反应完全后,用Na2S2O3标准溶液滴定,发生反应:I2+2S2O
+5I-+6H+=3I2+3H2O;反应完全后,用Na2S2O3标准溶液滴定,发生反应:I2+2S2O =2I-+S4O
=2I-+S4O 。滴定达终点时消耗cmol•L-1的Na2S2O3溶液VmL,则样品中WCl6(摩尔质量为Mg•mol-1)的质量分数为
。滴定达终点时消耗cmol•L-1的Na2S2O3溶液VmL,则样品中WCl6(摩尔质量为Mg•mol-1)的质量分数为
您最近一年使用:0次
2021-06-29更新
|
11605次组卷
|
23卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)专题17 综合实验设计、探究和评价-备战2022年高考化学真题及地市好题专项集训【山东专用】2021年湖南省高考化学试卷变式题11-192021年山东高考化学试题变式题11-20(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题10 化学实验综合—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点10 综合实验方案的设计与评价-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷16题 化学实验综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)考点52 定量分析-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第28讲 定性、定量实验(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)微专题45 定量测量类综合实验-备战2023年高考化学一轮复习考点微专题山东省临沂市兰陵县第四中学2021-2022学年高三12月月考化学试题(已下线)易错点34 化学实验方案的设计与评价-备战2023年高考化学考试易错题湖南省邵阳市第二中学2022-2023学年高三上学期第五次月考化学试题福建省福州八中2022-2023学年高三上学期质检模拟考化学试题湖南省株洲市第八中学2022-2023学年高二上学期期中考试化学试题(已下线)专题26 定量测定类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 化学综合实验 综合提能训练(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
解答题-有机推断题
|
适中(0.65)
19. 一种利胆药物F的合成路线如图:
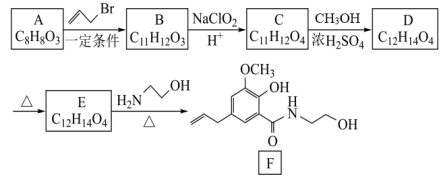
已知:Ⅰ.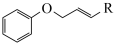

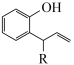 +
+
Ⅱ.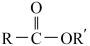

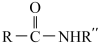
回答下列问题:
(1)A的结构简式为___ ;符合下列条件的A的同分异构体有___ 种。
①含有酚羟基 ②不能发生银镜反应 ③含有四种化学环境的氢
(2)检验B中是否含有A的试剂为___ ;B→C的反应类型为___ 。
(3)C→D的化学方程式为__ ;E中含氧官能团共___ 种。
(4)已知: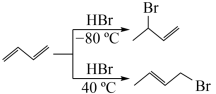 ,综合上述信息,写出由
,综合上述信息,写出由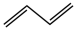 和
和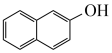 制备
制备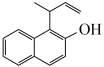 的合成路线
的合成路线___ 。

已知:Ⅰ.


 +
+
Ⅱ.
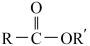

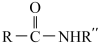
回答下列问题:
(1)A的结构简式为
①含有酚羟基 ②不能发生银镜反应 ③含有四种化学环境的氢
(2)检验B中是否含有A的试剂为
(3)C→D的化学方程式为
(4)已知:
 ,综合上述信息,写出由
,综合上述信息,写出由 和
和 制备
制备 的合成路线
的合成路线
您最近一年使用:0次
2021-06-29更新
|
11649次组卷
|
19卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)专题19 有机化学综合-备战2022年高考化学真题及地市好题专项集训【山东专用】2021年山东高考化学试题变式题11-20陕西省长安区第一中学2021-2022学年高二上学期期中考试化学试题(已下线)专题讲座(十二)有机合成与推断突破策略(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)解密12 有机化学基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密12 有机化学基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题14 有机化学基础—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点12 有机化学基础-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷18题 有机化学基础综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)2022年山东省高考真题变式题(非选择题)(已下线)易错点29 烃的衍生物-备战2023年高考化学考试易错题山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题辽宁省鞍山市第一中学2022-2023学年高二下学期期中考试化学试题(已下线)专题21 有机推断题(已下线)专题21 有机推断题(已下线)专题17 有机化学基础综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点40 有机合成(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)章末综合评价(九)
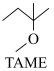
20. 2-甲氧基-2-甲基丁烷(TAME)常用作汽油原添加剂。在催化剂作用下,可通过甲醇与烯烃的液相反应制得,体系中同时存在如图反应:
反应Ⅰ: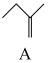 +CH3OH
+CH3OH
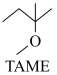 △H1
△H1
反应Ⅱ: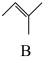 +CH3OH
+CH3OH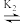
 △H2
△H2
反应Ⅲ: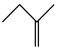
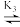
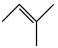 △H3
△H3
回答下列问题:
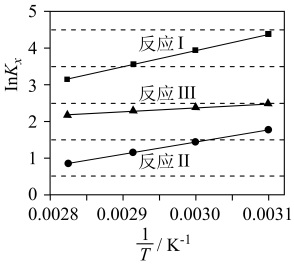
(1)反应Ⅰ、Ⅱ、Ⅲ以物质的量分数表示的平衡常数Kx与温度T变化关系如图所示。据图判断,A和B中相对稳定的是__ (用系统命名法命名); 的数值范围是
的数值范围是___ (填标号)。
A.<-1 B.-1~0 C.0~1 D.>1
(2)为研究上述反应体系的平衡关系,向某反应容器中加入1.0molTAME,控制温度为353K,测得TAME的平衡转化率为α。已知反应Ⅲ的平衡常数Kx3=9.0,则平衡体系中B的物质的量为___ mol,反应Ⅰ的平衡常数Kx1=___ 。同温同压下,再向该容器中注入惰性溶剂四氢呋喃稀释,反应Ⅰ的化学平衡将__ (填“正向移动”“逆向移动”或“不移动”)平衡时,A与CH3OH物质的量浓度之比c(A):c(CH3OH)=___ 。
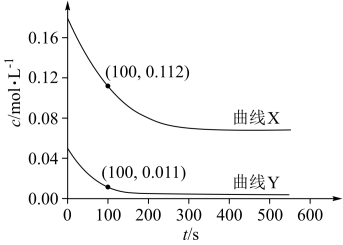
(3)为研究反应体系的动力学行为,向盛有四氢呋喃的另一容器中加入一定量A、B和CH3OH。控制温度为353K,A、B物质的量浓度c随反应时间t的变化如图所示。代表B的变化曲线为__ (填“X”或“Y”);t=100s时,反应Ⅲ的正反应速率v正__ 逆反应速率v逆(填“>”“<”或“=)。
反应Ⅰ:
 +CH3OH
+CH3OH
 △H1
△H1反应Ⅱ:
 +CH3OH
+CH3OH
 △H2
△H2反应Ⅲ:

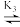
 △H3
△H3回答下列问题:
(1)反应Ⅰ、Ⅱ、Ⅲ以物质的量分数表示的平衡常数Kx与温度T变化关系如图所示。据图判断,A和B中相对稳定的是
 的数值范围是
的数值范围是A.<-1 B.-1~0 C.0~1 D.>1

(2)为研究上述反应体系的平衡关系,向某反应容器中加入1.0molTAME,控制温度为353K,测得TAME的平衡转化率为α。已知反应Ⅲ的平衡常数Kx3=9.0,则平衡体系中B的物质的量为
(3)为研究反应体系的动力学行为,向盛有四氢呋喃的另一容器中加入一定量A、B和CH3OH。控制温度为353K,A、B物质的量浓度c随反应时间t的变化如图所示。代表B的变化曲线为

【知识点】 盖斯定律及其有关计算 化学平衡的移动及其影响因素 化学平衡的有关计算
您最近一年使用:0次
2021-06-29更新
|
11422次组卷
|
15卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)专题15 化学反应原理综合-备战2022年高考化学真题及地市好题专项集训【山东专用】辽宁省东北育才学校2021-2022学年高二上学期期中考试化学试题2021年山东高考化学试题变式题11-20(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点09 化学反应原理综合-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷17题 化学反应原理综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)第20讲 化学平衡常数及转化率的计算(练)-2023年高考化学一轮复习讲练测(新教材新高考)山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题(已下线)第三部分 化学反应原理综合 综合提能训练(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)专题15 化学反应原理综合题-2023年高考化学真题题源解密(全国通用)
试卷分析
整体难度:适中
考查范围:化学与STSE、有机化学基础、物质结构与性质、化学实验基础、常见无机物及其应用、化学反应原理、认识化学科学
试卷题型(共 20题)
题型
数量
单选题
11
多选题
4
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 大气污染的治理原理及方法 能源开发利用新理念 煤的综合利用 | |
| 2 | 0.65 | 乙炔的加聚反应 氢键对物质性质的影响 分子晶体 石墨、金刚石和C60 | |
| 3 | 0.85 | 常用仪器及使用 化学实验基础操作 蒸馏与分馏 萃取和分液 | |
| 4 | 0.4 | 同周期元素性质递变规律 金属与非金属在周期表中位置及其性质递变的规律 根据物质性质进行元素种类推断 电离能变化规律 | |
| 5 | 0.65 | 硝酸的强氧化性 几种铁的氧化物的化学性质 盐类水解的原理 亚硫酸及其盐 | |
| 6 | 0.65 | 阿伏加德罗定律及其推论 基于氧化还原反应守恒规律的计算 | |
| 7 | 0.65 | 二氧化硅的化学性质 蔗糖水解相关实验 | |
| 8 | 0.4 | 二氧化硫的化学性质 物质分离、提纯综合应用 物质制备的探究 亚硫酸及其盐 | |
| 9 | 0.65 | 利用杂化轨道理论判断分子的空间构型 利用杂化轨道理论判断化学键杂化类型 极性分子和非极性分子 氢键对物质性质的影响 | |
| 10 | 0.65 | 原电池电极反应式书写 燃料电池原理及优点 甲醇燃料电池 原电池有关计算 | |
| 14 | 0.65 | 根据△H=生成物的总能量之和-反应物的总能量之和进行计算 活化能及其对反应速率的影响 可逆反应及反应限度 酯化反应的机理 | |
| 二、多选题 | |||
| 11 | 0.65 | 胶体的制备 酸碱中和滴定实验相关仪器 乙酸乙酯制备实验的装置及操作 配制一定物质的量浓度的溶液实验的仪器 | |
| 12 | 0.65 | 根据要求书写同分异构体 单烯烃的加成反应 卤代烃的水解反应 醇的消去反应 | |
| 13 | 0.65 | 氧化还原反应的几组概念 常见氧化剂与还原剂 氧化还原反应的规律 基于氧化还原反应守恒规律的计算 | |
| 15 | 0.4 | 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 弱电解质的电离平衡常数 | |
| 三、解答题 | |||
| 16 | 0.4 | 基态核外电子排布规律 元素性质与电负性的关系 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | 结构与性质 |
| 17 | 0.4 | 有关铁及其化合物转化的流程题型 电解原理的应用实验 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 18 | 0.65 | 酸碱中和滴定实质、原理 常见无机物的制备 探究物质组成或测量物质的含量 物质制备的探究 | 实验探究题 |
| 19 | 0.65 | 酚类的显色反应 醛类的银镜反应 羧酸酯化反应 根据题给物质选择合适合成路线 | 有机推断题 |
| 20 | 0.4 | 盖斯定律及其有关计算 化学平衡的移动及其影响因素 化学平衡的有关计算 | 原理综合题 |



