辽宁省沈阳铁路实验中学2016-2017学年高二下学期期末考试化学试题
辽宁
高二
期末
2017-07-27
431次
整体难度:
适中
考查范围:
认识化学科学、物质结构与性质、常见无机物及其应用、化学与STSE、化学反应原理、化学实验基础
辽宁省沈阳铁路实验中学2016-2017学年高二下学期期末考试化学试题
辽宁
高二
期末
2017-07-27
431次
整体难度:
适中
考查范围:
认识化学科学、物质结构与性质、常见无机物及其应用、化学与STSE、化学反应原理、化学实验基础
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
1. O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2,下列说法正确的是
| A.若生成4.48 L HF,则转移0.8 mol电子 |
| B.还原剂与氧化剂的物质的量之比为1:4 |
| C.氧气是氧化产物 |
| D.除O2外,其余反应物和生成物中均只有极性共价键 |
【知识点】 氧化还原反应基本概念 氧化还原反应有关计算 共价键
您最近一年使用:0次
2017-07-08更新
|
138次组卷
|
2卷引用:河南省漯河市第四高级中学2016-2017学年高一下学期期末考试化学试题
单选题
|
适中(0.65)
名校
解题方法
2. 对中国古代著作涉及化学的叙述,下列解读不正确 的是
| A.《天工开物》中“凡石灰,经火焚炼为用”里的“石灰”指的是Ca(OH)2 |
| B.《黄白第十六》中“曾青涂铁,铁赤如铜”,其“曾青”是可溶性铜盐 |
| C.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3 |
| D.《汉书》中“高奴县有洧水可燃”,这里的“洧水”指的是石油 |
您最近一年使用:0次
2019-09-13更新
|
323次组卷
|
19卷引用:2016届广东省肇庆高三第三次模拟考试理综化学试卷
2016届广东省肇庆高三第三次模拟考试理综化学试卷2017届河北省武邑中学高三上调研四化学试卷江苏省启东中学2016-2017学年高一下学期期终化学试题辽宁省沈阳铁路实验中学2016-2017学年高二下学期期末考试化学试题河北省辛集市第一中学2018届高三上学期第一次月考化学试题河北省衡水中学2018届高三上学期一调考试化学试题安徽省淮北市第一中学2017-2018学年高二上学期第二次月考化学试题新疆阿克苏市农一师中学2018届高三上学期第二次月考化学试题湖北省部分重点高中协作体2018届高三上学期期中联考化学试题黑龙江省哈尔滨师范大学附属中学2018届高三上学期期中考试化学试题安徽省六安市第一中学2018届高三上学期第五次月考化学试题江西省景德镇市第一中学2017-2018学年高一上学期期末考试化学试题湖南省醴陵市第二中学2019届高三上学期第一次月考化学试题【全国百强校】福建省三明市第一中学2019届高三上学期期中考试化学试题吉林省长春市市田家炳实验中学2019届高三上学期12月月考化学试题江西省金溪县第一中学2018届高三假期开学考试化学试题江苏省海安高级中学2019-2020学年高二上学期入学考试化学试题(已下线)课时02 化学与传统文化-2022年高考化学一轮复习小题多维练(全国通用)第30届( 2016年)全国中学生化学竞赛(安徽赛区)初赛试题
单选题
|
适中(0.65)
名校
3. NA 代表阿伏伽德罗常数的值,下列说法正确的是
A.1 L 0.1 mol· NH4Cl溶液中, NH4Cl溶液中, 的数量为0.1 的数量为0.1 |
B.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2 |
| C.1molCl 2 完全反应,转移的电子数一定为 2N A |
| D.14 g 乙烯和丙烯混合气体中的氢原子数为 2N A |
【知识点】 阿伏加德罗常数的应用解读
您最近一年使用:0次
2017-07-07更新
|
79次组卷
|
2卷引用:山东省淄博市淄川中学2016-2017学年高二下学期学分认定(期末)考试化学试题
单选题
|
适中(0.65)
名校
4. 下列分类标准和分类结果不科学 的是
| 选项 | 分类目标 | 分类标准 | 分类结果 |
| A | 化学反应 | 有无离子参加或生成 | 离子反应和非离子反应 |
| B | 有无单质参加或生成 | 氧化还原反应和非氧化还原反应 | |
| C | 化学物质 | 分散质粒子直径的大小 | 胶体、溶液和浊液 |
| D | 化合物在水溶液或熔融状态下能否导电 | 电解质和非电解质 |
| A.A | B.B | C.C | D.D |
【知识点】 无机物质的分类
您最近一年使用:0次
2017-07-08更新
|
345次组卷
|
6卷引用:辽宁省沈阳铁路实验中学2016-2017学年高二下学期期末考试化学试题
单选题
|
适中(0.65)
名校
5. 下列说法正确的是
| A.只含一种元素的物质一定是纯净物 |
| B.金属氧化物一定是碱性氧化物 |
| C.溶于水呈酸性的是酸,呈碱性的是碱 |
| D.向蛋白质溶液中滴加CuSO4溶液产生沉淀属于化学变化 |
您最近一年使用:0次
2017-07-08更新
|
121次组卷
|
2卷引用:福建省龙海市第二中学2016-2017学年高二下学期期末考试化学试题
单选题
|
适中(0.65)
名校
6. 下列离子方程式正确的是
| A.Cl 2 通入水中:Cl 2 +H 2 O == 2H+ +Cl― +ClO― |
| B.用氯化铁溶液腐蚀线路板上的铜:Fe 3+ +Cu == Fe 2+ +Cu 2+ |
| C.Al 与 NaOH 溶液反应:2Al+2OH―== 2AlO 2― +H2 ↑ |
| D.稀硫酸与氢氧化钡溶液混合:2H++SO42―+Ba2+ +2OH― == BaSO4 ↓+2H 2O |
【知识点】 离子方程式的书写解读 离子方程式的正误判断解读
您最近一年使用:0次
2017-07-07更新
|
84次组卷
|
2卷引用:山东省淄博市淄川中学2016-2017学年高二下学期学分认定(期末)考试化学试题
单选题
|
适中(0.65)
名校
7. 有一澄清透明的酸性溶液,可能含有大量Fe3+、Fe2+、Al3+、AlO2-、CO32-、NO3-6种离子中的几种,向溶液中逐滴加入一定量2mol·L-1的NaOH溶液的过程中,开始没有沉淀,而后有沉淀,沉淀达最大量后继续滴加NaOH溶液沉淀部分消失。
下列判断正确的是选项顺序
下列判断正确的是选项顺序
| A.一定不含Fe3+和Fe2+ |
| B.一定含有Fe3+,但一定不含Fe2+ |
| C.一定含有Al3+,Fe2+、Fe2+含有一种或两种 |
| D.溶液可能含有NO3- |
【知识点】 离子反应在化合物组成的分析、鉴定的应用解读
您最近一年使用:0次
单选题
|
适中(0.65)
名校
8. 同温同压下,x g甲气体和y g乙气体占有相同的体积,根据阿伏伽德罗定律判断,x:y的值可以表示( )
| A.甲与乙的物质的量之比 |
| B.等质量的甲与乙的分子个数之比 |
| C.同温同压下,甲与乙的密度之比 |
| D.同温同体积下,等质量的甲与乙的压强之比 |
【知识点】 物质的量有关计算
您最近一年使用:0次
2017-06-30更新
|
73次组卷
|
2卷引用:江西省南昌市三校(南昌一中、南昌十中、南铁一中)2016-2017学年高二下学期期末联考化学试题
单选题
|
适中(0.65)
名校
9. 下列各组离子在指定溶液中,一定能大量共存的是
| A.pH = 0的溶液中:Na+、AlO2-、K+ 、NH4+ |
| B.既能与酸反应又能与碱反应的溶液中:Cl- 、HCO3-、 NH4+、SO32- |
| C.加入铝能放出H2的溶液中:Mg2+、 NH4+、 Cl-、SO42- |
| D.滴加石蕊试液显蓝色的溶液:K+ 、Ba2+ 、NO3- 、OH- |
【知识点】 限定条件下的离子共存解读
您最近一年使用:0次
2017-06-29更新
|
69次组卷
|
2卷引用:河南省安阳市第三十六中学2016-2017学年高一5月月考化学试题
单选题
|
适中(0.64)
名校
10. 菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有+5价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的+3价砷。下列说法中,正确的是( )
| A.在该反应中维生素C作催化剂 |
| B.由上述信息可推知砒霜中含有的砷是+3价的 |
| C.因为河虾中含有砷元素,所以不能食用 |
| D.上述反应中维生素C作氧化剂 |
【知识点】 氧化还原反应
您最近一年使用:0次
2016-12-09更新
|
964次组卷
|
20卷引用:2010年黑龙江大庆实验中学高一上学期期中考试化学试卷
(已下线)2010年黑龙江大庆实验中学高一上学期期中考试化学试卷(已下线)2015届福建省四地六校高三上学期第一次月考化学试卷(已下线)2015届山西省忻州第一中学高三上学期期中考试化学试卷2015届河北省衡水冀州中学高三12月月考化学试卷2016届山东省青岛市第五十八中高三上学期10月月考化学试卷黑龙江省肇东市第一中学2016-2017学年高二下学期期中考试化学试题辽宁省沈阳铁路实验中学2016-2017学年高二下学期期末考试化学试题陕西省黄陵中学高新部2018届高三上学期开学考试化学试题四川省乐山沫若中学2017-2018学年高一上学期第二次月考(12月)化学试题山东省济南市历城区第二中学2017-2018学年高一上学期期中考试化学试题新疆克拉玛依市第十三中学2018-2019学年高一上学期第二次月考化学试题人教版(2019)高一必修第一册第一章 物质及其变化 素养拓展区高一必修第一册(苏教2019版)专题3 B 素养拓展区 过综合 专题素养综合检测山东省滨州市博兴县第三中学2020-2021学年高一上学期10月月考化学试题山东省淄博市沂源县第二中学2021-2022学年高一上学期第一次月考化学试题云南省腾冲市第一中学2021-2022学年高一下学期3月份考试化学试题吉林省德惠市实验中学2022-2023学年高一上学期第一次月考化学试题湖南省长沙市长郡中学2023-2024学年高一上学期第一次月考化学试题广西南宁市沛鸿民族中学2023-2024学年高一上学期10月月考化学试题安徽省芜湖市无为襄安中学2023-2024学年高一上学期11月期中化学试题
单选题
|
适中(0.65)
名校
11. 中科大陈乾旺教授等人发明 合成金刚石的新方法,化学原理为:①
合成金刚石的新方法,化学原理为:①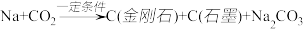 (未配平)该方法比1955年人工首次制得金刚石的旧方法容易得多。②
(未配平)该方法比1955年人工首次制得金刚石的旧方法容易得多。② 。以下表述正确的是
。以下表述正确的是
 合成金刚石的新方法,化学原理为:①
合成金刚石的新方法,化学原理为:①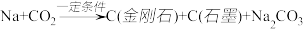 (未配平)该方法比1955年人工首次制得金刚石的旧方法容易得多。②
(未配平)该方法比1955年人工首次制得金刚石的旧方法容易得多。② 。以下表述正确的是
。以下表述正确的是| A.反应①中既有旧化学键的断裂又有新化学键的形成 |
| B.新方法利用的是物理变化,旧方法利用的是化学变化 |
C.在反应①中每生成 金刚石需要消耗 金刚石需要消耗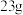 金属钠 金属钠 |
| D.反应①和反应②中所得的金刚石都是还原产物 |
【知识点】 氧化还原反应的应用 化学键与化学反应中的能量关系解读
您最近一年使用:0次
2017-06-28更新
|
86次组卷
|
3卷引用:福建省莆田市第七中学2016-2017学年高二下学期第二次月考化学试题
单选题
|
适中(0.65)
名校
12. 下列说法不正确的是
①FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能从含Cu2+的溶液中置换出铜
②室温下,不能将浓硫酸盛放在铁桶中 ③K+、Fe3+、NO3-、SCN﹣在水溶液中能大量共存
④因氧化铁能与酸反应,可用于制作红色涂料 ⑤将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液观察溶液是否变红,可检验Fe(NO3)2晶体是否已氧化变质.
①FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能从含Cu2+的溶液中置换出铜
②室温下,不能将浓硫酸盛放在铁桶中 ③K+、Fe3+、NO3-、SCN﹣在水溶液中能大量共存
④因氧化铁能与酸反应,可用于制作红色涂料 ⑤将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液观察溶液是否变红,可检验Fe(NO3)2晶体是否已氧化变质.
| A.仅①②③ | B.仅①③④ | C.仅②④⑤ | D.全部 |
您最近一年使用:0次
2017-07-04更新
|
185次组卷
|
4卷引用:河北省承德市第二中学2016-2017学年高二下学期第一次月考化学试题
单选题
|
适中(0.65)
名校
13. 用类推的方法可能会得出错误结论,因此推出的结论要经过实践的检验才能确定其正确与否。下列推论中正确的是
A.Na失火不能用 灭火,K失火也不能用 灭火,K失火也不能用 灭火 灭火 |
B.工业上电解熔融 制取金属镁,也可以用电解熔融 制取金属镁,也可以用电解熔融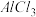 的方法制取金属铝 的方法制取金属铝 |
C.Al与S直接化合可以得到 与S直接化合也可以得到 与S直接化合也可以得到 |
D. 可以写成 可以写成 也可写成 也可写成 |
您最近一年使用:0次
2017-07-04更新
|
290次组卷
|
3卷引用:河北省承德市第二中学2016-2017学年高二下学期第一次月考化学试题
单选题
|
适中(0.65)
名校
解题方法
14. 已知氧化性强弱顺序:Cl2> Br2> Fe3+>I2。下列反应不能发生的是
| A.Br2+2I-= I2+2 Br- | B.2FeCl2+Cl2 = 2FeCl3 |
| C.2FeCl2+2HCl+I2 = 2FeCl3+2HI | D.2Fe3+ + 2I-= 2Fe2+ + I2 |
您最近一年使用:0次
2016-09-06更新
|
486次组卷
|
10卷引用:2016届黑龙江省哈尔滨师大附中高三上开学考试化学试卷
2016届黑龙江省哈尔滨师大附中高三上开学考试化学试卷辽宁省沈阳铁路实验中学2016-2017学年高二下学期期末考试化学试题黑龙江省哈尔滨市第六中学2017-2018学年高一上学期期中考试化学试题内蒙古赤峰市宁城县2017-2018学年高一上学期期末考试化学试题广西桂林中学2017-2018学年高一上学期期中考试化学试题河南省漯河市实验高中2019-2020学年高一上学期期中考试化学试题宁夏回族自治区石嘴山市平罗中学2019-2020学年高一上学期第三次月考化学试题广东省高州市长坡中学2021-2021学年高一10月月考化学试题卷一 物质及其变化 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末复习检测卷 湖南省邵东市创新学校2023-2024学年高一上学期特训班月考化学试卷
单选题
|
适中(0.65)
名校
15. 下列说法正确的是
| A.等质量的铝分别与足量Fe2O3或Fe3O4发生铝热反应时,转移电子的数目相等 |
| B.质量分数分别为40%和60%的硫酸溶液等体积混合,所得溶液的质量分数为50% |
| C.金属钠着火时,立即用泡沫灭火器灭火 |
| D.洗涤做焰色反应的铂丝,可选用稀盐酸或稀硫酸 |
您最近一年使用:0次
2017-05-29更新
|
288次组卷
|
4卷引用:辽宁省沈阳铁路实验中学2016-2017学年高二下学期期末考试化学试题
单选题
|
适中(0.65)
名校
16. 物质 R2CO3 的饱和溶液 V mL,密度为 ρ g·cm-3 , R+的物质的量浓度为 c mol·L-1 ,溶质的质量分数为 a% ,溶质的相对分子量为 M,溶质的溶解度为 s g。则下列表达式正确的是
A. | B. |
C.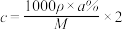 | D.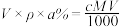 |
您最近一年使用:0次
2017-07-24更新
|
180次组卷
|
2卷引用:2016届黑龙江省哈尔滨师大附中高三上开学考试化学试卷
单选题
|
适中(0.65)
名校
解题方法
17. 为了比较铁和铜金属活动性强弱,某研究小组的同学设计了如下一些方案,并将实验结果记录如下:
能根据以上各种现象或产物证明铁的金属活动性比铜强的方案一共有( )
| 方案 | 现象或产物 | ||
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 | ||
| ②将铁丝和铜丝分别在氯气中燃烧 | 产物分别为FeCl3和CuCl2 | ||
| ③将铁片和铜片分别放入热浓硫酸中 | 产物分别为Fe2(SO4)3和CuSO4 | ||
| ④将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡,铜片上不产生气泡 | ||
| ⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 | ||
| A.2种 | B.3种 | C.4种 | D.5种 |
您最近一年使用:0次
2016-01-14更新
|
571次组卷
|
12卷引用:2016届辽宁省实验中学分校高三上期中测试理综化学试卷
2016届辽宁省实验中学分校高三上期中测试理综化学试卷2017届宁夏固原市第一中学高三下学期第二次模拟考试理综化学试卷广西钦州市钦州港经济技术开发区中学2016-2017学年高一下学期期中考试化学试题陕西省西藏民族学院附属中学2016-2017学年高一下学期期中考试化学试题河北省衡水中学2016-2017学年高一下学期期末考试化学试题辽宁省沈阳铁路实验中学2016-2017学年高二下学期期末考试化学试题山东省淄博第一中学2018届高三上学期开学考试化学试题海南省桥中三亚学校2019届高三上学期第二次月考化学试题(已下线)课时18 铜及其化合物 合金-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点16 铜及其金属材料-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第07练 铁及其化合物-2023年高考化学一轮复习小题多维练(全国通用)(已下线)考点16 铜及其金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
单选题
|
容易(0.94)
名校
18. 在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(I)随新物质加入量(m)的变化曲线。

以下4个导电性实验,其中与图Ⅰ、图Ⅱ、图Ⅲ对应一致的选项是
①Ba(OH)2溶液中滴入H2SO4溶液至过量
②醋酸溶液中滴入NH3·H2O至过量
③澄清石灰水中通入CO2至过量
④NH4Cl溶液中逐渐加入适量NaOH固体

以下4个导电性实验,其中与图Ⅰ、图Ⅱ、图Ⅲ对应一致的选项是
①Ba(OH)2溶液中滴入H2SO4溶液至过量
②醋酸溶液中滴入NH3·H2O至过量
③澄清石灰水中通入CO2至过量
④NH4Cl溶液中逐渐加入适量NaOH固体
| 图I | 图II | 图III | |
| A | ① | ② | ③ |
| B | ④ | ②③ | ① |
| C | ③ | ①② | ④ |
| D | ② | ①③ | ④ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
19. 向3mol·L-1盐酸中加入打磨后的镁条,一段时间后生成灰白色固体X,并测得反应后溶液pH升高。为确认固体X的成分,过滤洗涤后进行实验:
①向固体X中加入足量硝酸,固体溶解,得到无色溶液,将其分成两等份;②向其中一份无色溶液中加入足量AgNO3溶液,得到白色沉淀a;③向另一份无色溶液中加入足量NaOH溶液,得到白色沉淀b。下列分析不正确 的是( )
①向固体X中加入足量硝酸,固体溶解,得到无色溶液,将其分成两等份;②向其中一份无色溶液中加入足量AgNO3溶液,得到白色沉淀a;③向另一份无色溶液中加入足量NaOH溶液,得到白色沉淀b。下列分析
| A.溶液pH升高的主要原因:Mg + 2H+ === Mg2+ + H2↑ |
| B.生成沉淀a的离子方程式:Ag+ + Cl- === AgCl↓ |
| C.沉淀b是Mg(OH)2 |
| D.若a、b的物质的量关系为n(a):n(b) = 1:3,则可推知固体X的化学式为Mg3(OH)6Cl |
您最近一年使用:0次
2017-05-22更新
|
274次组卷
|
3卷引用:辽宁省沈阳铁路实验中学2016-2017学年高二下学期期末考试化学试题
单选题
|
适中(0.65)
名校
20. 已知25℃时,Ksp[Mg(OH)2] =5.61×l0-12,Ksp[Al(OH)3] =1.3×l0-33,Al(OH)3 AlO2-+H++H2O Ka=6.31×l0-13。某溶液中可能含有 H+、Na+、Mg2+、Al3+、Cl-、HCO3-等离子。向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列有关说法正确的是
AlO2-+H++H2O Ka=6.31×l0-13。某溶液中可能含有 H+、Na+、Mg2+、Al3+、Cl-、HCO3-等离子。向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列有关说法正确的是
 AlO2-+H++H2O Ka=6.31×l0-13。某溶液中可能含有 H+、Na+、Mg2+、Al3+、Cl-、HCO3-等离子。向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列有关说法正确的是
AlO2-+H++H2O Ka=6.31×l0-13。某溶液中可能含有 H+、Na+、Mg2+、Al3+、Cl-、HCO3-等离子。向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列有关说法正确的是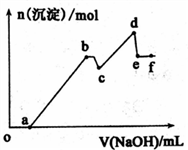
| A.b 点沉淀—Al(OH)3;d 点沉淀—A1(OH)3和Mg(OH)2;e点溶质—NaA1O2 |
| B.依据题意,用NaOH不能完全分离Mg2+和Al3+离子 |
| C.cd 段发生的反应为:Mg2+ +2OH- =Mg(OH)2↓ |
| D.bc 段发生的反应为:Al(OH)3+OH-=A1O2-+2H2O |
您最近一年使用:0次
2017-05-13更新
|
218次组卷
|
2卷引用:山东省济宁市2017届高三第二次模拟考试理综化学试题
二、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
21. KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。
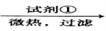

回答下列问题:
(1)为尽量少引入杂质,试剂①应选用NaOH溶液,若选用H2SO4溶液,其后果是________________________ 。
(2)易拉罐溶解过程中主要反应的化学方程式为____________________________ ;滤液A中的某种离子与NH4+、HCO3-均能反应生成沉淀B,该离子与NH4+反应的离子方程式为_____________________________________________ 。
(3)明矾与硫磺焙烧时发生反应的化学方程式为:KAl(SO4)2·12H2O+S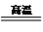 K2SO4+Al2O3+SO2↑+H2O(未配平),配平后的化学计量数依次为
K2SO4+Al2O3+SO2↑+H2O(未配平),配平后的化学计量数依次为___________________________ ;每生成67.2L标准状况下的SO2,转移电子的物质的量为________ ;焙烧产生的SO2经催化氧化、吸收等过程可制得硫酸,若SO2催化氧化时的转化率为96.0%,则理论上用该法生成硫酸时硫元素的总转化率为__________ 。
(4)实验室需要用1mol/L的KAl(SO4)2溶液225ml,用明矾配制用到的玻璃仪器有____________________________________ 。
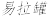
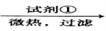

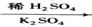
回答下列问题:
(1)为尽量少引入杂质,试剂①应选用NaOH溶液,若选用H2SO4溶液,其后果是
(2)易拉罐溶解过程中主要反应的化学方程式为
(3)明矾与硫磺焙烧时发生反应的化学方程式为:KAl(SO4)2·12H2O+S
 K2SO4+Al2O3+SO2↑+H2O(未配平),配平后的化学计量数依次为
K2SO4+Al2O3+SO2↑+H2O(未配平),配平后的化学计量数依次为(4)实验室需要用1mol/L的KAl(SO4)2溶液225ml,用明矾配制用到的玻璃仪器有
您最近一年使用:0次
三、解答题 添加题型下试题
解答题-实验探究题
|
较难(0.4)
名校
解题方法
22. 某化学学习小组欲探究铁及其化合物的氧化性和还原性。请你协助他们完成实验报告。
(1)实验目的:探究铁及其化合物的氧化性和还原性
(2)实验试剂及仪器:
试剂:氯化亚铁溶液、氯化铁溶液、氯水、KSCN溶液、铁粉、锌片、铜片、稀硫酸
仪器:胶头滴管外,你认为本实验必不可少的一种玻璃仪器是 。
(3)实验记录(在仿照①实验作答,划线部分不必填写)
(4)学习小组的同学将从本实验中获得的知识推广到其他类物质的学习,请判断下列物质既有氧化性又有还原性的是
A、Cl2 B、Na C、Mg2+ D、H2O2
(5)在实验②中,有部分同学在氯化亚铁溶液中滴入KSCN溶液后,就出现了血红色,你认为是什么原因: ;
你将对实验员在配制氯化亚铁溶液时,提出的建议是 。
(6)在配制氯化铁溶液时,由于实验员失误,可能导致溶液中含有少量的Fe2+,为帮助实验员进行检验少量Fe2+的存在,请从下列物质中选择合适的试剂( )
A、KSCN溶液 B、稀盐酸 C、KMnO4 溶液 D、NaOH溶液
(1)实验目的:探究铁及其化合物的氧化性和还原性
(2)实验试剂及仪器:
试剂:氯化亚铁溶液、氯化铁溶液、氯水、KSCN溶液、铁粉、锌片、铜片、稀硫酸
仪器:胶头滴管外,你认为本实验必不可少的一种玻璃仪器是 。
(3)实验记录(在仿照①实验作答,划线部分不必填写)
| 序号 | 实验设计 | 实验观察(主要现象) | 离子方程式 | 解释与结论 |
| ① | 在铁粉中滴 入稀硫酸 | 铁粉溶解,溶液由无 色变成浅绿色,有无 色无味的的气体生成 | Fe +2H+= H2↑+ Fe2+ | Fe具有还原性 |
② | 氯化亚铁溶液中滴入KSCN溶液,再加入氯水 | 滴入KSCN溶液无明 显变化,加入氯水立 即变成血红色 | ||
| ③ | 氯化亚铁溶液加 入锌片 | Fe2++ Zn =" Fe" + Zn 2+ | ||
④ | Fe3+具有氧化性 |
A、Cl2 B、Na C、Mg2+ D、H2O2
(5)在实验②中,有部分同学在氯化亚铁溶液中滴入KSCN溶液后,就出现了血红色,你认为是什么原因: ;
你将对实验员在配制氯化亚铁溶液时,提出的建议是 。
(6)在配制氯化铁溶液时,由于实验员失误,可能导致溶液中含有少量的Fe2+,为帮助实验员进行检验少量Fe2+的存在,请从下列物质中选择合适的试剂( )
A、KSCN溶液 B、稀盐酸 C、KMnO4 溶液 D、NaOH溶液
您最近一年使用:0次
2016-12-09更新
|
647次组卷
|
4卷引用:2012-2013学年福建省四地六校高一第三次月考化学试卷
(已下线)2012-2013学年福建省四地六校高一第三次月考化学试卷(已下线)2012-2013学年山东省聊城市高一上学期七校联考期末检测化学试卷四川省遂宁市2016-2017学年高一上学期教学水平监测化学试题辽宁省沈阳铁路实验中学2016-2017学年高二下学期期末考试化学试题
四、填空题 添加题型下试题
填空题
|
较易(0.85)
名校
23. A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:

(1)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体,写出④反应的离子方程式_____________ ;⑤反应的离子方程式______________ ;
(2)若A是应用最广泛的金属,④反应用到A,②⑤反应均用到同一种黄绿色气体单质。写出A与水反应的化学方程式__________________ 。④反应的离子方程式___________________ ;
D中加入氢氧化钠的现象是_____________________ 。

(1)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体,写出④反应的离子方程式
(2)若A是应用最广泛的金属,④反应用到A,②⑤反应均用到同一种黄绿色气体单质。写出A与水反应的化学方程式
D中加入氢氧化钠的现象是
您最近一年使用:0次
五、解答题 添加题型下试题
解答题-无机推断题
|
适中(0.65)
名校
解题方法
24. 某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:

据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是____________ 。
(2)根据上述框图反应关系,写出下列B、D、E所含物质的化学式
固体B_________________ ;沉淀D __________________ ;
溶液E_________________________________________ 。
(3)写出①、④两个反应的化学方程式
①__________________________________ ;④_____________________________ 。
(4)写出②、③两个反应的离子方程式
②_________________________________ ;③______________________________ 。
(5)分别写出Al2O3和Fe2O3在工业上的一种主要用途:
Al2O3__________________________ Fe2O3____________________________ 。

据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是
(2)根据上述框图反应关系,写出下列B、D、E所含物质的化学式
固体B
溶液E
(3)写出①、④两个反应的化学方程式
①
(4)写出②、③两个反应的离子方程式
②
(5)分别写出Al2O3和Fe2O3在工业上的一种主要用途:
Al2O3
您最近一年使用:0次
六、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
25. 铜是生物体必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出H2O2和稀硫酸的混合溶液与金属铜反应的离子方程式:____________________________________ 。
(2)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,该反应的氧化剂是
6Cu+SO2↑,该反应的氧化剂是________ ;当生成19.2 g Cu 时,反应中转移的电子为________ mol。
(3)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。称取a g试样配成 100 mL 溶液,取出25.00 mL溶液,向其中滴加 KI 溶液后有白色沉淀生成(发生的反应为2Cu2++4I-===2CuI↓+I2);继续滴加 KI 溶液至沉淀不再产生,反应生成的 I2 与V mL c mol·L-1Na2S2O3溶液恰好完全反应(发生的反应为I2+2Na2S2O3===2NaI+Na2S4O6)。则试样中CuSO4·5H2O的质量分数为_________________ 。
(1)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出H2O2和稀硫酸的混合溶液与金属铜反应的离子方程式:
(2)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S
 6Cu+SO2↑,该反应的氧化剂是
6Cu+SO2↑,该反应的氧化剂是(3)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。称取a g试样配成 100 mL 溶液,取出25.00 mL溶液,向其中滴加 KI 溶液后有白色沉淀生成(发生的反应为2Cu2++4I-===2CuI↓+I2);继续滴加 KI 溶液至沉淀不再产生,反应生成的 I2 与V mL c mol·L-1Na2S2O3溶液恰好完全反应(发生的反应为I2+2Na2S2O3===2NaI+Na2S4O6)。则试样中CuSO4·5H2O的质量分数为
您最近一年使用:0次
2017-03-29更新
|
107次组卷
|
3卷引用:2016-2017学年广西桂林市桂林中学高一下学期开学考试化学试卷
2016-2017学年广西桂林市桂林中学高一下学期开学考试化学试卷辽宁省沈阳铁路实验中学2016-2017学年高二下学期期末考试化学试题(已下线)微专题15 铜及其化合物的性质、制备与实验探究-备战2022年高考化学考点微专题
试卷分析
整体难度:适中
考查范围:认识化学科学、物质结构与性质、常见无机物及其应用、化学与STSE、化学反应原理、化学实验基础
试卷题型(共 25题)
题型
数量
单选题
20
填空题
3
解答题
2
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 氧化还原反应基本概念 氧化还原反应有关计算 共价键 | |
| 2 | 0.65 | 硫酸铜 化学科学对人类文明发展的意义 石油物理性质及组成成分 | |
| 3 | 0.65 | 阿伏加德罗常数的应用 | |
| 4 | 0.65 | 无机物质的分类 | |
| 5 | 0.65 | 酸、碱、盐、氧化物的概念及其相互联系 物理变化与化学变化 | |
| 6 | 0.65 | 离子方程式的书写 离子方程式的正误判断 | |
| 7 | 0.65 | 离子反应在化合物组成的分析、鉴定的应用 | |
| 8 | 0.65 | 物质的量有关计算 | |
| 9 | 0.65 | 限定条件下的离子共存 | |
| 10 | 0.64 | 氧化还原反应 | |
| 11 | 0.65 | 氧化还原反应的应用 化学键与化学反应中的能量关系 | |
| 12 | 0.65 | 浓硫酸的强氧化性 Fe2+的还原性 铁盐的检验 Fe3+与其他物质氧化性强弱关系 | |
| 13 | 0.65 | 硫与金属单质的反应 碳族元素简介 钠的化学性质 电解法制取铝 | |
| 14 | 0.65 | 氧化性、还原性强弱的比较 氧化还原反应的应用 氧化还原反应的规律 | |
| 15 | 0.65 | 物质的量有关计算 钠 焰色试验 | |
| 16 | 0.65 | 物质的量有关计算 物质的量浓度的计算 结合气体物质与NA相关推算 根据n=m/M进行相关计算 以N=m·NA/M为中心的有关基本粒子的推算 化学方程式计算中物质的量的运用 依据物质的量浓度公式的基础计算 | |
| 17 | 0.65 | 元素金属性、非金属性强弱探究实验 物质性质的探究 物质性质实验方案的设计 | |
| 18 | 0.94 | 电解质与非电解质 电解质的电离 物质水溶液的导电性 | |
| 19 | 0.65 | 离子反应的实际应用 离子反应在化合物组成的分析、鉴定的应用 氯离子的检验 镁原子的结构与化学性质 | |
| 20 | 0.65 | 含镁化合物 氢氧化铝与强酸反应 氢氧化铝与强碱反应 既能与酸反应又能与碱反应的无机物质 | |
| 二、填空题 | |||
| 21 | 0.65 | 氧化还原反应有关计算 氧化还原反应方程式的配平 铝 氧化铝 氢氧化铝 其他含铝化合物 铝的物理性质及用途 铝与酸溶液反应 铝与强碱溶液反应 氧化铝与酸反应 氧化铝与碱溶液反应 氢氧化铝的物理性质及用途 氢氧化铝的制备 氢氧化铝与强酸反应 氢氧化铝与强碱反应 既能与酸反应又能与碱反应的无机物质 钠单质与铝盐溶液反应相关分析及判断 铝盐与强碱溶液反应 铝三角转化 | |
| 23 | 0.85 | 铝 氧化铝 氢氧化铝 其他含铝化合物 铝三角转化 铁 氢氧化铁 氢氧化亚铁 亚铁盐 铁盐 与“铁三角”有关的推断 | |
| 25 | 0.65 | 铜 铜的其他化合物 | |
| 三、解答题 | |||
| 22 | 0.4 | 化学实验探究 物质性质的探究 实验方案设计的基本要求 物质性质实验方案的设计 | 实验探究题 |
| 24 | 0.65 | 离子方程式的书写 无机综合推断 氧化铝与碱溶液反应 铝三角转化 | 无机推断题 |



