按要求回答下列问题:
(1)胶体是一种常见的分散系,将饱和三氯化铁溶液滴入沸水时,得到的液体是______ 色,反应的化学方程式为_______ 。
(2)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2已知该反应中H2O2只发生如下过程:H2O2→O2
①该反应中的氧化剂是________ ,
②该反应中,发生还原反应的过程是___→_____,_____ 。
③写出该反应的化学方程式___________ 。
(1)胶体是一种常见的分散系,将饱和三氯化铁溶液滴入沸水时,得到的液体是
(2)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2已知该反应中H2O2只发生如下过程:H2O2→O2
①该反应中的氧化剂是
②该反应中,发生还原反应的过程是___→_____,
③写出该反应的化学方程式
更新时间:2024/02/24 20:27:08
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下,有下列10种物质:① 、②
、② 溶液、③
溶液、③ 、④
、④ 、⑤
、⑤ 溶液、⑥氨水、⑦
溶液、⑥氨水、⑦ 、⑧
、⑧ 、⑨
、⑨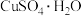 和⑩
和⑩ 胶体。请按要求填空。
胶体。请按要求填空。
(1)上述物质中属于强电解质的有___________ (填序号,下同),在该条件下能导电的有___________ 。
(2)实验室制备⑩的化学方程式___________ ,向制备的⑩中逐滴加入②的实验现象为___________ 。
(3)把盛有⑤和⑩的烧杯置于暗处,用红色激光笔照射烧杯中的液体,在与光束___________ (填“平行”或“垂直”)的方向进行观察。当光束通过⑩时,可以看到一条光亮的“通路”,而光束通过⑤时,则看不到此现象。这条光亮的“通路”是由于⑩中粒子对光线___________ (填“反射”或“散射”或“透射”)。
(4)实验室可用⑦与浓盐酸制备 。其反应方程式为:
。其反应方程式为: 用双线桥法表示电子转移的方向和数目
用双线桥法表示电子转移的方向和数目___________ 。
 、②
、② 溶液、③
溶液、③ 、④
、④ 、⑤
、⑤ 溶液、⑥氨水、⑦
溶液、⑥氨水、⑦ 、⑧
、⑧ 、⑨
、⑨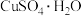 和⑩
和⑩ 胶体。请按要求填空。
胶体。请按要求填空。(1)上述物质中属于强电解质的有
(2)实验室制备⑩的化学方程式
(3)把盛有⑤和⑩的烧杯置于暗处,用红色激光笔照射烧杯中的液体,在与光束
(4)实验室可用⑦与浓盐酸制备
 。其反应方程式为:
。其反应方程式为: 用双线桥法表示电子转移的方向和数目
用双线桥法表示电子转移的方向和数目
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】Ⅰ.(1)实验室常用石灰石与盐酸反应制取CO2,请写出该反应的离子方程式__________ 。
(2)实验室常用锌粒与稀硫酸制取氢气,请写出该反应的离子方程式__________ 。
Ⅱ.(1)实验室常将饱和三氯化铁溶液滴入沸水中继续加热至红褐色制备氢氧化铁胶体,请写出制备氢氧化铁胶体的化学方程式___________ 。
(2)将Fe(OH)3 胶体装入U形管内,用石墨做电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐加深,这表明Fe(OH)3胶体微粒带_________ (填“正”或“负”)电荷。
(3)取少量Fe(OH)3 胶体于试管中,逐滴加入硫酸至过量,可看到的现象是____________ 。
(4)3.4gOH-中有_________ mol OH-,其含有的电子数是_______ 个(阿伏伽德罗常数用NA表示)。在同温同压下CH4和N2组成的混合气体对H2的相对密度为10,则混合气体中CH4与N2的体积比为_____ 。
(2)实验室常用锌粒与稀硫酸制取氢气,请写出该反应的离子方程式
Ⅱ.(1)实验室常将饱和三氯化铁溶液滴入沸水中继续加热至红褐色制备氢氧化铁胶体,请写出制备氢氧化铁胶体的化学方程式
(2)将Fe(OH)3 胶体装入U形管内,用石墨做电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐加深,这表明Fe(OH)3胶体微粒带
(3)取少量Fe(OH)3 胶体于试管中,逐滴加入硫酸至过量,可看到的现象是
(4)3.4gOH-中有
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化剂及军事科学中。所谓“纳米材料”是指研究、开发出的微粒直径从几纳米到几十纳米的材料,如将纳米材料分散到分散剂中,所得混合物可能具有的性质是 ____ 。
A.能全部透过滤纸 B.有丁达尔效应
C.所得液体呈胶状 D.所得物质一定是悬浊液
(2)把淀粉溶液溶于沸水中,制成淀粉胶体,鉴别溶液和淀粉胶体可以利用的方法是______ 。
(3)把少量的FeCl3饱和溶液滴入沸水中,制成Fe(OH)3胶体,回答下列问题:
①写出上述反应的化学方程式_______ 。
②向Fe(OH)3胶体中滴入硫酸直到过量,描述此过程的实验现象_______ 。
A.能全部透过滤纸 B.有丁达尔效应
C.所得液体呈胶状 D.所得物质一定是悬浊液
(2)把淀粉溶液溶于沸水中,制成淀粉胶体,鉴别溶液和淀粉胶体可以利用的方法是
(3)把少量的FeCl3饱和溶液滴入沸水中,制成Fe(OH)3胶体,回答下列问题:
①写出上述反应的化学方程式
②向Fe(OH)3胶体中滴入硫酸直到过量,描述此过程的实验现象
您最近一年使用:0次
【推荐1】世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效、安全杀菌消毒剂,ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,它在食品保鲜、饮用水消毒等方面有着广泛的应用。
(1)实验室制备ClO2的方法之一为: ( H2C2O4俗称草酸,其中H为+1价,O为-2价)则下列说法正确的是 。
( H2C2O4俗称草酸,其中H为+1价,O为-2价)则下列说法正确的是 。
(2) KClO3和浓盐酸在一定温度下反应也会生成绿黄色的二氧化氯。其变化可表示为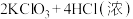
 。
。
①浓盐酸在反应中表现出来的性质是___________ ;
②已知每产生0.1mol Cl2,则发生转移的电子的物质的量为0.2mol。ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒后的还原产物是氯离子,则其消毒的效率(以单位质量得到的电子数表示)是Cl2的______ 倍。(答案保留小数点后两位)
(1)实验室制备ClO2的方法之一为:
 ( H2C2O4俗称草酸,其中H为+1价,O为-2价)则下列说法正确的是 。
( H2C2O4俗称草酸,其中H为+1价,O为-2价)则下列说法正确的是 。| A. KClO3在反应中得到电子 | B. ClO2是氧化产物 |
| C. H2C2O4在反应中被氧化 | D.1mol KClO3参加反应有2mol电子转移 |
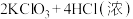
 。
。①浓盐酸在反应中表现出来的性质是
②已知每产生0.1mol Cl2,则发生转移的电子的物质的量为0.2mol。ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒后的还原产物是氯离子,则其消毒的效率(以单位质量得到的电子数表示)是Cl2的
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】氧化还原反应在生产和生活中使用非常广泛。回答下列问题:
(1)氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于区域3的是___________(填字母)。
(2) 外观和食盐相似,又有咸味,容易使人误食中毒。已知
外观和食盐相似,又有咸味,容易使人误食中毒。已知 能发生如下反应:
能发生如下反应: 。
。
①上述反应中氧化剂是___________ (填化学式,下同),氧化产物是___________ ,还原剂和氧化剂的物质的量之比是___________ 。
②若反应中有 (标准状况下)气体生成,则反应中转移电子的物质的量为
(标准状况下)气体生成,则反应中转移电子的物质的量为_____ 。
③某厂废液中,含有 的
的 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为不引起二次污染的
转化为不引起二次污染的 的是
的是___________ (填字母)。
A. B.
B. C.
C. D.浓
D.浓
(3)过氧化氢俗名双氧水,在生产、生活中有多种用途。涉及的化学反应如下:
A.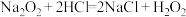
B.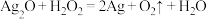
C.
D.
①上述反应中, 仅体现氧化性的是
仅体现氧化性的是___________ (填字母,下同), 既体现氧化性又体现还原性的反应是
既体现氧化性又体现还原性的反应是___________ , 、
、 、
、 的氧化性由强到弱的顺序是
的氧化性由强到弱的顺序是___________ 。
②某酸性反应体系中发生一个氧化还原反应,反应物和生成物共六种微粒: 、
、 、
、 、
、 、
、 、
、 。已知该反应中
。已知该反应中 只发生了如下过程:
只发生了如下过程: 。则该反应的离子方程式为
。则该反应的离子方程式为___________ 。
(1)氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于区域3的是___________(填字母)。

A. |
B.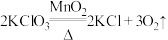 |
C. |
D. |
 外观和食盐相似,又有咸味,容易使人误食中毒。已知
外观和食盐相似,又有咸味,容易使人误食中毒。已知 能发生如下反应:
能发生如下反应: 。
。①上述反应中氧化剂是
②若反应中有
 (标准状况下)气体生成,则反应中转移电子的物质的量为
(标准状况下)气体生成,则反应中转移电子的物质的量为③某厂废液中,含有
 的
的 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为不引起二次污染的
转化为不引起二次污染的 的是
的是A.
 B.
B. C.
C. D.浓
D.浓
(3)过氧化氢俗名双氧水,在生产、生活中有多种用途。涉及的化学反应如下:
A.
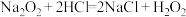
B.
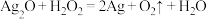
C.

D.

①上述反应中,
 仅体现氧化性的是
仅体现氧化性的是 既体现氧化性又体现还原性的反应是
既体现氧化性又体现还原性的反应是 、
、 、
、 的氧化性由强到弱的顺序是
的氧化性由强到弱的顺序是②某酸性反应体系中发生一个氧化还原反应,反应物和生成物共六种微粒:
 、
、 、
、 、
、 、
、 、
、 。已知该反应中
。已知该反应中 只发生了如下过程:
只发生了如下过程: 。则该反应的离子方程式为
。则该反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
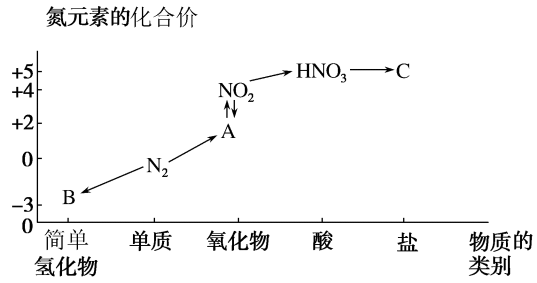
【推荐3】部分含氮物质及所含氮元素的化合价如图所示,试回答下列问题:_______ ,B_______ 。
(2)从N元素的化合价分析, 具有氧化性和还原性,请各举一例说明(用化学方程式表示)。
具有氧化性和还原性,请各举一例说明(用化学方程式表示)。
氧化性:_______ ;
还原性:_______ 。
(3) 与图中的物质C常用于检验
与图中的物质C常用于检验 的存在,则C的化学式为
的存在,则C的化学式为_______ 。
(4)氨是氮肥工业的重要原料。铵态氮肥不能与碱性物质共同施用,原因是_______ (用离子方程式和简单的文字说明)。
(2)从N元素的化合价分析,
 具有氧化性和还原性,请各举一例说明(用化学方程式表示)。
具有氧化性和还原性,请各举一例说明(用化学方程式表示)。氧化性:
还原性:
(3)
 与图中的物质C常用于检验
与图中的物质C常用于检验 的存在,则C的化学式为
的存在,则C的化学式为(4)氨是氮肥工业的重要原料。铵态氮肥不能与碱性物质共同施用,原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mg·kgˉ1。黄血盐易溶于水,在水溶液中会电离出K+和[Fe(CN)6]4ˉ,其中CNˉ的电子式为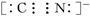 。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O
。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
(1)上述反应是否为氧化还原反应?______ (填“是”或“不是”)。
(2)食盐经长时间火炒,“亚铁氰化钾”名称前的“亚铁”就去掉了,变成了剧毒物质氰化钾,这是因为黄血盐在超过4000C时会分解,试配平该反应的化学方程式:□K4Fe(CN)6 □KCN+□Fe3C+□C+□N2↑
□KCN+□Fe3C+□C+□N2↑__________________________ 。
(3) 黄血盐可与高锰酸钾溶液反应,其化学方程式为
K4Fe(CN)6+ KMnO4+ H2SO4→KHSO4+ Fe2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平)
①该反应的氧化产物有_____________________________ (填化学式)。
②若有1mol K4Fe(CN)6被高锰酸钾氧化,则消耗高锰酸钾的物质的量为____________ mol。
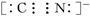 。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O
。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑(1)上述反应是否为氧化还原反应?
(2)食盐经长时间火炒,“亚铁氰化钾”名称前的“亚铁”就去掉了,变成了剧毒物质氰化钾,这是因为黄血盐在超过4000C时会分解,试配平该反应的化学方程式:□K4Fe(CN)6
 □KCN+□Fe3C+□C+□N2↑
□KCN+□Fe3C+□C+□N2↑(3) 黄血盐可与高锰酸钾溶液反应,其化学方程式为
K4Fe(CN)6+ KMnO4+ H2SO4→KHSO4+ Fe2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平)
①该反应的氧化产物有
②若有1mol K4Fe(CN)6被高锰酸钾氧化,则消耗高锰酸钾的物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】ClO2是一种消毒、杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,试回答下列问题。
(1)该反应中氧化产物是_______ ,被还原的元素是________ 。
(2)若反应共产生了0.2mol气体,则反应转移电子的物质的量为________ mol,消耗还原剂的质量为________ g。ClO2的有效氯含______ (有效氯含量指每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力)。
(3)用ClO2气体可去除地下水中Mn2+,生成难溶于水的MnO2,该反应的离子方程式为___________ 。
(1)该反应中氧化产物是
(2)若反应共产生了0.2mol气体,则反应转移电子的物质的量为
(3)用ClO2气体可去除地下水中Mn2+,生成难溶于水的MnO2,该反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】微生物构成的氮的循环如图所示。
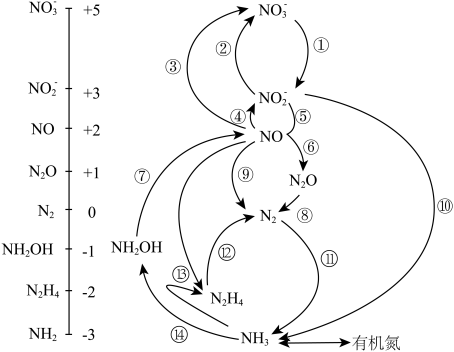
(1)NH3的电子式为___________ ,与N同周期的非金属元素的气态氢化物稳定性最强的为___________ 。
(2)实验室制备NH3的化学方程式为___________ 。检验NH3是否收集满的方法为___________ 。
(3)过程⑬的化学方程式为___________ 。反应中若将H替换成D(氘),当生成20gD2O时,产物中含有的N-D键的数目为___________ NA。
(4)羟胺(NH2OH)的结构式为___________ ,其与H2O2反应可实现⑦的转化,化学方程式为___________ ,为提高反应速率可适当升高温度,但温度过高该反应速率反而降低的原因是___________ 。

(1)NH3的电子式为
(2)实验室制备NH3的化学方程式为
(3)过程⑬的化学方程式为
(4)羟胺(NH2OH)的结构式为
您最近一年使用:0次



