2021·山东·模拟预测
解题方法
1 . 二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水,沸点为11℃。
(1)用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如图所示:
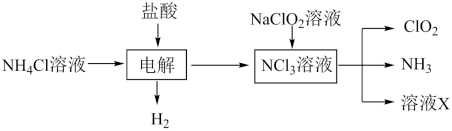
①写出电解时发生反应的化学方程式:___ 。
②ClO2的消毒效率(以转移电子数目的多少为依据)是等物质的量的Cl2的___ 倍。
(2)产品中ClO2含量的测量:向锥形瓶中加入由适量碘化钾、3mL硫酸组成的混合溶液,将上述反应过程中生成的一部分ClO2气体通入锥形瓶中充分反应。再加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定(I2+2 =2I-+S
=2I-+S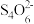 ,通入的气体中不存在能与I2、
,通入的气体中不存在能与I2、 反应的成分),共用去VmL硫代硫酸钠溶液。
反应的成分),共用去VmL硫代硫酸钠溶液。
①请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式:___ 。
②滴定终点的现象是___ 。
③测得通入ClO2的质量m(ClO2)=___ (用含c、V的代数式表示)。
(1)用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如图所示:

①写出电解时发生反应的化学方程式:
②ClO2的消毒效率(以转移电子数目的多少为依据)是等物质的量的Cl2的
(2)产品中ClO2含量的测量:向锥形瓶中加入由适量碘化钾、3mL硫酸组成的混合溶液,将上述反应过程中生成的一部分ClO2气体通入锥形瓶中充分反应。再加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定(I2+2
 =2I-+S
=2I-+S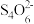 ,通入的气体中不存在能与I2、
,通入的气体中不存在能与I2、 反应的成分),共用去VmL硫代硫酸钠溶液。
反应的成分),共用去VmL硫代硫酸钠溶液。①请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式:
②滴定终点的现象是
③测得通入ClO2的质量m(ClO2)=
您最近半年使用:0次
2021·山东·模拟预测
解题方法
2 . 碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分为MnO2)和黄铁矿(主要成分为FeS2)为主要原料制备碳酸锰的一种工艺流程如图。
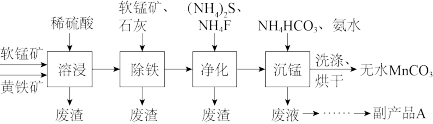
溶浸后的溶液中,阴离子只有 ,则生成
,则生成 的离子方程式为
的离子方程式为___ 。

溶浸后的溶液中,阴离子只有
 ,则生成
,则生成 的离子方程式为
的离子方程式为
您最近半年使用:0次
2021·山东·模拟预测
解题方法
3 . 实验室以锌灰(含ZnO、PbO、CuO、FeO、Fe2O3、SiO2等)为原料制备Zn3(PO4)2·4H2O的流程如图。
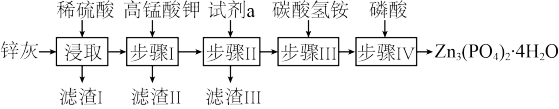
滴加KMnO4溶液后有MnO2生成,该反应的离子方程式为___ 。

滴加KMnO4溶液后有MnO2生成,该反应的离子方程式为
您最近半年使用:0次
2021·山东·模拟预测
解题方法
4 . 钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿制备NH4VO3。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
“酸浸氧化”中,VO+和VO2+被氧化成 ,同时还有
,同时还有__ 离子被氧化。写出VO+转化为 反应的离子方程式
反应的离子方程式___ 。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
| 开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 | 10.1 |
回答下列问题:
“酸浸氧化”中,VO+和VO2+被氧化成
 ,同时还有
,同时还有 反应的离子方程式
反应的离子方程式
您最近半年使用:0次
2021·山东·模拟预测
解题方法
5 . 用软锰矿(主要成分为MnO2,含少量Fe3O4、Al2O3)和BaS制备高纯MnCO3的工艺流程如图:
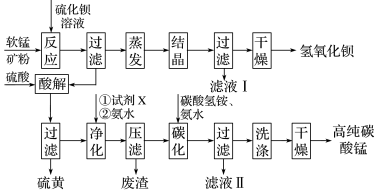
回答下列问题:MnO2与BaS溶液反应转化为MnO的化学方程式为___ 。

回答下列问题:MnO2与BaS溶液反应转化为MnO的化学方程式为
您最近半年使用:0次
名校
解题方法
6 . 白银(Ag)是高新技术产业的基础材料之一、从一种光盘金属层中回收少量白银(金属层中其它金属含量过低,对实验的影响可忽略)的流程如下:
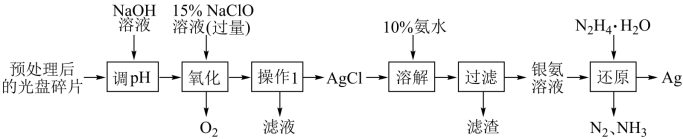
下列叙述不 正确的是

下列叙述
| A.“氧化”阶段需在80℃条件下进行,可用水浴加热 |
| B.“操作1”所用到的玻璃仪器是玻璃棒、烧杯、漏斗 |
| C.若“还原”过程通过原电池来实现,则N2为正极产物 |
D.“还原”过程中参加反应的n[Ag(NH3) ]∶n[N2H4·H2O]=4∶1 ]∶n[N2H4·H2O]=4∶1 |
您最近半年使用:0次
2021-04-26更新
|
995次组卷
|
5卷引用:江苏省徐州市邳州市运河中学2020-2021学年高一下学期期中考试(普通班)化学试题
江苏省徐州市邳州市运河中学2020-2021学年高一下学期期中考试(普通班)化学试题(已下线)2021年高考化学押题预测卷(广东卷)(02)浙江省绍兴市2020-2021学年高二下学期期末调测化学试题河南省南阳市第一中学校2022届高三上学期第四次月考化学试题(已下线)河北省石家庄市2023届高中毕业年级教学质量检测(一模)变式题(选择题11-14)
名校
解题方法
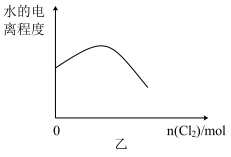
7 . 已知:2Fe2++Br2=2Fe3++2Br﹣,2Fe3++2I﹣=2Fe2++I2.向FeI2、FeBr2的混合溶液中缓缓通入氯气,溶液中某些离子的物质的量变化如图甲所示.下列有关说法中,不正确的是
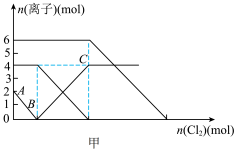


| A.还原性:I﹣>Fe2+>Br﹣ |
| B.随着氯气的通入,溶液中水的电离程度变化趋势如图乙 |
| C.当通入3 mol Cl2时,溶液中发生的离子反应可表示为:4Fe2++2I﹣+3Cl2=4Fe3++I2+6Cl﹣ |
| D.原溶液中:n(Fe2+):n(I﹣):n(Br﹣)=2:1:3 |
您最近半年使用:0次
2021-04-23更新
|
423次组卷
|
2卷引用:四川省成都邛崃市高埂中学2020-2021学年高三下学期第一次月考化学试题
名校
8 . 前四周期元素X、Y、Z、W核电荷数依次增大,核电荷数之和为58;Y原子的M层p轨道有3个未成对电子;Z与Y同周期,且在该周期中电负性最大;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:2。
(1)写出Z元素在元素周期表中的位置:___________ 。
(2) 与X形成共价化合物A,Z与X形成共价化合物B,A与B还原性较强的是
与X形成共价化合物A,Z与X形成共价化合物B,A与B还原性较强的是___________  写分子式
写分子式 。
。
(3) 的最高价氧化物的水化物的化学式为
的最高价氧化物的水化物的化学式为___________ ;
(4) 单质
单质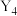 与
与 在一定条件下恰好完全反应生成
在一定条件下恰好完全反应生成 化合物C,一个C分子中所含有的σ键数目为
化合物C,一个C分子中所含有的σ键数目为___________ ;
(5)含W元素的最高化合价的含氧酸根离子是___________ ,该含氧酸根离子在分析化学中有重要作用,在酸性条件下该含氧酸根离子可将 氧化成
氧化成 ,请写出该反应的离子方程式
,请写出该反应的离子方程式___________ 。
(1)写出Z元素在元素周期表中的位置:
(2)
 与X形成共价化合物A,Z与X形成共价化合物B,A与B还原性较强的是
与X形成共价化合物A,Z与X形成共价化合物B,A与B还原性较强的是 写分子式
写分子式 。
。(3)
 的最高价氧化物的水化物的化学式为
的最高价氧化物的水化物的化学式为(4)
 单质
单质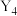 与
与 在一定条件下恰好完全反应生成
在一定条件下恰好完全反应生成 化合物C,一个C分子中所含有的σ键数目为
化合物C,一个C分子中所含有的σ键数目为(5)含W元素的最高化合价的含氧酸根离子是
 氧化成
氧化成 ,请写出该反应的离子方程式
,请写出该反应的离子方程式
您最近半年使用:0次
2021-04-21更新
|
550次组卷
|
5卷引用:2015-2016学年重庆市第八中学高二下第三次月考化学试卷
名校
解题方法
9 . 汽车尾气已成为城市空气的主要污染源,治理汽车尾气的SCR(选择性催化还原)和NSR (NOx储存还原)技术均可有效降低柴油发动机工作过程中排放的NOx。
(1)SCR工作原理
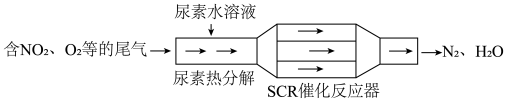
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式是___________ 。
②反应器中NH3还原NO2的化学方程式是___________ 。
(2)NSR(NOx储存还原)的工作原理如下图所示,柴油发动机工作时在稀燃(O2充足、柴油较少)和富燃(O2不足、柴油较多)条件下交替进行,通过BaO和Ba(NO3)2的相互转化实现NOx 的储存和还原。

①BaO吸收NO2的反应中氧化剂与还原剂的物质的量之比是___________ 。
②富燃条件下Pt表面反应的化学方程式是___________ 。
③若柴油中硫含量较高,在稀燃过程中,BaO吸收氮氧化物的能力下降至很低水平,结合化学方程式解释原因:___________ 。
④研究发现:尾气中的CO2对BaO吸收氮氧化物有影响。一定温度下,测得气体中CO2的体积分数与氮氧化物吸收率的关系如下图所示。则:一定范围内,氮氧化物吸收率随CO2体积分数的增大而下降,原因是___________ ;当CO2体积分数达到10%~20%时,氮氧化物吸收率依然较高,原因可能是___________ 。
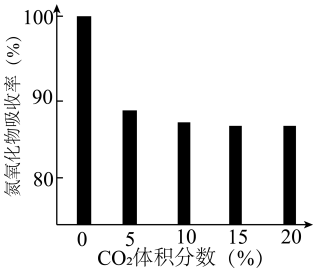
(1)SCR工作原理

①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式是
②反应器中NH3还原NO2的化学方程式是
(2)NSR(NOx储存还原)的工作原理如下图所示,柴油发动机工作时在稀燃(O2充足、柴油较少)和富燃(O2不足、柴油较多)条件下交替进行,通过BaO和Ba(NO3)2的相互转化实现NOx 的储存和还原。

①BaO吸收NO2的反应中氧化剂与还原剂的物质的量之比是
②富燃条件下Pt表面反应的化学方程式是
③若柴油中硫含量较高,在稀燃过程中,BaO吸收氮氧化物的能力下降至很低水平,结合化学方程式解释原因:
④研究发现:尾气中的CO2对BaO吸收氮氧化物有影响。一定温度下,测得气体中CO2的体积分数与氮氧化物吸收率的关系如下图所示。则:一定范围内,氮氧化物吸收率随CO2体积分数的增大而下降,原因是

您最近半年使用:0次
2021-04-17更新
|
649次组卷
|
4卷引用:四川省攀枝花市2021届高三第一次统一考试理科综合化学试题
解题方法
10 . 二氧化硫在生产和生活中有着广泛的用途。SO2可用来制备定影剂Na2S2O3,反应的化学方程式为: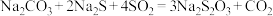 。
。
(1)请用双线桥表示该反应中的电子转移情况,还原剂与氧化剂的物质的量的比_______ 。
(2)用足量NaOH溶液吸收尾气中SO2,反应的离子方程式为:_______ ;吸收后的浓溶液可用如图的装置再生循环脱硫,并制得硫酸,电极a的电极反应为_______ ,乙是_______ 。

(3)可设计二氧化硫空气质子交换膜燃料电池处理尾气中的二氧化硫,原理如图所示。
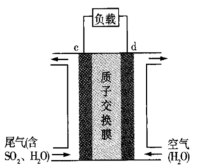
c电极是_______ 极,d电极上发生的电极反应是_______ 。当反应转移0.2mol电子时,消耗的SO2在标准状态下的体积是_______ 。
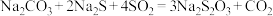 。
。(1)请用双线桥表示该反应中的电子转移情况,还原剂与氧化剂的物质的量的比
(2)用足量NaOH溶液吸收尾气中SO2,反应的离子方程式为:

(3)可设计二氧化硫空气质子交换膜燃料电池处理尾气中的二氧化硫,原理如图所示。

c电极是
您最近半年使用:0次



