名校
解题方法
1 . 活性氧化锌能对太阳光线和其他大气物质形成防护,常用于敏感皮肤的面霜和化妆品。工业上用菱锌矿(主要成分为ZnCO3,还含有Ni、Cd、Fe、Cu等元素及少量不溶于水的杂质)制备ZnO,工艺流程图所示:___________ ,常温下Fe2+比Fe3+更容易被氧化变质,请从结构角度加以解释___________ 。
(2)加入H2O2的目的是___________ ;“调pH”时除ZnO外还可以选用的物质是___________ 。
a.氨水 b.氢氧化铁 c.氢氧化锌
(3)常温下、pH=5时,Fe3+的浓度降到了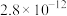 mol/L,此时Fe(OH)3的溶度积常数的数值为
mol/L,此时Fe(OH)3的溶度积常数的数值为___________ 。证明Fe3+已除尽的化学方法是___________ 。
(4)已知沉锌时固体产物是Zn2(OH)2CO3,请写出该过程的离子方程式:___________ 。
(5)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是___________。

(2)加入H2O2的目的是
a.氨水 b.氢氧化铁 c.氢氧化锌
(3)常温下、pH=5时,Fe3+的浓度降到了
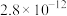 mol/L,此时Fe(OH)3的溶度积常数的数值为
mol/L,此时Fe(OH)3的溶度积常数的数值为(4)已知沉锌时固体产物是Zn2(OH)2CO3,请写出该过程的离子方程式:
(5)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是___________。
| A.粗锌作阳极,纯锌作阴极,电解质溶液是硫酸锌溶液 |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Al3+、Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu |
您最近一年使用:0次
名校
2 . 除去粗盐中的Ca2+、Mg2+、 及泥沙,可先将粗盐溶于水,然后进行下列操作:
及泥沙,可先将粗盐溶于水,然后进行下列操作:
①过滤②加过量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液。正确的操作顺序是
 及泥沙,可先将粗盐溶于水,然后进行下列操作:
及泥沙,可先将粗盐溶于水,然后进行下列操作:①过滤②加过量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液。正确的操作顺序是
| A.①④②⑤③ | B.④①②⑤③ | C.②④⑤①③ | D.⑤②④①③ |
您最近一年使用:0次
2024-04-11更新
|
172次组卷
|
2卷引用:四川省华蓥中学2023-2024学年高一下学期4月月考化学试题
解题方法
3 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含 、
、 、
、 、
、 、
、 、
、 等元素的氧化物)制备,工艺如图所示。回答下列问题:
等元素的氧化物)制备,工艺如图所示。回答下列问题:

相关金属离子[起始浓度为 ]形成氢氧化物沉淀的
]形成氢氧化物沉淀的 范围如表:
范围如表:
(1)“滤渣1”含有 和
和___________ 。
(2)“氧化”中添加适量的 的作用是将
的作用是将 氧化为
氧化为 ,写出该反应的离子方程式为
,写出该反应的离子方程式为___________ 。
(3)调 范围为4.7~6,滤渣2成分的化学式为
范围为4.7~6,滤渣2成分的化学式为___________ 。
(4)“除杂1”的目的是除去 和
和 ,“滤渣3”的主要成分是
,“滤渣3”的主要成分是___________ 。
(5)“除杂2”的目的是生成 沉淀除去
沉淀除去 。若溶液酸度过高,
。若溶液酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是___________ (从沉淀溶解平衡角度解释)。
(6)写出“沉锰”的离子方程式___________ 。
 、
、 、
、 、
、 、
、 、
、 等元素的氧化物)制备,工艺如图所示。回答下列问题:
等元素的氧化物)制备,工艺如图所示。回答下列问题:
相关金属离子[起始浓度为
 ]形成氢氧化物沉淀的
]形成氢氧化物沉淀的 范围如表:
范围如表:| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有
 和
和(2)“氧化”中添加适量的
 的作用是将
的作用是将 氧化为
氧化为 ,写出该反应的离子方程式为
,写出该反应的离子方程式为(3)调
 范围为4.7~6,滤渣2成分的化学式为
范围为4.7~6,滤渣2成分的化学式为(4)“除杂1”的目的是除去
 和
和 ,“滤渣3”的主要成分是
,“滤渣3”的主要成分是(5)“除杂2”的目的是生成
 沉淀除去
沉淀除去 。若溶液酸度过高,
。若溶液酸度过高, 沉淀不完全,原因是
沉淀不完全,原因是(6)写出“沉锰”的离子方程式
您最近一年使用:0次
名校
4 . 下列除去杂质(括号中的物质为杂质)的方法中,错误的是
A.MgO固体( ):加入足量NaOH溶液,过滤 ):加入足量NaOH溶液,过滤 |
B. 溶液( 溶液( );加入过量铁粉,过滤 );加入过量铁粉,过滤 |
C. 溶液( 溶液( ):加入适量烧碱溶液 ):加入适量烧碱溶液 |
D. 气体(HCl):依次通过饱和 气体(HCl):依次通过饱和 溶液和浓硫酸 溶液和浓硫酸 |
您最近一年使用:0次
名校
解题方法
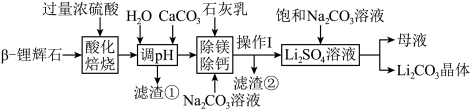
5 . 锂被誉为“新能源金属”、“金属味精”和“推动世界前进的金属”,具有极高的战略价值。碳酸锂是生产金属锂制品的基础材料,以β-锂辉石为原料,用硫酸焙烧法制取碳酸锂的工艺流程(部分试剂和步骤等已略去)如下。
【资料】
①β-锂辉石的主要成分是 ,含少量Ca、Mg元素。
,含少量Ca、Mg元素。
②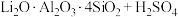 (浓)
(浓)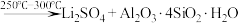 。
。
(1)工业上将β-锂辉石磨至粒径为0.125mm左右,再送入酸化炉的原因是___________ 。
(2)浓硫酸用量不宜过量太多,原因可能是___________ 。
(3)写出“酸化焙烧”步骤中氧化锂发生反应的化学方程式___________ 。
(4)操作Ⅰ的名称为___________ ,滤渣②的成分是___________ 。
(5)在“除镁除钙”步骤中,先加入石灰乳,再加入 溶液。添加试剂的顺序不能调换,其原因是
溶液。添加试剂的顺序不能调换,其原因是___________ 。
(6)母液中的溶质是___________ 。
(7) 和
和 的溶解度如表所示:
的溶解度如表所示:
为了提高产品的纯度,需要将得到的晶体洗涤,需选用___________ ℃的水;证明 晶体洗涤干净的方法操作是
晶体洗涤干净的方法操作是___________ 。

【资料】
①β-锂辉石的主要成分是
 ,含少量Ca、Mg元素。
,含少量Ca、Mg元素。②
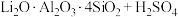 (浓)
(浓)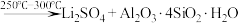 。
。(1)工业上将β-锂辉石磨至粒径为0.125mm左右,再送入酸化炉的原因是
(2)浓硫酸用量不宜过量太多,原因可能是
(3)写出“酸化焙烧”步骤中氧化锂发生反应的化学方程式
(4)操作Ⅰ的名称为
(5)在“除镁除钙”步骤中,先加入石灰乳,再加入
 溶液。添加试剂的顺序不能调换,其原因是
溶液。添加试剂的顺序不能调换,其原因是(6)母液中的溶质是
(7)
 和
和 的溶解度如表所示:
的溶解度如表所示:| T/℃ | 20 | 40 | 60 | 80 |
S( )/g )/g | 1.33 | 1.17 | 1.01 | 0.85 |
S( )/g )/g | 34.2 | 32.8 | 31.9 | 30.7 |
 晶体洗涤干净的方法操作是
晶体洗涤干净的方法操作是
您最近一年使用:0次
名校
解题方法
6 . 为除去括号内的杂质,下列各选项中所选用的试剂或方法错误的是
A. 固体( 固体( ):加热 ):加热 |
B.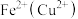 :加入过量NaOH后过滤 :加入过量NaOH后过滤 |
C.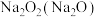 :将混合物在氧气中加热 :将混合物在氧气中加热 |
| D.Mg固体(Al):加入足量的NaOH溶液,过滤 |
您最近一年使用:0次
2024-01-17更新
|
138次组卷
|
4卷引用:四川省内江市第二中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
7 . 按要求回答以下问题
Ⅰ.某课外活动小组进行氢氧化铁胶体的制备实验并检验其性质。
(1)现有甲、乙、丙三名同学进行氢氧化铁胶体的制备实验,其中正确的是_______ (填序号)。
a.甲同学的操作:取一小烧杯,加入25mL蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴氯化铁饱和溶液,继续煮沸至混合液呈红褐色,停止加热;
b.乙同学直接加热饱和氯化铁溶液;
c.丙同学向沸水中滴加饱和氯化铁溶液,为了使反应进行充分,长时间加热;
(2)制备氢氧化铁胶体的化学方程式为_______ 。
(3) 胶体区别于FeCl3溶液最本质的特征是_______。
胶体区别于FeCl3溶液最本质的特征是_______。
Ⅱ.现有三种阳离子 、
、 、
、 对应的盐都为硝酸盐,将其混合配成溶液,选择合适试剂,将这三种离子逐一沉淀分离。其流程图如下图所示:
对应的盐都为硝酸盐,将其混合配成溶液,选择合适试剂,将这三种离子逐一沉淀分离。其流程图如下图所示:

部分物质的溶解性表:
(4)沉淀1的化学式为_______ 。
(5)写出混合溶液与试剂A反应的离子方程式:_______ 。
(6)若C为 ,且它与B的阳离子相同,则试剂B的名称是
,且它与B的阳离子相同,则试剂B的名称是_______ 。
Ⅰ.某课外活动小组进行氢氧化铁胶体的制备实验并检验其性质。
(1)现有甲、乙、丙三名同学进行氢氧化铁胶体的制备实验,其中正确的是
a.甲同学的操作:取一小烧杯,加入25mL蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴氯化铁饱和溶液,继续煮沸至混合液呈红褐色,停止加热;
b.乙同学直接加热饱和氯化铁溶液;
c.丙同学向沸水中滴加饱和氯化铁溶液,为了使反应进行充分,长时间加热;
(2)制备氢氧化铁胶体的化学方程式为
(3)
 胶体区别于FeCl3溶液最本质的特征是_______。
胶体区别于FeCl3溶液最本质的特征是_______。A. 胶体粒子的大小在1~100nm之间 胶体粒子的大小在1~100nm之间 |
B. 胶体具有丁达尔效应 胶体具有丁达尔效应 |
C. 胶体是均一的分散系 胶体是均一的分散系 |
D. 胶体的分散质能通过滤纸 胶体的分散质能通过滤纸 |
Ⅱ.现有三种阳离子
 、
、 、
、 对应的盐都为硝酸盐,将其混合配成溶液,选择合适试剂,将这三种离子逐一沉淀分离。其流程图如下图所示:
对应的盐都为硝酸盐,将其混合配成溶液,选择合适试剂,将这三种离子逐一沉淀分离。其流程图如下图所示:
部分物质的溶解性表:
| 阴离子 | 阳离子 | ||
 |  |  | |
 | 溶 | 溶 | 不 |
 | 不 | 不 | 不 |
 | 不 | 溶 | 微 |
 | 溶 | 不 | 不 |
(4)沉淀1的化学式为
(5)写出混合溶液与试剂A反应的离子方程式:
(6)若C为
 ,且它与B的阳离子相同,则试剂B的名称是
,且它与B的阳离子相同,则试剂B的名称是
您最近一年使用:0次
名校
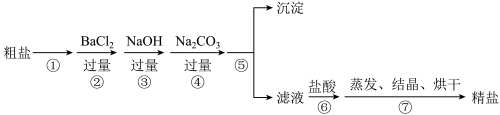
8 . 通过海水晾晒可以得到粗盐,粗盐除含有NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,下图是某兴趣小组粗盐提纯的实验流程。
(1)下列叙述正确的是___________。
(2)写出下列序号的离子反应方程式:
②:___________ ;
③:___________ ;
⑥:___________ 。

(1)下列叙述正确的是___________。
| A.步骤①、⑤的操作分别是溶解、过滤 |
| B.步骤④可以与步骤②互换顺序 |
| C.步骤①、⑤、⑦中都会用到玻璃棒 |
| D.步骤②中试剂BaCl2不能换成Ba(NO3)2 |
(2)写出下列序号的离子反应方程式:
②:
③:
⑥:
您最近一年使用:0次
9 . 氯化钠(NaCl)是生活中常用的化学品,也是重要的化工生产原料。粗盐中一般含有 、
、 、
、 和
和 杂质。粗盐制得精盐的过程如下:
杂质。粗盐制得精盐的过程如下:

下列说法错误的是
 、
、 、
、 和
和 杂质。粗盐制得精盐的过程如下:
杂质。粗盐制得精盐的过程如下:
下列说法错误的是
A.试剂I是足量 溶液 溶液 |
| B.操作a所需的玻璃仪器有烧杯、漏斗、玻璃棒 |
C.试剂II为碳酸钠,其作用为除去溶液中的 和 和 |
| D.用pH试纸检验溶液B,可发现溶液B显碱性 |
您最近一年使用:0次
2023-11-10更新
|
364次组卷
|
6卷引用:四川省雅安市2023-2024学年高一上学期期中考试化学试题
名校
解题方法
10 . 实验室用化学沉淀法除去粗盐中的Ca2+、Mg2+、 获得精制盐。下列叙述有误的是
获得精制盐。下列叙述有误的是
 获得精制盐。下列叙述有误的是
获得精制盐。下列叙述有误的是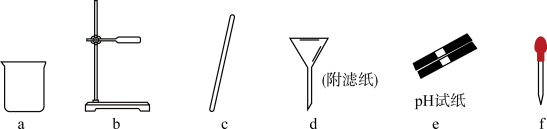
A.杂质离子除去顺序可确定为:SO 、Mg2+、Ca2+ 、Mg2+、Ca2+ |
| B.加入试剂顺序可依次为:NaOH、Na2CO3、BaCl2、盐酸四种溶液 |
| C.杂质离子沉淀完后,采取的分离操作用到的仪器是a、b、c、d |
| D.沉淀分离完成后,调整溶液pH时用到的全部仪器为a、c、e、f |
您最近一年使用:0次
2023-11-02更新
|
1243次组卷
|
5卷引用:四川省绵阳市2024届高三上学期第一次诊断性考试理科综合化学试题
四川省绵阳市2024届高三上学期第一次诊断性考试理科综合化学试题(已下线)题型07 化学实验基础(选择题)-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题03 化学实验基础-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)陕西省咸阳市实验中学2023-2024学年高一下学期第一次月考化学试题陕西省部分学校2023-2024学年高一下学期3月月考化学试题



