(1)化石原料合成丙烯腈(CH2=CH—CN):
已知:
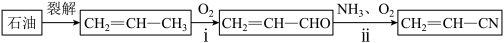
CH2=CH-CH3(g)+NH3(g)+
 O2(g)→CH2=CH-CN(g)+3H2O(g) △H=-514.6kJ·mol-1
O2(g)→CH2=CH-CN(g)+3H2O(g) △H=-514.6kJ·mol-1i:CH2=CH-CH3(g)+O2(g)→CH2=CH-CHO(g)+H2O(g) △H=-353.1kJ·mol-1
写出反应ii的热化学方程式:
(2)生物质原料合成丙烯腈:
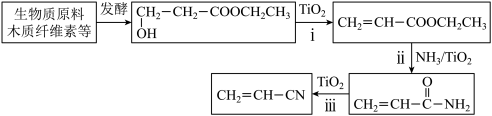
①写出ii的化学方程式:
②丙烯腈与1,3-丁二烯共聚生产的丁腈橡胶是现代工业重要的橡胶。写出合成丁腈橡胶的化学方程式:
(3)生物质脂肪酸脱羧制备长链烷烃:H2气氛,TiO2/Pt为催化剂,光催化长链脂肪酸转化为长链烷烃机理示意图如下:
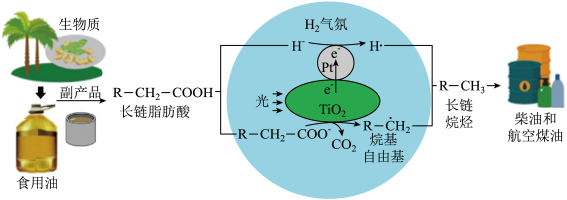
①油脂酸性水解可得高级脂肪酸和
②TiO2界面发生的电极反应式为
相似题推荐
I.一碘甲烷
 加热分解时主要反应有:
加热分解时主要反应有:反应①:
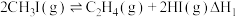
反应②:

反应③
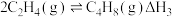
实验测得,反应①、②的
 随温度的变化如图1所示,在体积为
随温度的变化如图1所示,在体积为 的密闭容器中,起始投料
的密闭容器中,起始投料 ,反应温度对平衡体系中乙烯
,反应温度对平衡体系中乙烯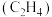 、丙烯
、丙烯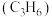 和丁烯
和丁烯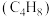 物质的量分数的影响如图2所示。
物质的量分数的影响如图2所示。
(1)
 时,反应
时,反应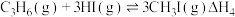 ;
;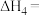

(2)平衡体系温度在
 之前,丙烯的物质量分数随温度升高而增加的可能原因是
之前,丙烯的物质量分数随温度升高而增加的可能原因是(3)若维持体系温度为
 的平衡转化率为
的平衡转化率为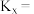
Ⅱ.研究
 的分解与合成对提高反应①中
的分解与合成对提高反应①中 的平衡转化率有重要意义。
的平衡转化率有重要意义。 ,将
,将
 和
和
 置于已抽成真空的固定容积为
置于已抽成真空的固定容积为 的密闭容器中,
的密闭容器中, 时体系达到平衡,体系中存在如下反应关系:
时体系达到平衡,体系中存在如下反应关系:A.
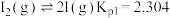
B.
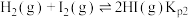
C.
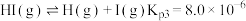
D.

(4)则
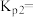
(5)已知:气体的分压=总压×物质的量分数。实验测得平衡体系的总压强为
 的分压为
的分压为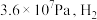 的分压为
的分压为 。已知该反应的正反应速率为
。已知该反应的正反应速率为 ,逆反应速率为
,逆反应速率为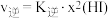 ,其中
,其中 为速率常数,x为物质量分数,若
为速率常数,x为物质量分数,若 ,在
,在 时,
时,
 的代数式表示)。
的代数式表示)。
| IA | 0 | |||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
(1)③、④、⑥的原子半径由大到小的顺序是
(2)下列事实能说明元素②的非金属性比元素⑥的非金属性强的是_______(填字母)。
| A.②的单质与⑥的简单氢化物溶液反应,溶液变浑浊 |
| B.在氧化还原反应中,1mol②单质比1mol⑥单质得电子多 |
| C.简单气态氢化物的热稳定性②大于⑥ |
| D.单质的熔点:⑥大于② |
(4)用原子结构知识解释元素的金属性④强于⑤的原因是
(5)M是①、②两种元素按原子个数比1∶1组成的常见液态化合物。足量M与0.4mol液态肼(
 )混合,产生大量的氮气和水蒸气并放出258kJ的热量,该反应的热化学方程式为
)混合,产生大量的氮气和水蒸气并放出258kJ的热量,该反应的热化学方程式为
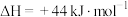 )。液态肼用作火箭推进剂,除释放出大量的热和快速产生大量的气体外,还有一个很突出的优点是
)。液态肼用作火箭推进剂,除释放出大量的热和快速产生大量的气体外,还有一个很突出的优点是已知:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH =+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH =+247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g)ΔH =+169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与 H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S 燃烧,其目的是
(3)H2O 的热分解也可得到 H2,高温下水分解体系中主要气体的体积分数与温度的关系如图甲所示。图中A、B 表示的依次是
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图乙(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为
(5)Mg2Cu 是一种储氢合金。 350 ℃时,Mg2Cu 与 H2反应,生成 MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为 0.077)。Mg2Cu 与 H2反应的化学方程式为
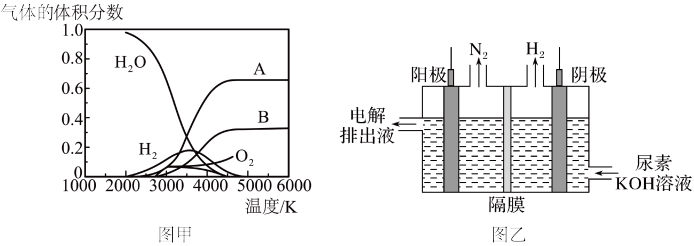
(1)已知:海水的pH约为8.1,图1的腐蚀过程属于
(2)用图2研究铁的腐蚀过程。预测恒温条件下反应一段时间后,U形管内液面的变化情况。(已知:起始时两管内液面相平,实验过程中铁丝始终不接触溶液,选填“左高右低”、“左低右高”或“相平”)
| 溶液X | 浓硫酸 | 浓盐酸 | 稀硫酸 |
| 液面情况 |
(3)用图3所示装置研究铁的防腐蚀过程:
①
 、
、 、
、 只关闭一个,则铁腐蚀的速度最快的是只闭合
只关闭一个,则铁腐蚀的速度最快的是只闭合 ”、“
”、“ ”或“
”或“ ”,下同);
”,下同);②为减缓铁的腐蚀,应只闭合
③只闭合
 ,石墨电极附近的pH将
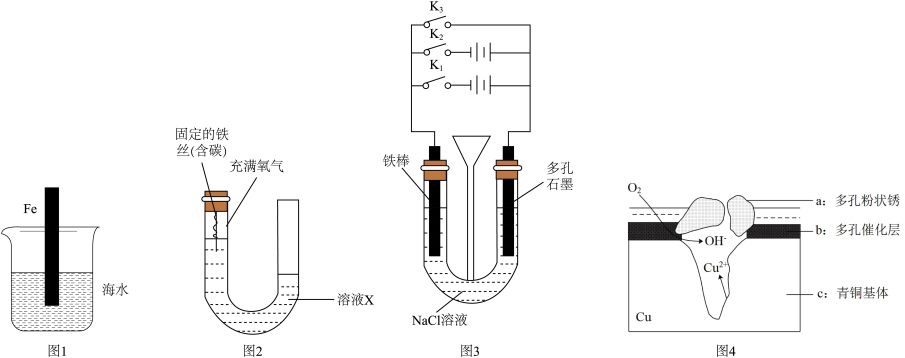
,石墨电极附近的pH将(4)图4为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
①腐蚀过程中,负极是
②环境中的
 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈
扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈 ,总的离子方程式为
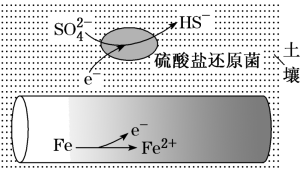
,总的离子方程式为(5)深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根离子腐蚀,其电化学腐蚀原理下图所示,此腐蚀过程中,正极的电极反应式是
【推荐2】2019年12月4日“全球碳计划”发布报告说,全球CO2排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是用CO2转化成为有机物实现碳循环。如:
C2H4(g)+H2O(l)⇌C2H5OH(l) ΔH=-44.2kJ/mol
2CO2(g)+2H2O(l)⇌C2H4(g)+3O2(g) ΔH=+1411.0kJ/mol
已知2CO2(g)+3H2O(1)⇌C2H5OH(l)+3O2(g)其正反应的活化能为EakJ/mol,则逆反应的活化能为
(2)利用工业废气中的CO2可以制取甲醇和水蒸气,一定条件下,往2L恒容密闭容器中充入1 molCO2和3molH2,在不同催化剂作用下发生反应I、反应II与反应Ⅲ,相同时间内CO2的转化率随温度变化如图所示:
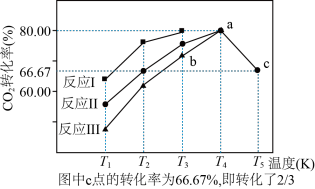
①催化剂效果最佳的反应是
②b点v(正)
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是
④c点时该反应的平衡常数K=
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图所示:
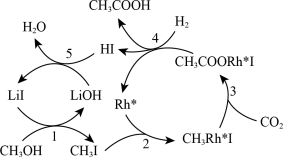
①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式:
②根据图示,写出总反应的化学方程式:
(1)氯碱工业示意图如图。

①c极为
②电解饱和NaCl溶液的化学方程式为
③下列说法正确的是
A.该装置可以实现化学能向电能转化
B.该装置中Na+透过阳离子交换膜向d极移动
C.该装置中c极一侧流出的是淡盐水
④结合化学用语解释d极区产生NaOH的原因:
⑤实际生产中,阳离子交换膜的损伤会造成OH-迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为
A.定期检查并更换阳离子交换膜
B.向阳极区加入适量盐酸
C.使用Cl−浓度高的精制饱和食盐水为原料
(2)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为
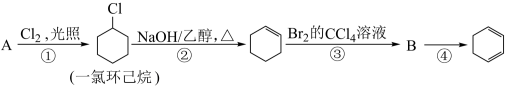
(1)A的结构简式是
(2)①的反应类型是
(3)反应④的化学方程式是
(4)
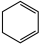 与Br2的CCl4溶液发生1,4-加成产物的结构简式是
与Br2的CCl4溶液发生1,4-加成产物的结构简式是
已知:①碳原子上连有四个不同的原子或者原子团时,该碳原子称为手性碳原子
②
③

请回答以下问题:
(1)A的名称为
(2)C的分子式为
(3)该合成路线中,涉及最多的有机反应类型是
(4)C→E的化学方程式为
(5)下列关于H和G的理解正确的是
a.G属于芳香族化合物 b.H在水中溶解性更好
c.H可以发生加成反应 d.G和H中均含有手性碳原子
(6)F有多种同分异构体,其中能使
 溶液显色,且结构中除苯环外,还含有
溶液显色,且结构中除苯环外,还含有 片段(R为其他可变化的结构部分)的有
片段(R为其他可变化的结构部分)的有 ,写出该有机物的结构简式
,写出该有机物的结构简式(1)通过管道运输,天然气可以为家庭提供热量。输送到家的天然气几乎是纯甲烷,下列关于甲烷与氯气反应的说法中错误的是_______。
| A.反应类型为取代 | B.产物CH3Cl常温下为液体 |
| C.产物CH2Cl2结构只有一种 | D.产物CCl4可做灭火剂 |
(2)液化石油气通常使用的是丙烷和丁烷。
①丙烷与丁烷的关系是互为
②相同条件下,下列烷烃的沸点最高的是
A.丙烷 B.正丁烷 C.异丁烷 D.正戊烷
(3)石蜡是分子中含有20~40个碳原子的烷烃,雪蜡是雪上项目装备的辅助材料,通常含有石蜡。下列关于石蜡的说法正确的是_______。
| A.常温下为气体 | B.易溶于水 | C.属于纯净物 | D.是石油分馏产物 |
(4)科学家致力于二氧化碳的“组合转化”技术的研究,把过多二氧化碳转化为有益于人类的物质。二氧化碳“组合转化”的某烷烃碳架结构如图所示:
 ,回答下列问题。
,回答下列问题。①用系统命名法命名此烷烃:
②若此烷烃为单烯烃加氢制得,则单烯烃的结构共有
③若此烷烃为炔烃加氢制得,则此炔烃的
Ⅰ.下列实验操作或叙述正确的是
A.实验室进行石油的分馏实验时,温度计水银球插入石油液面以下
B.用金属钠检验无水乙醇中含有的少量水
C.分离苯和苯酚的混合液,先加入适量浓溴水,再过滤、分液,即可实现
D.某醛的结构简式为(CH3)2C=CHCH2CH2CHO,检验里面的碳碳双键时,可先用新制氢氧化铜除醛基,再加溴水,若褪色,则证明含有碳碳双键
E.将10滴溴乙烷加入1mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子
F.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验
G.在蔗糖的水解液中加新制Cu(OH)2悬浊液,有砖红色沉淀生成
H.实验室制乙炔时,为了减缓反应速率,改用饱和食盐水
II.(1)
 由
由(2)写出
 与足量氢氧化钠溶液在加热条件下反应的化学方程式:
与足量氢氧化钠溶液在加热条件下反应的化学方程式:
已知:
(i)

(ii)环氧羧酸酯在一定条件下可发生反应:

回答下列问题:
(1)A的名称为
(2)C的结构简式为
(3)写出对应过程的反应类型:A→B为
(4)E与新制氢氧化铜溶液反应的化学方程式为
(5)下列关于布洛芬的说法正确的是_______(填标号)。
| A.能发生氧化、取代、加成反应 |
| B.过量布洛芬不能与Na2CO3生成CO2 |
| C.能与高锰酸钾溶液反应生成对苯二甲酸 |
| D.一个布洛芬分子含有两个手性碳原子 |
②用
 对布洛芬进行成酯“修饰”后的有机物M可降低对胃肠道的刺激,写出M的结构简式:
对布洛芬进行成酯“修饰”后的有机物M可降低对胃肠道的刺激,写出M的结构简式:③如果对布洛芬既进行成酯“修饰”,又将其转化为缓释布洛芬高分子,疗效增强、镇痛更持久。缓释布洛芬高分子结构如下:

制备缓释布洛芬高分子,除了布洛芬还需要两种原料,其结构简式分别为

(1)反应①的类型为
(2)写出实验室制备A的方程式
(3)煤的干馏属于
(4)写出PVC的结构简式
(5)写出C的出结构简式
(6)写出A→D的化学反应方程式
(7)与D互为同分异构体的酯类的物质有多种(不含环状化合物),写出其中一种的结构简式



