氯化亚铜(CuCl) 为白色粉末,其露置于空气中易被氧化为绿色的碱式氯化铜Cu2(OH)3Cl]。某兴趣小组高温加热分解氯化铜晶体(CuCl2·xH 2O)制备CuCl,其装置如下(加热仪器、夹持仪器省略)

回答下列问题:
(1)装有无水硫酸铜的仪器名称为______ ,装置 D 的作用是______ 。
(2)通入 HCl 气体的主要作用是______ 。
(3)实验过程中,装置C 中的现象为______ 。
(4)硬质玻璃管A 中发生主要反应的化学方程式为__________ 。
(5)为测定 CuCl2·xH 2O 中结晶水的数目 x,实验步骤如下:
a 用电子天平称取一定质量的氯化铜晶体;
b 在坩埚中充分灼烧;
c 在干燥器中冷却;
d 称量所得黑色固体质量;
e 重复 b~d 操作直至连续两次称量差值不超过 0.001g。
①若氯化铜晶体质量为 3.384g,最终得到黑色固体质量为 1.600g,则 x=______ (精确到 0.1)。
②若加热时有固体溅出坩埚,则测得x 值______ 填“偏大”“不变”或“偏小”)。

回答下列问题:
(1)装有无水硫酸铜的仪器名称为
(2)通入 HCl 气体的主要作用是
(3)实验过程中,装置C 中的现象为
(4)硬质玻璃管A 中发生主要反应的化学方程式为
(5)为测定 CuCl2·xH 2O 中结晶水的数目 x,实验步骤如下:
a 用电子天平称取一定质量的氯化铜晶体;
b 在坩埚中充分灼烧;
c 在干燥器中冷却;
d 称量所得黑色固体质量;
e 重复 b~d 操作直至连续两次称量差值不超过 0.001g。
①若氯化铜晶体质量为 3.384g,最终得到黑色固体质量为 1.600g,则 x=
②若加热时有固体溅出坩埚,则测得x 值
更新时间:2020-05-25 12:40:13
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】已二酸 是一种二元弱酸,实验室以环已醇(
是一种二元弱酸,实验室以环已醇( )为原料制取己二酸的实验流程如图:
)为原料制取己二酸的实验流程如图:

已知:①不同温度下,相关物质在水中的溶解度如下表:
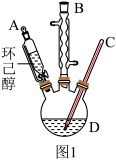
②“氧化”过程在三颈烧瓶(如下图1所示)中进行,发生的主要反应为: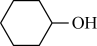

回答下列问题:
(1)在水溶液中已二酸的电离方程式为_______ 。
(2)实验操作1的名称为_______ ;图1中仪器 的名称为
的名称为_______ 。
(3)“氧化”过程在环已醇不同滴速下,溶液温度随时间变化曲线如图2所示,实验过程中应选择的环己醇滴速为_______ 滴 。
。

(4)蒸发浓缩操作中当溶液表面出现_______ 现象时停止加热。
(5)除去己二酸晶体中含有的氯化钠杂质通常采取的实验方法为_______ 。
(6)实验时称取的环己醇质量为 ,最终得到纯净的己二酸晶体
,最终得到纯净的己二酸晶体 ,则该实验中已二酸的产率为
,则该实验中已二酸的产率为_______ %(保留两位有效数字)。
 是一种二元弱酸,实验室以环已醇(
是一种二元弱酸,实验室以环已醇( )为原料制取己二酸的实验流程如图:
)为原料制取己二酸的实验流程如图:
已知:①不同温度下,相关物质在水中的溶解度如下表:
| 物质 | 已二酸 | 氯化钠 | 氯化钾 |
| 25℃时溶解度/g | 2.1 | 36.1 | 34.3 |
| 70℃时溶解度/g | 68 | 37.8 | 48 |
| 100℃时溶解度/g | 160 | 39.5 | 56.3 |


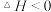
回答下列问题:
(1)在水溶液中已二酸的电离方程式为
(2)实验操作1的名称为
 的名称为
的名称为
(3)“氧化”过程在环已醇不同滴速下,溶液温度随时间变化曲线如图2所示,实验过程中应选择的环己醇滴速为
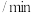 。
。
(4)蒸发浓缩操作中当溶液表面出现
(5)除去己二酸晶体中含有的氯化钠杂质通常采取的实验方法为
(6)实验时称取的环己醇质量为
 ,最终得到纯净的己二酸晶体
,最终得到纯净的己二酸晶体 ,则该实验中已二酸的产率为
,则该实验中已二酸的产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】膨松剂反应时产生气体的量是检验膨松剂品质的一项重要指标。某膨松剂中发挥作用的物质为碳酸氢钠,学校兴趣小组为研究该膨松剂在加热情况下放出气体的量,设计了如图所示实验(装置A、C、D、E中的试剂足量)。

回答下列问题:
(1)加热前,需向装置内通入空气,用离子反应方程式解释装置A的作用______ ,停止加热后,还需继续通入一段时间的空气,目的是________ 。
(2)将一定质量的膨松剂样品装入装置B中,装置B中可能发生反应的化学反应方程式为____ ;样品产生的二氧化碳的质量可通过测定实验前后装置____ (填装置对应的标号)的质量测得。
(3)若没有装置E,可能会造成测定结果_____ (填“偏大”、“偏小”或“不变”)。
(4)实验测得二氧化碳的质量为13.2 g,则二氧化碳的体积(标准状况)为____ L,膨松剂样品中所含碳酸氢钠的物质的量为_____ mol。

回答下列问题:
(1)加热前,需向装置内通入空气,用离子反应方程式解释装置A的作用
(2)将一定质量的膨松剂样品装入装置B中,装置B中可能发生反应的化学反应方程式为
(3)若没有装置E,可能会造成测定结果
(4)实验测得二氧化碳的质量为13.2 g,则二氧化碳的体积(标准状况)为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】KMnO4在实验室和工业上均有重要应用,其工业制备的部分工艺如下:
Ⅰ.将软锰矿(主要成分MnO2)粉碎后,与KOH固体混合,通入空气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
(1)Ⅰ中,粉碎软锰矿的目的是_____ 。
(2)Ⅰ中,生成K2MnO4的化学方程式是_____ 。
(3)Ⅱ中,浸取时用稀KOH溶液的原因是_____ 。
(4)Ⅲ中,CO2和K2MnO4在溶液中反应的化学方程式是_____ 。
(5)将K2MnO4溶液采用惰性电极隔膜法电解,也可制得KMnO4.装置如图:
①b极是_____ 极(填“阳”或“阴”),D是____________ 。
②结合电极反应式简述生成KMnO4的原理:___________ 。
③传统无膜法电解时,锰元素利用率偏低,与之相比,用阳离子交换膜可以提高锰元素的利用率,其原因是__________ 。
(6)用滴定法测定某高锰酸钾产品的纯度,步骤如下:
已知:Na2C2O4 +H2SO4 ═H2C2O4 +Na2SO4
5H2C2O4 +2MnO4﹣+6H+═2Mn2++10CO2↑+8H2O
摩尔质量:Na2C2O4 134g/mol KMnO4 158g/mol
ⅰ.称取ag产品,配成50mL溶液。
ⅱ.称取bgNa2C2O4,置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。
ⅲ.将锥形瓶中溶液加热到75℃~80℃,恒温,用ⅰ中所配溶液滴定至终点,消耗溶液V mL(杂质不参与反应)。
产品中KMnO4的质量分数的表达式为_________ 。
Ⅰ.将软锰矿(主要成分MnO2)粉碎后,与KOH固体混合,通入空气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
(1)Ⅰ中,粉碎软锰矿的目的是
(2)Ⅰ中,生成K2MnO4的化学方程式是
(3)Ⅱ中,浸取时用稀KOH溶液的原因是
(4)Ⅲ中,CO2和K2MnO4在溶液中反应的化学方程式是
(5)将K2MnO4溶液采用惰性电极隔膜法电解,也可制得KMnO4.装置如图:

①b极是
②结合电极反应式简述生成KMnO4的原理:
③传统无膜法电解时,锰元素利用率偏低,与之相比,用阳离子交换膜可以提高锰元素的利用率,其原因是
(6)用滴定法测定某高锰酸钾产品的纯度,步骤如下:
已知:Na2C2O4 +H2SO4 ═H2C2O4 +Na2SO4
5H2C2O4 +2MnO4﹣+6H+═2Mn2++10CO2↑+8H2O
摩尔质量:Na2C2O4 134g/mol KMnO4 158g/mol
ⅰ.称取ag产品,配成50mL溶液。
ⅱ.称取bgNa2C2O4,置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。
ⅲ.将锥形瓶中溶液加热到75℃~80℃,恒温,用ⅰ中所配溶液滴定至终点,消耗溶液V mL(杂质不参与反应)。
产品中KMnO4的质量分数的表达式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】Na2O2是重要的化工原料,具有多种用途。
(1)Na2O2具有氧化性,可以将SO2氧化为硫酸钠,写出该反应的化学方程式:___ ,该反应中,Na2O2的作用为___ (填“还原剂”、“氧化剂”或“既是氧化剂又是还原剂”)。
(2)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选择适当的化学试剂和实验用品,用图中的实验装置进行实验,证明过氧化钠可作供氧剂。

装置A是CO2气体的发生装置,请写出仪器a的名称___ ,B中盛饱和NaHCO3溶液,其作用是___ 。写出C中过氧化钠与二氧化碳反应的化学方程式___ 。D中盛放的试剂可以是____ (填序号)。
①浓H2SO4②NaOH溶液 ③CaCl2溶液 ④Na2SO3溶液
(3)将一定量的Na2O2固体投入到含有下列离子的溶液中:NO3-、HCO3-、CO32-、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)___ (填离子符号)。
(1)Na2O2具有氧化性,可以将SO2氧化为硫酸钠,写出该反应的化学方程式:
(2)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选择适当的化学试剂和实验用品,用图中的实验装置进行实验,证明过氧化钠可作供氧剂。

装置A是CO2气体的发生装置,请写出仪器a的名称
①浓H2SO4②NaOH溶液 ③CaCl2溶液 ④Na2SO3溶液
(3)将一定量的Na2O2固体投入到含有下列离子的溶液中:NO3-、HCO3-、CO32-、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
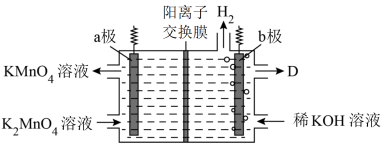
【推荐2】 是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,具有强氧化性,是一种常用的消毒剂,可用于污水杀菌和饮用水净化,可通过
是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,具有强氧化性,是一种常用的消毒剂,可用于污水杀菌和饮用水净化,可通过 与酸性
与酸性 溶液反应制备,某化学兴趣小组同学设计了如下装置制备
溶液反应制备,某化学兴趣小组同学设计了如下装置制备 。
。
已知:浓硫酸与 固体反应可用来制备
固体反应可用来制备 ,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成
,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成 ,回答下列问题:
,回答下列问题:
(1)A中盛装 固体的仪器名称为
固体的仪器名称为___________ 。
(2)通过装置B中反应制备 ,此反应的离子方程式为
,此反应的离子方程式为___________ 。
(3)欲制备一瓶 ,选择上图中的装置,其接口的连接顺序为a-g-h
,选择上图中的装置,其接口的连接顺序为a-g-h___________ 。
(4)装置D盛放冰水的目的___________ ,装置E的作用是___________ 。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力(还原产物均为氯离子)。
的氧化能力(还原产物均为氯离子)。 的有效氯含量为
的有效氯含量为___________ 克(计算结果保留一位小数)。
 是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,具有强氧化性,是一种常用的消毒剂,可用于污水杀菌和饮用水净化,可通过
是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,具有强氧化性,是一种常用的消毒剂,可用于污水杀菌和饮用水净化,可通过 与酸性
与酸性 溶液反应制备,某化学兴趣小组同学设计了如下装置制备
溶液反应制备,某化学兴趣小组同学设计了如下装置制备 。
。
已知:浓硫酸与
 固体反应可用来制备
固体反应可用来制备 ,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成
,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成 ,回答下列问题:
,回答下列问题:(1)A中盛装
 固体的仪器名称为
固体的仪器名称为(2)通过装置B中反应制备
 ,此反应的离子方程式为
,此反应的离子方程式为(3)欲制备一瓶
 ,选择上图中的装置,其接口的连接顺序为a-g-h
,选择上图中的装置,其接口的连接顺序为a-g-h(4)装置D盛放冰水的目的
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力(还原产物均为氯离子)。
的氧化能力(还原产物均为氯离子)。 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某化学兴趣小组用下图所示装置制备乙烯并验证乙烯的性质。当温度迅速上升后,可观察到试管中的溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。
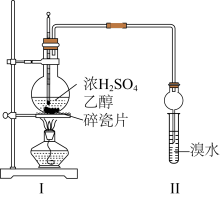
(1)装置Ⅰ生成乙烯的化学方程式是___________ 。
(2)甲同学认为:溴水褪色的现象不能证明装置Ⅰ中有乙烯生成,原因是___________ 。
(3)乙同学建议:在装置Ⅰ和Ⅱ之间增加一个洗气装置,洗气的试剂是___________ 。
(4)丁同学查文献得知:若用溴水验证,反应后装置Ⅱ的产物主要为BrCH2CH2OH,含少量BrCH2CH2Br。建议装置Ⅱ中的试剂改为“溴的CC14溶液”以排除H2O对乙烯与Br2反应的干扰。写出乙烯与溴水反应生成BrCH2CH2OH的化学方程式___________ 。

(1)装置Ⅰ生成乙烯的化学方程式是
(2)甲同学认为:溴水褪色的现象不能证明装置Ⅰ中有乙烯生成,原因是
(3)乙同学建议:在装置Ⅰ和Ⅱ之间增加一个洗气装置,洗气的试剂是
(4)丁同学查文献得知:若用溴水验证,反应后装置Ⅱ的产物主要为BrCH2CH2OH,含少量BrCH2CH2Br。建议装置Ⅱ中的试剂改为“溴的CC14溶液”以排除H2O对乙烯与Br2反应的干扰。写出乙烯与溴水反应生成BrCH2CH2OH的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
(1)连接上述仪器的正确顺序是:E接____ ,____ 接____ ,____ 接H,G接F。
(2)气体发生装置中进行的反应化学方程式是________ ;当足量的MnO2与2mol浓盐酸充分反应后(不考虑浓盐酸的挥发),得到的氯气的物质的量小于0.5mol的原因是__________ 。
(3)在装置中:①饱和食盐水的作用是______ ,②浓硫酸的作用是_____ 。
(4)化学实验中检验是否有Cl2产生常用_____ ,如果有Cl2产生,可观察到的现象是_________ ,写出反应方程式________ 。

(1)连接上述仪器的正确顺序是:E接
(2)气体发生装置中进行的反应化学方程式是
(3)在装置中:①饱和食盐水的作用是
(4)化学实验中检验是否有Cl2产生常用
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】甲乙同学通过如下实验探究乙烯的部分化学性质。
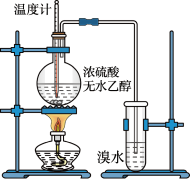
(1)实验室制乙烯的化学方程式是__________________ ,乙烯使溴水褪色的化学反应类型是______________ 。
(2)甲同学观察到当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,此黑色物质是_________ ;超过170℃后生成气体速度明显加快并伴有刺激性气味气体产生,这种刺激性气味气体是_________ ,该气体的存在不能认为溴水褪色是乙烯的加成反应造成的,原因是(用化学方程表示):________________________ 。
(3)乙同学经分析认为可能还有CO、CO2两种气体产生。为检验CO是否存在,他设计了如下装置。
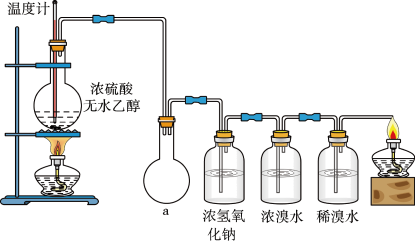
装置a的作用是_________________ ,浓溴水的作用是______________ ,稀溴水的作用是________________ 。实验发现最后气体经点燃是蓝色火焰,确认有一氧化碳。

(1)实验室制乙烯的化学方程式是
(2)甲同学观察到当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,此黑色物质是
(3)乙同学经分析认为可能还有CO、CO2两种气体产生。为检验CO是否存在,他设计了如下装置。

装置a的作用是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】CaS用于制备除虫剂、发光材料等。某课题小组拟用硫酸钙和焦炭在高温下反应制备硫化钙并检验产物。
(1)甲同学设计如图所示实验装置检验气体产物。
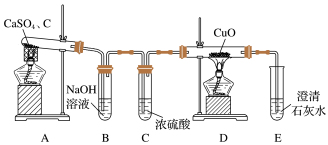
①B装置的作用是___________________________________________ 。
②D和E装置能检验A装置的反应产物中的________ (填化学式)。
③E装置中可能出现的现象是__________________________________ 。
(2)乙同学提出,根据氧化还原反应原理,A装置中的气体产物可能还有CO2、SO2,为了验证他的猜想,结合上述装置并选择下列仪器设计实验方案(同一种仪器可重复使用)。

①气流从左至右,仪器连接顺序为A、F、________ 。
②能证明有CO2的现象是_________________________________________________ 。
③除去SO2的离子方程式为_______________________________________________ 。
(3)经实验检验气体产物有SO2、CO、CO2且气体体积之比为1∶1∶2,写出A中反应的化学方程式:_______________________________________________________________ 。
(4)利用重量法测定固体产物的质量之比,即将样品溶于足量的饱和碳酸钠溶液中,过滤、洗涤、干燥等。需要测定的物理量有__________________ [已知CaS与H2O反应生成Ca(OH)2和H2S]。
(1)甲同学设计如图所示实验装置检验气体产物。

①B装置的作用是
②D和E装置能检验A装置的反应产物中的
③E装置中可能出现的现象是
(2)乙同学提出,根据氧化还原反应原理,A装置中的气体产物可能还有CO2、SO2,为了验证他的猜想,结合上述装置并选择下列仪器设计实验方案(同一种仪器可重复使用)。

①气流从左至右,仪器连接顺序为A、F、
②能证明有CO2的现象是
③除去SO2的离子方程式为
(3)经实验检验气体产物有SO2、CO、CO2且气体体积之比为1∶1∶2,写出A中反应的化学方程式:
(4)利用重量法测定固体产物的质量之比,即将样品溶于足量的饱和碳酸钠溶液中,过滤、洗涤、干燥等。需要测定的物理量有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。

(1)洗气瓶C中发生反应的化学方程式为:_______________ ;
(2)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:___________________ ;
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量将_________ (填“偏高”、“偏低”或“无影响”);
(4)下列试剂中,可以用来替代洗气瓶C中溶液的是_________ 。(选填字母编号)
a.NaOH溶液 b.品红溶液
c.酸性高锰酸钾溶液 d.Na2CO3溶液
乙方案:实验步骤如以下流程图所示:

(5)写出步骤②中反应的离子方程式;_________________________
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)为________________ (用含V、m的代数式表示)
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。

(1)洗气瓶C中发生反应的化学方程式为:
(2)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量将
(4)下列试剂中,可以用来替代洗气瓶C中溶液的是
a.NaOH溶液 b.品红溶液
c.酸性高锰酸钾溶液 d.Na2CO3溶液
乙方案:实验步骤如以下流程图所示:

(5)写出步骤②中反应的离子方程式;
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】科学家利用石墨烯和具有粘弹性的聚硅树脂(俗称橡皮泥)制备出一种具有极高灵敏度的电力学传感材料,能够检测轻微的变形和冲击,其灵敏程度甚至能探测到蜘蛛的运动。该材料可用于制作检测人体脉搏、血压的传感器等。实验室模拟工业合成方法,制备聚硅树脂的中间体氯甲基三乙氧基硅烷ClCH2Si(OEt)3 。量取20mL甲基三氯硅烷(CH3SiCl3)注入三颈烧瓶中,开启电磁搅拌加热器升温至66℃,从a中加入浓盐酸,加热A一段时间,待温度升至110℃,停止加热,在三颈烧瓶中加入30mL无水乙醇(EtOH),迅速反应生成氯甲基三乙氧基硅烷ClCH2Si(OEt)3,待温度降至室温后,将三颈烧瓶中液体转移到蒸馏烧瓶中蒸馏,收集得到174.5℃馏分12mL。
已知:①甲基三氯硅烷为无色液体,具有刺鼻恶臭,易潮解;氯甲基三乙氧基硅烷易水解,能与碱金属氢氧化物生成碱金属硅醇盐。②CH3CH2OH也可简写成EtOH

(1)连接好装置后,检验装置气密性的操作是:D和E之间夹上止水夹,B中装入适量蒸馏水,___________________________________________________ 说明装置气密性完好。
(2) A装置中发生反应的离子方程式是:_______________________ ;装置C的作用是:_______________________ ;E中所装液体是:__________________ ;
(3)装置D中发生反应的化学方程式为:① CH3SiCl3 + Cl2 → ClCH2SiCl3 + HCl
②___________________________________________________________ ;球形冷凝管的作用是:________________________ ;
(4) 有同学发现该装置有一处不足可能会导致实验失败,应该___________________ ;
(5) 该方法制备氯甲基三乙氧基硅烷的产率(实际产量/理论产量)是:_______________ (保留两位有效数字)。
| 物质 | C2H5OH | CH3SiCl3 | ClCH2SiCl3 | ClCH2Si(OEt)3 |
| 相对分子质量 | 46 | 149.5 | 184 | 212.5 |
| 熔点/℃ | -114.1 | -77.8 | — | — |
| 沸点/℃ | 78.3 | 66.4 | 116.5 | 174 |
| 密度/g·mL | 0.79 | 1.30 | 1.47 | 1.02 |

(1)连接好装置后,检验装置气密性的操作是:D和E之间夹上止水夹,B中装入适量蒸馏水,
(2) A装置中发生反应的离子方程式是:
(3)装置D中发生反应的化学方程式为:① CH3SiCl3 + Cl2 → ClCH2SiCl3 + HCl
②
(4) 有同学发现该装置有一处不足可能会导致实验失败,应该
(5) 该方法制备氯甲基三乙氧基硅烷的产率(实际产量/理论产量)是:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】Ⅰ.铁不能与冷、热水反应,但能与水蒸气反应,完成实验Fe与水蒸气的反应,如图所示。

(1)装置A的作用是______________ ;
(2)B中反应的化学方程式:_______________ ;
(3)碱石灰的作用是_______________________ ;
(4)在D处玻璃管口点燃生成的气体前,必须对该气体进行___________________________ ,这一操作的目的是_____________________________________ ;
(5)当有8.4g铁粉参加反应时,生成的气体在标准状况下的体积是______________ L。
Ⅱ.制备二氧化硫并研究其性质,如图所示。

(1)A中铜与浓硫酸反应的化学方程式是_______________________________________ ;
(2)B、C中的实验现象分别是_________________ 、___________________ ;
(3)浸氢氧化钠溶液的棉花团的作用是_________________________ ,反应的离子方程式是_____________________________ 。

(1)装置A的作用是
(2)B中反应的化学方程式:
(3)碱石灰的作用是
(4)在D处玻璃管口点燃生成的气体前,必须对该气体进行
(5)当有8.4g铁粉参加反应时,生成的气体在标准状况下的体积是
Ⅱ.制备二氧化硫并研究其性质,如图所示。

(1)A中铜与浓硫酸反应的化学方程式是
(2)B、C中的实验现象分别是
(3)浸氢氧化钠溶液的棉花团的作用是
您最近一年使用:0次



