为了除去KCl溶液中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
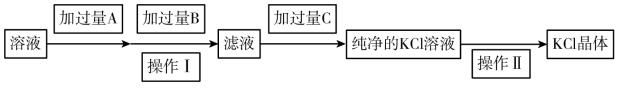
(1)写出上述试剂的化学式:A_____________________ 。
(2)上述操作Ⅰ所用玻璃仪器的名称是__________________ ;操作Ⅱ的名称是_____________ 。
(3) 加过量A时发生有关反应的离子反应方程式为:_________________ 、__________________ 。
(4)检验试剂B是否过量的方法:__________________

(1)写出上述试剂的化学式:A
(2)上述操作Ⅰ所用玻璃仪器的名称是
(3) 加过量A时发生有关反应的离子反应方程式为:
(4)检验试剂B是否过量的方法:
更新时间:2020-07-20 21:19:50
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】通过海水晾晒可以得到粗盐,粗盐除含有NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,下图是某兴趣小组粗盐提纯的实验流程。
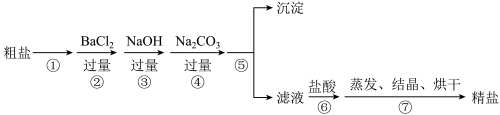
(1)下列叙述正确的是___________。
(2)写出下列序号的离子反应方程式:
②:___________ ;
③:___________ ;
⑥:___________ 。

(1)下列叙述正确的是___________。
| A.步骤①、⑤的操作分别是溶解、过滤 |
| B.步骤④可以与步骤②互换顺序 |
| C.步骤①、⑤、⑦中都会用到玻璃棒 |
| D.步骤②中试剂BaCl2不能换成Ba(NO3)2 |
(2)写出下列序号的离子反应方程式:
②:
③:
⑥:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】制烧碱所用的盐水需进行两次的精制。
(1)第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42-等离子,过程如下:
I.向粗盐水中加入过量X,过滤。
II.向所得滤液中加入过量Y,过滤。
III.滤液用盐酸调节pH,获得一次精制盐水。
请回答下列问题:
①X是__________ 。
②Y是___________ ,加入Y的主要目的_______________ 。
③经检测,II中过滤所得的沉淀中还含有Mg2(OH)2CO3,生成该沉淀的离子方程式是________ 。
(2)第二次精制要除去一次精制盐水中微量的IO3-、NH4+、Ca2+、Mg2+,流程示意图如下:

①IV中除去的离子是____________ (填化学式),判断的理由是_______ 。
②V中得到的溶液颜色呈棕黄色,由此说明Na2S2O3将IO3-还原为______ (填化学式),同时Na2S2O3被氧化为SO42-。此反应中体现了Na2S2O3的_________ 性。假设Na2S2O3已完全反应,则证明盐水b中含有SO42-的方法是__________ ,观察到的现象是____________ 。
③有同学提出,该流程中的过程IV可直接加入NaOH溶液除去NH4+和Mg2+,你认为是否可行?_______ (填“是”或“否”,提示NH3极易溶于水),理由是_______ (答一点)。
(1)第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42-等离子,过程如下:
I.向粗盐水中加入过量X,过滤。
II.向所得滤液中加入过量Y,过滤。
III.滤液用盐酸调节pH,获得一次精制盐水。
请回答下列问题:
①X是
②Y是
③经检测,II中过滤所得的沉淀中还含有Mg2(OH)2CO3,生成该沉淀的离子方程式是
(2)第二次精制要除去一次精制盐水中微量的IO3-、NH4+、Ca2+、Mg2+,流程示意图如下:

①IV中除去的离子是
②V中得到的溶液颜色呈棕黄色,由此说明Na2S2O3将IO3-还原为
③有同学提出,该流程中的过程IV可直接加入NaOH溶液除去NH4+和Mg2+,你认为是否可行?
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】蛋壳是一种很好的绿色钙源,其主要成分为CaCO3.以蛋壳为原料制备葡萄糖酸钙晶体[M( )=448g/mol],并对其纯度进行测定,过程如下:
)=448g/mol],并对其纯度进行测定,过程如下:
步骤Ⅰ.葡萄糖酸钙晶体的制备

步骤Ⅱ.产品纯度测定——KMnO4间接滴定法
①称取步骤Ⅰ中制得的产品2.24g置于烧杯中,加入蒸馏水及适量稀盐酸溶解;
②加入足量(NH4)2C2O4溶液,用氨水调节pH为4~5,生成白色沉淀,过滤、洗涤;
③将②洗涤后所得的固体溶于稀硫酸溶液中,用0.05 mol·L-1KMnO4标准溶液滴定,消耗KMnO4标准溶液36.00ml。
根据以上两个步骤,回答下列问题:
(1)步骤Ⅰ中煅烧需要使用的仪器有_______(填标号)。
(2)步骤Ⅰ中“操作a”是蒸发浓缩、_______ 、过滤、洗涤、_______ 。
(3)步骤Ⅱ中用氨水调节pH为4~5后如何洗涤生成的晶体_______ 。
(4)用KMnO4标准溶液滴定待测液的反应原理为_______ ,(用离子方程式表示),判断滴定达到终点的现象为_______ 。
(5)根据以上实验数据,测得产品中葡萄糖酸钙晶体的纯度为_______ 。
 )=448g/mol],并对其纯度进行测定,过程如下:
)=448g/mol],并对其纯度进行测定,过程如下:步骤Ⅰ.葡萄糖酸钙晶体的制备

步骤Ⅱ.产品纯度测定——KMnO4间接滴定法
①称取步骤Ⅰ中制得的产品2.24g置于烧杯中,加入蒸馏水及适量稀盐酸溶解;
②加入足量(NH4)2C2O4溶液,用氨水调节pH为4~5,生成白色沉淀,过滤、洗涤;
③将②洗涤后所得的固体溶于稀硫酸溶液中,用0.05 mol·L-1KMnO4标准溶液滴定,消耗KMnO4标准溶液36.00ml。
根据以上两个步骤,回答下列问题:
(1)步骤Ⅰ中煅烧需要使用的仪器有_______(填标号)。
A. | B. | C. | D. |
(3)步骤Ⅱ中用氨水调节pH为4~5后如何洗涤生成的晶体
(4)用KMnO4标准溶液滴定待测液的反应原理为
(5)根据以上实验数据,测得产品中葡萄糖酸钙晶体的纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是____________ 。
(2)步骤Ⅱ吸收Br2,有关反应的化学方程式为___________________________ ,由此反应可知,除环境保护外,在工业生产中还应解决的主要问题是_________________ 。
(3)某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了装置简图:

请你参与分析讨论:
①图中仪器B的名称是____________________ 。
②实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?____ 。

(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是
(2)步骤Ⅱ吸收Br2,有关反应的化学方程式为
(3)某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了装置简图:

请你参与分析讨论:
①图中仪器B的名称是
②实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】实验室以工业废渣(主要含CaSO4·2H2O,还含少量SiO2、Al2O3、Fe2O3)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如图所示。

请回答下列问题:
(1)将氨水和NH4HCO3溶液混合,可制得(NH4)2CO3溶液,其离子方程式为_____ ;浸取废渣时,向(NH4)2CO3溶液中加入适量浓氨水的目的是________ 。
(2)废渣浸取在如图所示的装置中进行控制反应温度在0~70℃,搅拌,反应3小时,温度过高将会导致CaSO4的转换率下降,其原因是________ ;保持温度反应时间、反应物和溶剂的量不变,实验中提高CaSO4转化率的操作有________ 。

(3)滤渣水洗后,经多步处理得到制备轻质CaCO3所需的CaCl2溶液。设计以水洗后的滤渣为原料,制取CaCl2溶液的实验方案:在搅拌下向足量的稀盐酸中分批加入滤渣,待观察不到气泡后,过滤,向滤液中分批加入少量的氢氧化钙,用pH试纸测量溶液的pH,当pH介于5~8.5时,过滤[已知pH=5时Fe(OH)3和Al(OH)3沉淀完全pH=8.5时Al(OH)3开始溶解。实验中必须使用的试剂:盐酸和Ca(OH)2____________________________________________

请回答下列问题:
(1)将氨水和NH4HCO3溶液混合,可制得(NH4)2CO3溶液,其离子方程式为
(2)废渣浸取在如图所示的装置中进行控制反应温度在0~70℃,搅拌,反应3小时,温度过高将会导致CaSO4的转换率下降,其原因是

(3)滤渣水洗后,经多步处理得到制备轻质CaCO3所需的CaCl2溶液。设计以水洗后的滤渣为原料,制取CaCl2溶液的实验方案:在搅拌下向足量的稀盐酸中分批加入滤渣,待观察不到气泡后,过滤,向滤液中分批加入少量的氢氧化钙,用pH试纸测量溶液的pH,当pH介于5~8.5时,过滤[已知pH=5时Fe(OH)3和Al(OH)3沉淀完全pH=8.5时Al(OH)3开始溶解。实验中必须使用的试剂:盐酸和Ca(OH)2
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】以萃铜余液为原料制备工业活性氧化锌,其生产工艺流程如图所示:
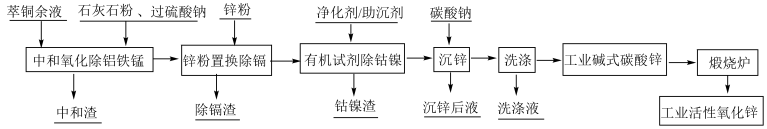
(1)铜萃余液含硫酸30~60g/L,设计采用过硫酸钠(Na2S2O8)氧化法除锰,写出Mn2+被氧化成MnO2的离子方程式_______ ;采用石灰石粉中和除去铝和铁,则中和渣中主要成分为_______ 。
(2)流程中用到最多的操作是_______ ,该操作中玻璃棒的作用是_______ 。
(3)用锌粉除镉(Cd2+ )的离子方程式为_______ ;沉锌生成碱式碳酸锌[2Zn(OH2)·ZnCO3·H2O]的化学方程式为_______ 。
(4)检验碱式碳酸锌洗涤干净的操作及现象为_______ 。
(5)煅烧炉中发生反应的化学方程式为_______ 。

(1)铜萃余液含硫酸30~60g/L,设计采用过硫酸钠(Na2S2O8)氧化法除锰,写出Mn2+被氧化成MnO2的离子方程式
(2)流程中用到最多的操作是
(3)用锌粉除镉(Cd2+ )的离子方程式为
(4)检验碱式碳酸锌洗涤干净的操作及现象为
(5)煅烧炉中发生反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】为了探究化合物A(含三种元素)的组成和性质,设计并完成如下实验:

已知:①气体B是由两种元素组成的纯净物,流程图中混合气体通过浓硫酸后,浓硫酸增重3.60g。②溶液E的焰色试验呈黄色。
请回答:
(1)组成A的元素是H、___________ 和___________ (写元素符号)。
(2)气体C的分子式是___________ 。
(3)固体A与足量水反应的化学方程式是___________ 。
(4)请写出溶液E进行焰色试验的操作___________ 。

已知:①气体B是由两种元素组成的纯净物,流程图中混合气体通过浓硫酸后,浓硫酸增重3.60g。②溶液E的焰色试验呈黄色。
请回答:
(1)组成A的元素是H、
(2)气体C的分子式是
(3)固体A与足量水反应的化学方程式是
(4)请写出溶液E进行焰色试验的操作
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】现有A、B、C、D、E六种元素原子序数依次增大;只有E不是短周期元素;对其分别描述如下表:
(1)元素D的最高价氧化物为无色液体, 0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式______________________ ;
(2)用一个化学方程式表示C与E的金属性强弱_____________________________ 。
(3)A与B两种元素组成一种阳离子,检验某溶液中含有该离子的方法是__________ 。
(4)含C的某化合物可用作净水剂,该物质的水溶液呈酸性,其原因是________________ 。(用离子方程式表示)
(5)E单质在海水中易被腐蚀,写出正极反应式:______________________ 。
| 元素编号 | 元素描述 |
| A | 单质是最理想的气体燃料;而氧化物是最常用的液态灭火剂 |
| B | 氧化物之一不但能造成酸雨,还能造成光化学烟雾 |
| C | 所处周期数、族序数都与电子层数相等 |
| D | 最高化合价为+7 |
| E | 目前用量最大,应用最广泛的金属 |
(2)用一个化学方程式表示C与E的金属性强弱
(3)A与B两种元素组成一种阳离子,检验某溶液中含有该离子的方法是
(4)含C的某化合物可用作净水剂,该物质的水溶液呈酸性,其原因是
(5)E单质在海水中易被腐蚀,写出正极反应式:
您最近一年使用:0次




