以氨气代替氢气研发氨燃料电池是当前科研的一个热点.
(1)氨燃料电池使用的电解质溶液是2mol•L﹣1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O.该电池负极的电极反应式为______ ;每消耗1.7g NH3转移的电子数目为______ .
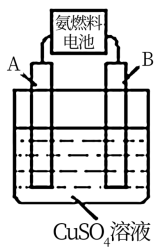
(2)用氨燃料电池电解CuSO4溶液,如图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,则B电极上发生的电极反应式为______ ;此时向所得溶液中加入8gCuO固体后恰好可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为_______ L.
(3)纳米级氧化亚铜(Cu2O)是一种重要光电材料.现用铜棒和石墨做电极,饱和食盐水做电解质制备纳米级氧化亚铜(Cu2O),电解反应为2Cu+H2O Cu2O+H2↑铜棒上发生的电极反应式为
Cu2O+H2↑铜棒上发生的电极反应式为__ .
(1)氨燃料电池使用的电解质溶液是2mol•L﹣1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O.该电池负极的电极反应式为
(2)用氨燃料电池电解CuSO4溶液,如图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,则B电极上发生的电极反应式为

(3)纳米级氧化亚铜(Cu2O)是一种重要光电材料.现用铜棒和石墨做电极,饱和食盐水做电解质制备纳米级氧化亚铜(Cu2O),电解反应为2Cu+H2O
 Cu2O+H2↑铜棒上发生的电极反应式为
Cu2O+H2↑铜棒上发生的电极反应式为
更新时间:2020-07-30 17:12:35
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】自然界中的能量存在多种能量转化形式,化学能可以转变为热能,也可以转变为电能。回答下列问题:

如图所示,是原电池的装置图。回答问题
(1)若A为Zn电极,B为Cu电极,C为 溶液,A是
溶液,A是_______ 极(填正极或负极),Cu极发生反应的类型为_______ 。
(2)若需将反应 设计成如图所示的原电池装置,则A极(负极)材料为
设计成如图所示的原电池装置,则A极(负极)材料为_______ ,B极电极反应式为_______ 。
(3)航天技术上使用的一种氢—氧燃料电池原理可以简单看作下图,则:
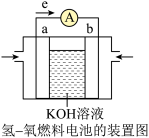
该氢氧燃料电池的正极反应式为_______ ,工作时氢氧根向_______ (a或b)极移动。

如图所示,是原电池的装置图。回答问题
(1)若A为Zn电极,B为Cu电极,C为
 溶液,A是
溶液,A是(2)若需将反应
 设计成如图所示的原电池装置,则A极(负极)材料为
设计成如图所示的原电池装置,则A极(负极)材料为(3)航天技术上使用的一种氢—氧燃料电池原理可以简单看作下图,则:

该氢氧燃料电池的正极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】利用原电池原理可以探究物质的还原性强弱。实验中,电流表指针的偏转方向均与电子的移动方向一致,阴离子交换膜只允许阴离子通过。回答下列问题:
(1)按照如图连接装置后,电流表指针向Co电极偏转,该原电池的总反应离子方程式为___________ ,由此可以判断:Co的还原性比Zn的还原性___________ (填强或弱)。

(2)上图中Co电极和CoSO4溶液接触的界面两侧存在电势差,称为该电极的电极电势,该电极的电对符号为Co2+/Co,电对中Co2+是氧化型,Co是还原型。金属离子的浓度为1mol/L时部分电极的电极电势如下表所示:
①根据第(1)小题中实验结论和表中数据推测:电极电势越低,电对中还原型的还原性越___________ (填强或弱)。
②为验证上述推测,利用0.34和-0.41两组数据进行实验,请补全原电池装置。

电极X的化学式为___________ ,某浓度的溶液Y为___________ ,某浓度的溶液Z为___________ 。
③若上述推测成立,电流表指针向___________ (填X或Cu)电极偏转,负极的电极反应式为___________ 。
(1)按照如图连接装置后,电流表指针向Co电极偏转,该原电池的总反应离子方程式为

(2)上图中Co电极和CoSO4溶液接触的界面两侧存在电势差,称为该电极的电极电势,该电极的电对符号为Co2+/Co,电对中Co2+是氧化型,Co是还原型。金属离子的浓度为1mol/L时部分电极的电极电势如下表所示:
| 电对符号 | Cu2+/Cu | Co2+/Co | Cd2+/Cd | Zn2+/Zn |
| 电极电势/V | 0.34 | -0.28 | -0.41 | -0.76 |
①根据第(1)小题中实验结论和表中数据推测:电极电势越低,电对中还原型的还原性越
②为验证上述推测,利用0.34和-0.41两组数据进行实验,请补全原电池装置。

电极X的化学式为
③若上述推测成立,电流表指针向
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】按要求回答下列问题:
I.某温度时,在2L密闭容器中某一反应中气体A、B的物质的量随时间变化的曲线如下图所示,回答下列问题:
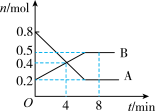
(1)该反应的化学方程式为________ 。
(2)0~4min内,用A表示反应速率v(A)=______ 。
(3)反应达平衡时容器内混合气体的平均相对分子质量比起始时______ (填“变大”、“变小”或“相等”)。
(4)下列措施能加快反应速率的是_______ 。
A.缩小体积,使压强增大 B.恒温恒容充入He气 C.恒温恒压充入He气 D.使用催化剂
Ⅱ.化学能与电能之间可以相互转化。
(1)直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是_________
A.Ba(OH)2·8H2O与NH4Cl反应 B.氢氧化钠与稀盐酸反应
C.灼热的炭与CO2反应 D.H2与Cl2燃烧反应
(2)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
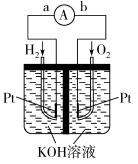
①电池的负极反应式为:_______ 。
②电池工作时OH-向移动_______ (填“正极”或“负极”)。
③正极上消耗标况下4.48L气体时,转移电子的数目为________ 。
I.某温度时,在2L密闭容器中某一反应中气体A、B的物质的量随时间变化的曲线如下图所示,回答下列问题:

(1)该反应的化学方程式为
(2)0~4min内,用A表示反应速率v(A)=
(3)反应达平衡时容器内混合气体的平均相对分子质量比起始时
(4)下列措施能加快反应速率的是
A.缩小体积,使压强增大 B.恒温恒容充入He气 C.恒温恒压充入He气 D.使用催化剂
Ⅱ.化学能与电能之间可以相互转化。
(1)直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是
A.Ba(OH)2·8H2O与NH4Cl反应 B.氢氧化钠与稀盐酸反应
C.灼热的炭与CO2反应 D.H2与Cl2燃烧反应
(2)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:

①电池的负极反应式为:
②电池工作时OH-向移动
③正极上消耗标况下4.48L气体时,转移电子的数目为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】能源是现代文明的原动力,化学电池在生产生活中有着广泛的应用。
(1)根据构成原电池的本质判断,下列反应可以设计成原电池的是_______ (填标号)。
A.C(s)+H2O(g)=CO(g)+H2(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2CO(g)+O2(g)=2CO2(g)
(2)为了探究化学反应中的能量变化,某同学设计了如图所示两个实验。有关实验现象,下列说法正确的是___________(填标号)。
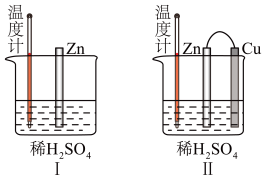
(3)图Ⅱ中外电路中的电子是从_______ (填“Zn”或“Cu”)电极经导线流向_______ 电极。若反应过程中有0.2 mol电子发生转移,则生成的氢气在标准状况下的体积为___________ 。若电池的总反应为2Fe3++Cu=2Fe2++Cu2+,则负极材料是______ (填化学式),正极反应式为_______________
(4)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计如图为CH4燃料电池示意图,工作时电子流向如图所示。

写出电极A的电极反应式_______ ,电极A附近pH如何变化?_______ (填“变大”或“变小”)。
(1)根据构成原电池的本质判断,下列反应可以设计成原电池的是
A.C(s)+H2O(g)=CO(g)+H2(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2CO(g)+O2(g)=2CO2(g)
(2)为了探究化学反应中的能量变化,某同学设计了如图所示两个实验。有关实验现象,下列说法正确的是___________(填标号)。

| A.图Ⅰ和图Ⅱ的气泡均产生于锌棒表面 |
| B.图Ⅱ中产生气体的速率比图Ⅰ快 |
| C.图Ⅰ中温度计的示数高于图Ⅱ的示数 |
| D.图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温 |
(4)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计如图为CH4燃料电池示意图,工作时电子流向如图所示。

写出电极A的电极反应式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】完成下列填空
(1) 的电子式是
的电子式是______ .
(2) 的系统命名是
的系统命名是______ .
(3)锌片、铜片连接后浸入稀硫酸形成原电池,正极反应式是______ .
(4)写出苯和液溴在催化剂作用下生成溴苯的化学方程式______ .
(5)已知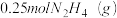 完全燃烧生成氮气和气态水时,放出
完全燃烧生成氮气和气态水时,放出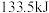 热量.写出该反应的热化学方程式
热量.写出该反应的热化学方程式______ .
(1)
 的电子式是
的电子式是(2)
 的系统命名是
的系统命名是(3)锌片、铜片连接后浸入稀硫酸形成原电池,正极反应式是
(4)写出苯和液溴在催化剂作用下生成溴苯的化学方程式
(5)已知
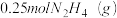 完全燃烧生成氮气和气态水时,放出
完全燃烧生成氮气和气态水时,放出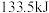 热量.写出该反应的热化学方程式
热量.写出该反应的热化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】(1)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为___________ ,该电池总反应的离子方程式为______________ 。
(2)尿素[CO(NH2)2]在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为____ 。可将该反应设计成碱性燃料电池除去烟气中的氮氧化物,该燃料电池负极的电极反应式是______________ ,正极的电极反应式是__________________ 。
(2)尿素[CO(NH2)2]在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中 G 为电流计。请回答下列问题

(1)以下叙述中,正确的是_____ 。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的 pH 均增大
D.乙中电子从铜片经导线流向锌片
E.乙溶液中SO42-向锌片方向移动
(2)变化过程中能量转化的形式主要是:甲为_____ ;乙为____________ 。
(3)若反应过程中有 2mol 电子发生转移,则生成的氢气在标况下的体积为______ ;
(4)原电池在工作时,下列反应可以作为原电池工作时发生的反应的是:_____
A. Cu2AgNO3Cu(NO3 )22Ag
B.H2SO4+ Na2SO3==Na2SO4+ SO2+H2O
C.NaOHHClNaClH2O
D.2H2O22H2O

(1)以下叙述中,正确的是
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的 pH 均增大
D.乙中电子从铜片经导线流向锌片
E.乙溶液中SO42-向锌片方向移动
(2)变化过程中能量转化的形式主要是:甲为
(3)若反应过程中有 2mol 电子发生转移,则生成的氢气在标况下的体积为
(4)原电池在工作时,下列反应可以作为原电池工作时发生的反应的是:
A. Cu2AgNO3Cu(NO3 )22Ag
B.H2SO4+ Na2SO3==Na2SO4+ SO2+H2O
C.NaOHHClNaClH2O
D.2H2O22H2O
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】2019年诺贝尔化学奖颁给了三位为锂离子电池发展做出巨大贡献的科学家,锂离子电池广泛应用于手机、笔记本电脑等。
(1)锂元素在元素周期表中的位置:_________________ 。
(2)氧化锂(Li2O)是制备锂离子电池的重要原料,氧化锂的电子式为_____________ 。
(3)近日华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出了石墨烯电池,电池反应式为LIxC6+Li1-x C6+LiCoO2,其工作原理如图。
C6+LiCoO2,其工作原理如图。

①石墨烯的优点是提高电池的能量密度,石墨烯为层状结构,层与层之间存在的作用力是_______ 。
②锂离子电池不能用水溶液做离子导体的原因是___________ (用离子方程式表示)。
③锂离子电池放电时正极的电极反应式为________________ 。
④请指出使用锂离子电池的注意问题____________________ 。(回答一条即可)
(1)锂元素在元素周期表中的位置:
(2)氧化锂(Li2O)是制备锂离子电池的重要原料,氧化锂的电子式为
(3)近日华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出了石墨烯电池,电池反应式为LIxC6+Li1-x
 C6+LiCoO2,其工作原理如图。
C6+LiCoO2,其工作原理如图。
①石墨烯的优点是提高电池的能量密度,石墨烯为层状结构,层与层之间存在的作用力是
②锂离子电池不能用水溶液做离子导体的原因是
③锂离子电池放电时正极的电极反应式为
④请指出使用锂离子电池的注意问题
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】现有如下两个反应:(A)NaOH+HCl===NaCl+H2O (B)2FeCl3+Cu===2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)(A)______ (B)________ ;
(2)如果(A或B)不能,说明其原因________________ ;
(3)如果(A或B)可以,则在下面方框中画出装置图并写出正、负极材料及电极反应式______

负极:________、_________________________ ;
正极:________、__________________________ 。
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)(A)
(2)如果(A或B)不能,说明其原因
(3)如果(A或B)可以,则在下面方框中画出装置图并写出正、负极材料及电极反应式

负极:________、
正极:________、
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)高铁酸钾 不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。总反应式为
不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。总反应式为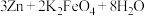
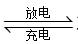
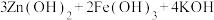 ,如图是高铁电池的模拟实验装置:
,如图是高铁电池的模拟实验装置:

①该电池盐桥中盛有饱和 溶液,此盐桥中氯离子向
溶液,此盐桥中氯离子向______ (填“左”或“右”)移动。
②该电池放电时正极的电极反应式为______ ;充电时每转移0.3mol电子,有______ mol 生成,正极附近溶液的碱性
生成,正极附近溶液的碱性______ (填“增强”,“不变”或“减弱”)。
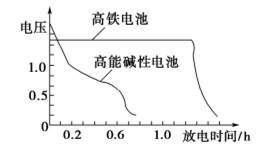
③上图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有_________________ 。
(2)“ ”电池可将
”电池可将 变废为宝。我国科研人员研制出的可充电“
变废为宝。我国科研人员研制出的可充电“ ”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为
”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为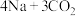

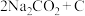 。放电时该电池“吸入”
。放电时该电池“吸入” ,其工作原理如图所示:
,其工作原理如图所示:
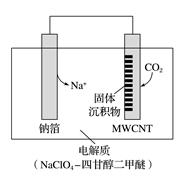
①充电时,正极的电极反应式为________________________________ 。
②放电时,若生成的 和
和 全部沉积在电极表面,当转移0.2mol
全部沉积在电极表面,当转移0.2mol 时,两极的质量差为
时,两极的质量差为______ 。
 不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。总反应式为
不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。总反应式为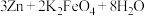

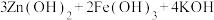 ,如图是高铁电池的模拟实验装置:
,如图是高铁电池的模拟实验装置:
①该电池盐桥中盛有饱和
 溶液,此盐桥中氯离子向
溶液,此盐桥中氯离子向②该电池放电时正极的电极反应式为
 生成,正极附近溶液的碱性
生成,正极附近溶液的碱性
③上图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有
(2)“
 ”电池可将
”电池可将 变废为宝。我国科研人员研制出的可充电“
变废为宝。我国科研人员研制出的可充电“ ”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为
”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为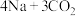

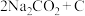 。放电时该电池“吸入”
。放电时该电池“吸入” ,其工作原理如图所示:
,其工作原理如图所示:
①充电时,正极的电极反应式为
②放电时,若生成的
 和
和 全部沉积在电极表面,当转移0.2mol
全部沉积在电极表面,当转移0.2mol 时,两极的质量差为
时,两极的质量差为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.如图为原电池装置示意图。
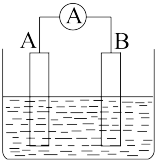
(1)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧 燃料电池,B电极为_____ 极(填“正”或“负”)。写出A电极反应式:_____ 。该电池在工作一段时间后,溶液的碱性将_____ (填“增强” “减弱”或“不变”)。
Ⅱ.现用图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量。量筒的规格为1000 mL,供选择的电极材料有纯铜片和纯锌片。
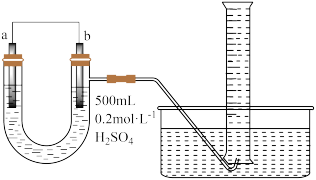
(2)b电极材料为_____ ,其电极反应式为_____ 。
(3)当量筒中收集到672 mL(标准状况下)气体时,通过导线的电子的物质的量为_____ ,此时a电极质量_____ (填“增加”或“减少”)_____ g。
(4)如果将a、b两电极的电极材料对调,U形管中将出现的现象是_____ 。

(1)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧 燃料电池,B电极为
Ⅱ.现用图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量。量筒的规格为1000 mL,供选择的电极材料有纯铜片和纯锌片。

(2)b电极材料为
(3)当量筒中收集到672 mL(标准状况下)气体时,通过导线的电子的物质的量为
(4)如果将a、b两电极的电极材料对调,U形管中将出现的现象是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】人们应用原电池原理制作了多种电池,以满足不同的需要,广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)铅蓄电池在放电时发生的电池反应式为Pb+PbO2+2H2SO4===2PbSO4+2H2O。正极电极反应式为_________ 。电池工作一段时间后需要充电,充电过程中H2SO4的浓度_____ (填“增大”、“减小”或“不变”)。
(2)某学习小组依据氧化还原反应:2Ag++Cu===Cu2++2Ag设计成原电池,则负极发生的电极反应式为_____________________ ;当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4 g,则该原电池反应转移的电子数目是_________________ 。
(3)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:

①该电池的正极反应式为_________________ 。
②若该电池的效率80%,当外电路通过0.2 mol电子时,消耗O2的体积___________ L(标准状况)。
(1)铅蓄电池在放电时发生的电池反应式为Pb+PbO2+2H2SO4===2PbSO4+2H2O。正极电极反应式为
(2)某学习小组依据氧化还原反应:2Ag++Cu===Cu2++2Ag设计成原电池,则负极发生的电极反应式为
(3)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:

①该电池的正极反应式为
②若该电池的效率80%,当外电路通过0.2 mol电子时,消耗O2的体积
您最近一年使用:0次



