化学反应伴随着能量变化是化学反应的基本特征之一。
(1)已知拆开1molH-H键、1moll-I键、1molH-I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1molH2和1molI2,反应生成HI会___ (填“放出”或“吸收”)___ kJ的热量。
(2)下列反应中属于放热反应的是___ ,属于吸热反应的是___ 。
①物质燃烧②炸药爆炸③酸碱中和反应④二氧化碳通过炽热的碳⑤食物因氧化而腐败⑥Ba(OH)2•8H2O与NH4Cl反应⑦铁粉与稀盐酸反应
(3)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如图所示。
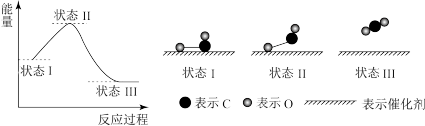
下列说法中正确的是___ 。
A.CO和O生成CO2是放热反应
B.CO和O生成了具有极性共价键的CO2
C.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
(1)已知拆开1molH-H键、1moll-I键、1molH-I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1molH2和1molI2,反应生成HI会
(2)下列反应中属于放热反应的是
①物质燃烧②炸药爆炸③酸碱中和反应④二氧化碳通过炽热的碳⑤食物因氧化而腐败⑥Ba(OH)2•8H2O与NH4Cl反应⑦铁粉与稀盐酸反应
(3)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如图所示。

下列说法中正确的是
A.CO和O生成CO2是放热反应
B.CO和O生成了具有极性共价键的CO2
C.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
更新时间:2020/08/27 21:49:06
|
相似题推荐
填空题
|
较易
(0.85)
名校
【推荐1】完成下列问题。
(1)在25℃、101kPa的条件下:
①由H+H→H2,当生成1molH2时,要___________ (填“吸收”或“放出”)436kJ的能量;由Cl2→Cl+Cl,当断裂1molCl2中的共价键时,要___________ (填“吸收”或“放出”)243kJ的能量。
②对于反应H2(g)+Cl2(g)==2HCl(g),测得生成2molHCl(g)时,反应过程中放出193kJ的热量,则断开1molH-Cl键所需的能量是___________ kJ。
③有两个反应:a.H2(g)+Cl2(g) 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g) 2HCl(g)。这两个反应的能量转化方式主要是
2HCl(g)。这两个反应的能量转化方式主要是___________ 能转化为___________ 能,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量___________ (填“相等”或“不相等”)。
(2)利用反应4HCl+O2 2Cl2+2H2O,可实现氯的循环利用,已知:该反应中,2molHCl被氧化时,放出57.8kJ的热量。
2Cl2+2H2O,可实现氯的循环利用,已知:该反应中,2molHCl被氧化时,放出57.8kJ的热量。
①4molHCl被氧化时,放出___________ kJ的热量。
②断开1molH—O键与断开1molH-Cl键所需能量相差___________ kJ,H2O中H-O键比HCl中H-Cl键(填“强”或“弱”)___________ 。
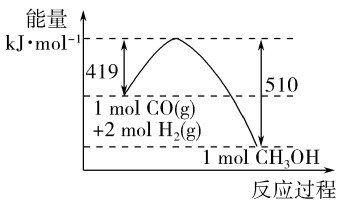
(3)根据图示的能量转化关系判断,生成16gCH3OH(l)___________ (填“吸收”或“放出”)___________ kJ能量。
(1)在25℃、101kPa的条件下:
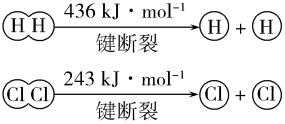
①由H+H→H2,当生成1molH2时,要
②对于反应H2(g)+Cl2(g)==2HCl(g),测得生成2molHCl(g)时,反应过程中放出193kJ的热量,则断开1molH-Cl键所需的能量是
③有两个反应:a.H2(g)+Cl2(g)
 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g) 2HCl(g)。这两个反应的能量转化方式主要是
2HCl(g)。这两个反应的能量转化方式主要是(2)利用反应4HCl+O2
 2Cl2+2H2O,可实现氯的循环利用,已知:该反应中,2molHCl被氧化时,放出57.8kJ的热量。
2Cl2+2H2O,可实现氯的循环利用,已知:该反应中,2molHCl被氧化时,放出57.8kJ的热量。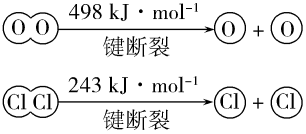
①4molHCl被氧化时,放出
②断开1molH—O键与断开1molH-Cl键所需能量相差
(3)根据图示的能量转化关系判断,生成16gCH3OH(l)
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】某一化学反应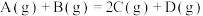
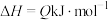 ,一定条件下反应过程中的能量变化如图所示。
,一定条件下反应过程中的能量变化如图所示。
(1)Q_____ 0(填“>”“<”或“=”)。
(2)熵变
_____ 0(填“>”“<”或“=”)。
(3)该反应_____ 自发进行;若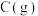 改为
改为 其他不变,该反应
其他不变,该反应_____ 自发进行。(填“能”、“不能”或“可能”)。
(4)反应物键能之和数值_____ 生成物键能之和(填“>”“<”或“=”)
(5)该反应_____ 氧化还原反应(填“是”“不是”或“可能是”)
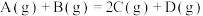
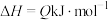 ,一定条件下反应过程中的能量变化如图所示。
,一定条件下反应过程中的能量变化如图所示。
(1)Q
(2)熵变

(3)该反应
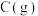 改为
改为 其他不变,该反应
其他不变,该反应(4)反应物键能之和数值
(5)该反应
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】化学反应与生产、生活及很多研究领域存在着广泛的联系,化学反应原理的研究与其他科学的研究在相互促进中发展。
(1)已知反应 中相关的化学键键能数据如表:
中相关的化学键键能数据如表:
若有1mol 生成,反应需要
生成,反应需要_________ (填“吸收”或“放出”)_________ kJ能量。
(2)在体积为2L的绝热刚性密闭容器中发生反应: ,
, 随时间的变化如下表所示:
随时间的变化如下表所示:
①用 表示0~2s内该反应的平均速率v=
表示0~2s内该反应的平均速率v=___________ mol/(L•s)
②从表格数据可知,该反应速率先加快,再减慢,请说明反应速率加快的原因是___________ 。
③对于该反应,下列说法正确的是___________ 。
A.当混合气体平均摩尔质量不变,说明反应达到平衡
B.当消耗1molCO,同时生成1mol ,说明反应达到平衡
,说明反应达到平衡
C.当温度不变,说明反应达到平衡
D.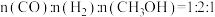 ,说明反应已达平衡
,说明反应已达平衡
(3)乙醇燃料电池可以作为笔记本电脑、汽车等的能量来源,其工作原理如图所示,质子交换膜只允许H通过。请回答下列问题:___________ 。
②电池工作时, 移向
移向___________ (填“a”或“b”)电极。
(1)已知反应
 中相关的化学键键能数据如表:
中相关的化学键键能数据如表:| 化学键 | H—H | C—O | C≡O | H—O | C—H |
E( ) ) | 436 | 343 | 1076 | 465 | 413 |
 生成,反应需要
生成,反应需要(2)在体积为2L的绝热刚性密闭容器中发生反应:
 ,
, 随时间的变化如下表所示:
随时间的变化如下表所示:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
 /mol /mol | 0.40 | 0.32 | 0.20 | 0.10 | 0.06 | 0.06 | 0.06 |
 表示0~2s内该反应的平均速率v=
表示0~2s内该反应的平均速率v=②从表格数据可知,该反应速率先加快,再减慢,请说明反应速率加快的原因是
③对于该反应,下列说法正确的是
A.当混合气体平均摩尔质量不变,说明反应达到平衡
B.当消耗1molCO,同时生成1mol
 ,说明反应达到平衡
,说明反应达到平衡C.当温度不变,说明反应达到平衡
D.
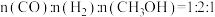 ,说明反应已达平衡
,说明反应已达平衡(3)乙醇燃料电池可以作为笔记本电脑、汽车等的能量来源,其工作原理如图所示,质子交换膜只允许H通过。请回答下列问题:
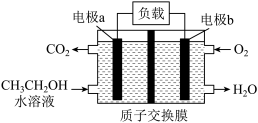
②电池工作时,
 移向
移向
您最近一年使用:0次
【推荐1】I.实验室利用如图装置进行中和热的测定,请回答下列问题:
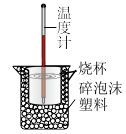
(1)该图中缺少的仪器或用品有__ 。
(2)①如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”绝对值将___ (填“偏大”“偏小”或“不变")
②如用0.5mol/L的CH3COOH与0.5mol/LNaOH进行实验,则实验中测得的“中和热”△H将___ (填“偏大”“偏小”或“不变")
③如用18.4mol/L的H2SO4与0.5mol/LNaOH进行实验,则实验中测得的“中和热”△H将___ 。(填“偏大”“偏小”或“不变")
II.CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如图所示:

(3)该过程用化学反应方程式表示为___ ,反应的△H___ 0(填“<”>”或“=”)。
(4)从起始到过渡态断裂的化学键有___ ,该过程___ (填“放出”或“吸收”)能量。

(1)该图中缺少的仪器或用品有
(2)①如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”绝对值将
②如用0.5mol/L的CH3COOH与0.5mol/LNaOH进行实验,则实验中测得的“中和热”△H将
③如用18.4mol/L的H2SO4与0.5mol/LNaOH进行实验,则实验中测得的“中和热”△H将
II.CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如图所示:

(3)该过程用化学反应方程式表示为
(4)从起始到过渡态断裂的化学键有
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】放热反应不需要加热就能反应,吸热反应不加热就不能反应。______
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】Ⅰ.反应Fe+H2SO4=FeSO4+H2↑的能量变化如图所示:
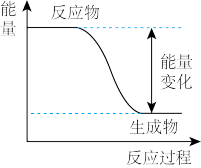
(1)该反应为_______ 反应(填“吸热”或“放热”)。
(2)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_______ (填“正”或“负”)极。外电路中电流由_______ 流出。(填电极材料名称)。
(3)若要使该反应的反应速率加快,下列生成物措施可行的是_______。
Ⅱ.在一定温度下将2molA气体和4molB气体在2L密闭容器中混合并发生反应:A(g)+2B(g) 3C(g)+D(s)。若经2min后测得C的浓度为0.6mol·L-1,则:
3C(g)+D(s)。若经2min后测得C的浓度为0.6mol·L-1,则:
(4)用物质A表示的反应速率为_______ 。
(5)2min时物质B的浓度为_______ 。B的转化率为_______ 。
(6)当下列哪些项不再发生变化时,表明上述反应已达到平衡状态_______ 。
A.混合气体的压强 B.混合气体的密度
C.混合气体的平均相对分子质量 D.混合气体的总物质的量
E.单位时间内消耗1molB同时生成1.5molC F.用A、B、C表示的速率比为1:2:3
G.正反应速率v(B)=0.4 mol·L-1·min-1,逆反应速率v(D)=0.6 mol·L-1·min-1
(7)下列说法正确的是_______ 。
A.升高温度改变化学反应的限度 B.化学反应的限度与时间长短无关
C.增大B的浓度,正反应速率加快,逆反应速率减慢 D.化学反应的限度是不可能改变的
E.已知正反应是吸热反应,升高温度正反应速率加快,逆反应速率减慢

(1)该反应为
(2)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为
(3)若要使该反应的反应速率加快,下列生成物措施可行的是_______。
| A.改铁片为铁粉 | B.改稀硫酸为98%的硫酸 |
| C.增大压强 | D.滴加几滴CuSO4溶液 |
Ⅱ.在一定温度下将2molA气体和4molB气体在2L密闭容器中混合并发生反应:A(g)+2B(g)
 3C(g)+D(s)。若经2min后测得C的浓度为0.6mol·L-1,则:
3C(g)+D(s)。若经2min后测得C的浓度为0.6mol·L-1,则:(4)用物质A表示的反应速率为
(5)2min时物质B的浓度为
(6)当下列哪些项不再发生变化时,表明上述反应已达到平衡状态
A.混合气体的压强 B.混合气体的密度
C.混合气体的平均相对分子质量 D.混合气体的总物质的量
E.单位时间内消耗1molB同时生成1.5molC F.用A、B、C表示的速率比为1:2:3
G.正反应速率v(B)=0.4 mol·L-1·min-1,逆反应速率v(D)=0.6 mol·L-1·min-1
(7)下列说法正确的是
A.升高温度改变化学反应的限度 B.化学反应的限度与时间长短无关
C.增大B的浓度,正反应速率加快,逆反应速率减慢 D.化学反应的限度是不可能改变的
E.已知正反应是吸热反应,升高温度正反应速率加快,逆反应速率减慢
您最近一年使用:0次



