在众多的化学反应现象中,化学振荡现象最为令人惊奇,化学振荡实验很多,其中酸与铁丝的反应就是其中一例。某合作小组的同学查阅文献资料后,拟做铁丝与酸的化学振荡实验并进行探究。
实验步骤:
①将2 cm左右的铁丝夹成多段,放在培养皿中,先用热的碳酸钠溶液除去铁丝表面的油污,用蒸馏水冲洗后,再用某种试剂X浸泡到有大量气泡时取出,用蒸馏水冲洗干净。
②在细口瓶中加入30 mL 1.0 mol·L-1的H2SO4、3 mL 30%的H2O2溶液,将处理后的铁丝放入其中。
③观察现象:铁丝表面产生气泡,随后消失,再产生气泡,再消失的周而往复的化学振荡现象出现,振荡周期约20秒,可维持数小时。
试回答下列问题:
(1)步骤①中,用试剂X可除去铁钉表面的铁的氧化物或镀层,所用的试剂X可能是___________ (填序号)。
A.NaOH B.盐酸 C.酒精
(2)对振荡中产生的气体的成分,甲、乙两同学分别提出了假设,丙同学进行了验证。
甲同学认为是H2,其可能的理由是_______________________________________________ 。
乙同学认为是O2,其可能的理由是______________________________________________ 。
丙同学在细口瓶中插入数据采集器氧气传感器,密封进行实验一小时,结果发现瓶中氧气的百分含量呈现逐渐减小的趋势,从而证明产生的气体是_________________ 。
(3)丁同学猜想酸与铁丝振荡体系中的反应机理及过程:
(a)Fe+2H+=Fe2++H2
(b)2Fe2++H2O2+H2O=Fe2O3+4H+
(c)Fe2O3+6H+=2Fe3++3H2O
(d)2Fe3++H2=2Fe2++2H+
依据过程:(a)→(b)→(c)→(d)→(a)…周而复始。
依据此机理,四步反应总的反应方程式为________________________________________ 。
(4)戊同学对本次实验中的所用铁钉中单质铁的含量进行测定,他们先配制一定物质的量浓度的硫酸,然后将一定质量的铁与硫酸(加入适量的铜粉)充分反应,并收集产生的气体,有关数据如下表:
所配硫酸的物质的量浓度为________ mol·L-1;铁钉中单质铁的质量分数为____________ 。
实验步骤:
①将2 cm左右的铁丝夹成多段,放在培养皿中,先用热的碳酸钠溶液除去铁丝表面的油污,用蒸馏水冲洗后,再用某种试剂X浸泡到有大量气泡时取出,用蒸馏水冲洗干净。
②在细口瓶中加入30 mL 1.0 mol·L-1的H2SO4、3 mL 30%的H2O2溶液,将处理后的铁丝放入其中。
③观察现象:铁丝表面产生气泡,随后消失,再产生气泡,再消失的周而往复的化学振荡现象出现,振荡周期约20秒,可维持数小时。
试回答下列问题:
(1)步骤①中,用试剂X可除去铁钉表面的铁的氧化物或镀层,所用的试剂X可能是
A.NaOH B.盐酸 C.酒精
(2)对振荡中产生的气体的成分,甲、乙两同学分别提出了假设,丙同学进行了验证。
甲同学认为是H2,其可能的理由是
乙同学认为是O2,其可能的理由是
丙同学在细口瓶中插入数据采集器氧气传感器,密封进行实验一小时,结果发现瓶中氧气的百分含量呈现逐渐减小的趋势,从而证明产生的气体是
(3)丁同学猜想酸与铁丝振荡体系中的反应机理及过程:
(a)Fe+2H+=Fe2++H2
(b)2Fe2++H2O2+H2O=Fe2O3+4H+
(c)Fe2O3+6H+=2Fe3++3H2O
(d)2Fe3++H2=2Fe2++2H+
依据过程:(a)→(b)→(c)→(d)→(a)…周而复始。
依据此机理,四步反应总的反应方程式为
(4)戊同学对本次实验中的所用铁钉中单质铁的含量进行测定,他们先配制一定物质的量浓度的硫酸,然后将一定质量的铁与硫酸(加入适量的铜粉)充分反应,并收集产生的气体,有关数据如下表:
| ① | ② | ③ | |
| 硫酸溶液体积/mL | 50 | 50 | 50 |
| 称取铁钉质量/g | 5.0 | 6.0 | 7.0 |
| 两投入铜粉质量/g | 1.0 | 1.0 | 1.0 |
| 标准状况下的体积/L | 1.97 | 2.24 | 2.24 |
所配硫酸的物质的量浓度为
更新时间:2020-09-22 20:12:38
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】为测定CuSO4溶液的浓度,甲同学设计了个方案。回答下列问题:
实验原理: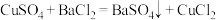
实验步骤:
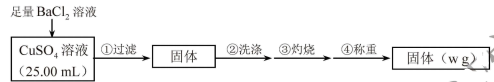
(1)判断SO 沉淀完全的操作为
沉淀完全的操作为__________________________ 。
(2)步骤②判断沉淀是否洗净所选用的试剂为______________________ 。
(3)步骤③灼烧时盛装样品的仪器名称为______________________ 。
(4)固体质量为w g,则c(CuSO4)=______________________ mol﹒L-1。
(5)若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得c(CuSO4)__________ (填“偏高”、“偏低”或“无影响”)
实验原理:
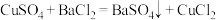
实验步骤:

(1)判断SO
 沉淀完全的操作为
沉淀完全的操作为(2)步骤②判断沉淀是否洗净所选用的试剂为
(3)步骤③灼烧时盛装样品的仪器名称为
(4)固体质量为w g,则c(CuSO4)=
(5)若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得c(CuSO4)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:

ClO2发生器中的反应为SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4.
(1)NaClO3中Cl元素的化合价为_____ ,上述反应是_____ (填反应类型)。
(2)吸收器中反应温度不能高于5℃的可能原因有_____ 。
(3)理论上当ClO2发生器中19.2gSO2完全反应时,可制得标况下ClO2的体积为多少_____ 。(写出计算过程)

ClO2发生器中的反应为SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4.
(1)NaClO3中Cl元素的化合价为
(2)吸收器中反应温度不能高于5℃的可能原因有
(3)理论上当ClO2发生器中19.2gSO2完全反应时,可制得标况下ClO2的体积为多少
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】正盐A、B均含有三种元素。且所含元素种类相同。24.5g的A在加热条件下发生如图变化。已知:生成的标况下2.24L的气体D,能使得火星的水条复燃。透过蓝色钴玻璃,A、B、C的焰色实验均为紫色,往C的溶液中加入AgNO3溶液,出现白色沉淀。再加入稀硝酸,沉淀不溶解,且质量称得为14.35g。请回答:

(1)D的物质的量为____________ mol,C的化学式为____________ 。
(2)写出A分解的化学方程式______________ 。

(1)D的物质的量为
(2)写出A分解的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】孔雀石铜矿(含Cu、Fe、Al等元素)是工业上提取铁、铜等金属的原材料,某工厂由孔雀石铜矿制备单质铜和绿矾( )的工艺流程如下:
)的工艺流程如下:
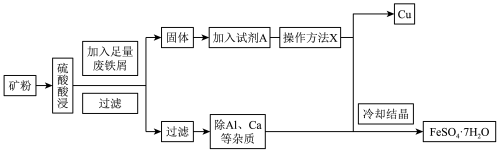
回答下列问题:
(1)试剂A为___________ ,此步骤涉及反应的离子方程式是___________ ,1molA参与上述反应转移电子的物质的量为___________ 。
(2)操作X是___________ 。
(3)实验室需要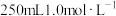 稀硫酸,化学小组用98%浓硫酸(
稀硫酸,化学小组用98%浓硫酸(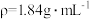 )配制上述稀硫酸,配制过程中可能用到下列仪器:①100mL量筒②25mL量筒③烧杯④托盘天平⑤250mL容量瓶⑥胶头滴管⑦玻璃棒,按使用时出现的先后顺序排列是___________。
)配制上述稀硫酸,配制过程中可能用到下列仪器:①100mL量筒②25mL量筒③烧杯④托盘天平⑤250mL容量瓶⑥胶头滴管⑦玻璃棒,按使用时出现的先后顺序排列是___________。
(4)将稀释后的硫酸转移到容量瓶之前需___________ 。若将稀释后的硫酸立即转移到容量瓶将使所配溶液的物质的量浓度___________ 。(填“偏高”“偏低”或“无影响”)
 )的工艺流程如下:
)的工艺流程如下:
回答下列问题:
(1)试剂A为
(2)操作X是
(3)实验室需要
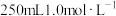 稀硫酸,化学小组用98%浓硫酸(
稀硫酸,化学小组用98%浓硫酸(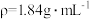 )配制上述稀硫酸,配制过程中可能用到下列仪器:①100mL量筒②25mL量筒③烧杯④托盘天平⑤250mL容量瓶⑥胶头滴管⑦玻璃棒,按使用时出现的先后顺序排列是___________。
)配制上述稀硫酸,配制过程中可能用到下列仪器:①100mL量筒②25mL量筒③烧杯④托盘天平⑤250mL容量瓶⑥胶头滴管⑦玻璃棒,按使用时出现的先后顺序排列是___________。| A.①③⑤⑦⑥ | B.②③⑦⑤⑥ | C.④③⑤⑦⑥ | D.①③⑦⑤⑥ |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]俗称摩尔盐,用途十分广泛。实验室通常用如图所示装置制备FeSO4溶液后,再与等物质的量的(NH4)2SO4反应制备摩尔盐。
已知:硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
(1)制备FeSO4
①用图示装置制备FeSO4,仪器a的名称是_______ 。该实验不用明火加热的原因是_______ 。
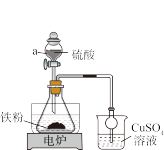
将0.7g铁粉加入锥形瓶中,放入15mL 1mol/L H2SO4溶液,保持温度在50°C~60°C之间反应,待无明显气泡产生后停止加热,趁热过滤。
②如果加入的铁粉不纯,反应过程中会产生少量H2S、PH3气体。用CuSO4溶液吸收PH3时会生成H3PO4和Cu。写出CuSO4溶液吸收PH3的化学方程式_______ 。
(2)制备摩尔盐
①向滤液中加入适量(NH4)2SO4饱和溶液,70C~80°C水浴加热,保持溶液pH为1~2,蒸发浓缩至溶液表面出现晶膜,冷却至室温即得晶体,减压过滤,用乙醇洗涤晶体。蒸发浓缩时,如果用玻璃棒搅拌,可能导致溶液变黄,其原因是_______ 。选用乙醇洗涤晶体的目的是_______ 。
②过滤出产品的母液中,可以大量共存的离子有_______ (填序号)
A. NO B. A13+ C. SO
B. A13+ C. SO D. AlO
D. AlO E. Ba2+ F. Cu2+
E. Ba2+ F. Cu2+
已知:硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
(1)制备FeSO4
①用图示装置制备FeSO4,仪器a的名称是

将0.7g铁粉加入锥形瓶中,放入15mL 1mol/L H2SO4溶液,保持温度在50°C~60°C之间反应,待无明显气泡产生后停止加热,趁热过滤。
②如果加入的铁粉不纯,反应过程中会产生少量H2S、PH3气体。用CuSO4溶液吸收PH3时会生成H3PO4和Cu。写出CuSO4溶液吸收PH3的化学方程式
(2)制备摩尔盐
①向滤液中加入适量(NH4)2SO4饱和溶液,70C~80°C水浴加热,保持溶液pH为1~2,蒸发浓缩至溶液表面出现晶膜,冷却至室温即得晶体,减压过滤,用乙醇洗涤晶体。蒸发浓缩时,如果用玻璃棒搅拌,可能导致溶液变黄,其原因是
②过滤出产品的母液中,可以大量共存的离子有
A. NO
 B. A13+ C. SO
B. A13+ C. SO D. AlO
D. AlO E. Ba2+ F. Cu2+
E. Ba2+ F. Cu2+
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】无水FeCl2为黄绿色晶体,在空气中易被氧化和易吸水,不溶于氯仿等有机溶剂。回答下列问题:
I.FeCl2的制备及产率测定:制备反应原理为2FeCl3+C6H5Cl 2FeCl2+C6H4Cl2+HCl(C6H5Cl为氯苯,沸点132℃),产率通过测定HCl的量进行计算。制备装置如图所示(夹持及加热装置略去):
2FeCl2+C6H4Cl2+HCl(C6H5Cl为氯苯,沸点132℃),产率通过测定HCl的量进行计算。制备装置如图所示(夹持及加热装置略去):
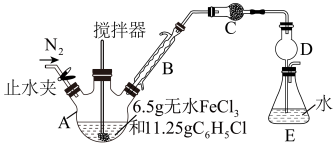
(1)仪器A的名称是____ ,仪器B的作用是____ ,装置C中的试剂是____ (填化学式)。
(2)为测定FeCl2的产率,用1.00mol·L-1NaOH溶液滴定溶于水的HCl,达到滴定终点时消耗NaOH溶液19.00mL,则FeCl2的产率为____ 。下列操作中,导致产率测定值偏低的是____ 。
a.滴定终点时俯视读数
b.滴定管未用NaOH标准溶液润洗
c.配制NaOH标准溶液时,转移溶液未洗涤烧杯
d.滴定前滴定管内无气泡,滴定结束后有气泡
II.FeCl2性质探究:将FeCl2晶体配成溶液后进行如表实验。
已知:Ba2+与SCN-可在溶液中大量共存;SCN-易被氧化为SO 。
。
(3)对实验ⅰ中溶液为浅红色的原因,甲同学提出以下假设:
假设1:加入氯水的量少,生成的Fe3+浓度低;
假设2:氯水氧化性强,____ 。
取实验ⅰ中浅红色溶液,____ (填实验操作),溶液浅红色消失,从而排除了假设1;向2mL水中滴加0.5mL0.1mol·L-1KSCN溶液,滴加0.5mL饱和氯水,加入____ ,产生白色沉淀,说明假设2正确。
(4)分析实验ⅱ“一段时间后,溶液褪为无色”的原因是____ (用离子方程式表示,已知SCN-中C元素为+4价)。
I.FeCl2的制备及产率测定:制备反应原理为2FeCl3+C6H5Cl
 2FeCl2+C6H4Cl2+HCl(C6H5Cl为氯苯,沸点132℃),产率通过测定HCl的量进行计算。制备装置如图所示(夹持及加热装置略去):
2FeCl2+C6H4Cl2+HCl(C6H5Cl为氯苯,沸点132℃),产率通过测定HCl的量进行计算。制备装置如图所示(夹持及加热装置略去):
(1)仪器A的名称是
(2)为测定FeCl2的产率,用1.00mol·L-1NaOH溶液滴定溶于水的HCl,达到滴定终点时消耗NaOH溶液19.00mL,则FeCl2的产率为
a.滴定终点时俯视读数
b.滴定管未用NaOH标准溶液润洗
c.配制NaOH标准溶液时,转移溶液未洗涤烧杯
d.滴定前滴定管内无气泡,滴定结束后有气泡
II.FeCl2性质探究:将FeCl2晶体配成溶液后进行如表实验。
| 序号 | 装置 | 试剂 | 实验现象 | |
| 实验ⅰ |  | 0.5mL0.1mol·L-1 KSCN溶液、1mL0.1mol·L-1 FeCl2(pH=1)溶液 | 0.5mL饱和氯水 | 溶液立即变为浅红色 |
| 实验ⅱ | 1mLl.5mol·L-1 HNO3溶液 | 滴入硝酸后,溶液变为红色,一段时间后,溶液褪为无色,且溶液中产生无色气泡,试管上方呈红棕色。 | ||
 。
。(3)对实验ⅰ中溶液为浅红色的原因,甲同学提出以下假设:
假设1:加入氯水的量少,生成的Fe3+浓度低;
假设2:氯水氧化性强,
取实验ⅰ中浅红色溶液,
(4)分析实验ⅱ“一段时间后,溶液褪为无色”的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵晶体在500°C时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵晶体隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和__________________
(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵晶体至分解完全。

①A中固体充分加热较长时间后,通入氮气,目的是_______________________________ 。
②为检验A中残留物是否含有FeO,需要选用的试剂有______________ (填标号)。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
(3)通入酸性高锰酸钾溶液,溶液褪色,该反应中SO2表现出化学性质是_____
(1)硫酸亚铁铵晶体隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和
(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵晶体至分解完全。

①A中固体充分加热较长时间后,通入氮气,目的是
②为检验A中残留物是否含有FeO,需要选用的试剂有
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
(3)通入酸性高锰酸钾溶液,溶液褪色,该反应中SO2表现出化学性质是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】实验室里研究不同价态硫元素之间的转化
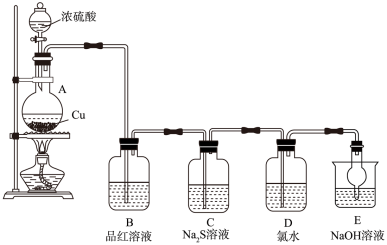
(1)A中发生反应的化学方程式为________________ 。
(2)B中的现象是__________________ 。
(3)C中出现淡黄色沉淀,反应中Na2S做____________ (填“氧化剂”或“还原剂”)。
(4)D溴水褪色,该反应S元素的价态变化是由+4价变为________________ 价。
(5)某同学认为D中换成H2O2溶液也可以实现上述硫元素的价态转化,并通过实验进一步证明了他的观点。实验方案和现象为:取D中反应后的溶液于试管中,_________ 。
(6) E的作用是_____________ ,离子方程式为_________________________ 。
(7)上述实验体现SO2的性质有__________________ 。

(1)A中发生反应的化学方程式为
(2)B中的现象是
(3)C中出现淡黄色沉淀,反应中Na2S做
(4)D溴水褪色,该反应S元素的价态变化是由+4价变为
(5)某同学认为D中换成H2O2溶液也可以实现上述硫元素的价态转化,并通过实验进一步证明了他的观点。实验方案和现象为:取D中反应后的溶液于试管中,
(6) E的作用是
(7)上述实验体现SO2的性质有
您最近一年使用:0次




