在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ·mol-1表示。请认真观察下图,然后回答问题。

(1)图中反应是________ (填“吸热”或“放热”)反应,该反应的ΔH=________ (用含E1、E2的代数式表示)。
(2)已知:H2(g)+ O2(g)===H2O(g)ΔH=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为
O2(g)===H2O(g)ΔH=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为________________ 。
(3)对于同一反应,图中虚线(II)与实线(I)相比,活化能________ (填“升高”“降低”或“不变”),对反应热是否有影响?________ ,原因是____________________________________________

(1)图中反应是
(2)已知:H2(g)+
 O2(g)===H2O(g)ΔH=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为
O2(g)===H2O(g)ΔH=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为(3)对于同一反应,图中虚线(II)与实线(I)相比,活化能
更新时间:2020-09-24 20:45:49
|
相似题推荐
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】写出或完成下列热化学方程式。
(1)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ 的热量。写出CH4燃烧的热化学方程式__________ 。
(2)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。下表是一些化学键的键能。
根据键能数据估算下列反应:CH4(g) + 4F2(g)=CF4(g) + 4HF(g)的反应热△H为_____ 。
(3)1840年瑞士的化学家盖斯(Hess)在总结大量实验事实(热化学实验数据)的基础上提出:“定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)。”
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
请写出CO还原FeO的热化学方程式:______ 。
(4)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为__________ ;
②氢气燃烧热的热化学方程式为________ ;
(5)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) ΔH1=-74.5kJ·mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) ΔH2;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1。
则ΔH2=_______ kJ·mol-1;
(6)白磷与氧气可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH为_____ 。
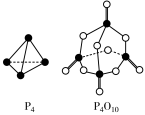
(7)同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
①P4(白磷,s)+5O2(g)=P4O10(s) ΔH1=-2 983.2 kJ·mol-1
②P(红磷,s)+5/4O2(g)=1/4P4O10(s) ΔH2=-738.5 kJ·mol-1
相同状况下,能量较低的是________ ;白磷的稳定性比红磷________ (填“大”或“小”)。
(1)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ 的热量。写出CH4燃烧的热化学方程式
(2)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。下表是一些化学键的键能。
| 化学键 | C-H | C-F | H-F | F-F |
| 键能kJ/mol | 414 | 489 | 565 | 155 |
根据键能数据估算下列反应:CH4(g) + 4F2(g)=CF4(g) + 4HF(g)的反应热△H为
(3)1840年瑞士的化学家盖斯(Hess)在总结大量实验事实(热化学实验数据)的基础上提出:“定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)。”
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
请写出CO还原FeO的热化学方程式:
(4)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为
②氢气燃烧热的热化学方程式为
(5)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) ΔH1=-74.5kJ·mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) ΔH2;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1。
则ΔH2=
(6)白磷与氧气可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH为

(7)同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
①P4(白磷,s)+5O2(g)=P4O10(s) ΔH1=-2 983.2 kJ·mol-1
②P(红磷,s)+5/4O2(g)=1/4P4O10(s) ΔH2=-738.5 kJ·mol-1
相同状况下,能量较低的是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】I (1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、___________ 、___________ 。
(2)量取反应物时,取50 mL 0.50 mol·L-1的盐酸,还需加入的试剂是__________ (填序号)。
A.50 mL 0.50 mol·L-1 NaOH溶液
B.50 mL 0.55 mol·L-1 NaOH溶液
C.1.0 g NaOH固体
(3)由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如下表所示。
乙在实验之前预计ΔH1≠ΔH2,他的根据是_________ 。
II(4)研究NOx、SO2、CO等大气污染气体的处理具有重要意义。处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是___________ 。
(5)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为_____________ 。
(2)量取反应物时,取50 mL 0.50 mol·L-1的盐酸,还需加入的试剂是
A.50 mL 0.50 mol·L-1 NaOH溶液
B.50 mL 0.55 mol·L-1 NaOH溶液
C.1.0 g NaOH固体
(3)由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如下表所示。
| 反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热/kJ·mol-1 |
| A.1.0 mol·L-1 HCl溶液50 mL、1.1 mol·L-1 NaOH溶液50 mL | 13.0 | ΔH1 | |
| B.1.0 mol·L-1 HCl溶液50 mL、1.1 mol·L-1 NH3·H2O溶液50 mL | 13.0 | ΔH2 |
乙在实验之前预计ΔH1≠ΔH2,他的根据是
II(4)研究NOx、SO2、CO等大气污染气体的处理具有重要意义。处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+
 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是
(5)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐1】在化学反应中,人们把能够发生有效碰撞的分子叫做活化分子,同时把活化分子多出的那部分能量称作活化能,单位:kJ·mol-1。请根据下图回答问题:
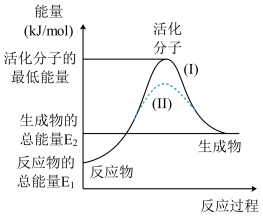
(1)图中所示反应是____ (填“吸热”或“放热”)反应,该反应的ΔH=____ kJ·mol-1 (用含E1、E2的代数式表示)。
(2)对于同一反应,上图虚线(Ⅱ)与实线(Ⅰ)相比,活化分子最低能量明显降低,反应速率加快,你认为最有可能的原因是____ 。
(3)下列4个反应中符合示意图描述的反应的是____ (填代号)。
A.氧化钙与水反应
B.A(g)+2B(g) C(g) 反应中C的能量高于A的能量
C(g) 反应中C的能量高于A的能量
C.铝粉与铁红反应
D.灼热的碳与CO2反应
(4)已知热化学方程式:A(g)+2B(g)=C(g) ΔH=+a kJ·mol-1。该反应的活化能为 b kJ·mol-1,则其逆反应的活化能为____ kJ·mol-1。

(1)图中所示反应是
(2)对于同一反应,上图虚线(Ⅱ)与实线(Ⅰ)相比,活化分子最低能量明显降低,反应速率加快,你认为最有可能的原因是
(3)下列4个反应中符合示意图描述的反应的是
A.氧化钙与水反应
B.A(g)+2B(g)
 C(g) 反应中C的能量高于A的能量
C(g) 反应中C的能量高于A的能量C.铝粉与铁红反应
D.灼热的碳与CO2反应
(4)已知热化学方程式:A(g)+2B(g)=C(g) ΔH=+a kJ·mol-1。该反应的活化能为 b kJ·mol-1,则其逆反应的活化能为
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】(1)实验测得16g甲醇CH3OH(l)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇燃烧的热化学方程式:_________
(2)合成氨反应N2(g)+3H2(g) 2NH3(g)ΔH=akJ·mol-1,反应过程中有关键能数据如下:
2NH3(g)ΔH=akJ·mol-1,反应过程中有关键能数据如下:
试根据表中所列键能数据计算a为____________ 。
(3)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知:①N2(g)+2O2(g)=2NO2(g)ΔΗ1=akJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔΗ2=bkJ/mol
写出肼和二氧化氮反应生成氮气和气态水的热化学方程式:________________________ 。
(2)合成氨反应N2(g)+3H2(g)
 2NH3(g)ΔH=akJ·mol-1,反应过程中有关键能数据如下:
2NH3(g)ΔH=akJ·mol-1,反应过程中有关键能数据如下:| 化学键 | H—H | N—H | N≡N |
| 键能(kJ·mol-1) | 436 | 391 | 945 |
试根据表中所列键能数据计算a为
(3)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知:①N2(g)+2O2(g)=2NO2(g)ΔΗ1=akJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔΗ2=bkJ/mol
写出肼和二氧化氮反应生成氮气和气态水的热化学方程式:
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
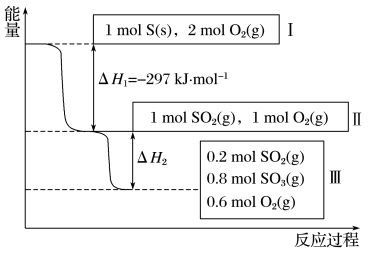
【推荐3】2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ·mol-1。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ·mol-1。请回答下列问题:
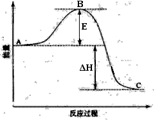
(1)图中E表示__________ 。E的大小对该反应的反应热_______ (填“有”或“无”)影响。
(2)该反应通常用V2O5作催化剂,加V2O5会使图中B点(填“升高”还是“降低”),△H______ (填“变大”、“变小”或“不变”)。
(3)图中△H=___________ kJ·mol-1;
(4)当反应达到平衡时,升高温度,反应速率_______ (增大”“减小”或“不变”),SO2的转化率_________ (增大”“减小”或“不变”),原因是______________________
 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ·mol-1。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ·mol-1。请回答下列问题:
(1)图中E表示
(2)该反应通常用V2O5作催化剂,加V2O5会使图中B点(填“升高”还是“降低”),△H
(3)图中△H=
(4)当反应达到平衡时,升高温度,反应速率
您最近一年使用:0次
【推荐1】雾霾已经成为部分城市发展的障碍。雾霾形成的最主要原因是人为排放,其中汽车尾气污染对雾霾的“贡献”逐年增加。回答下列问题:
(1)汽车尾气中含有NO,N2与O2生成NO的过程如下:

①1molO2与1molN2的总能量比2molNO的总能量___________ (填“高”或“低”)。
②N2(g)+O2(g)=2NO(g)的∆H=___________ kJ∙mol-1。
③NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)⇌2CO2(g)+N2(g)∆H=akJ∙mol-1,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的NO与CO转化成无害物质排出。上述反应在使用“催化转化器”后,a值___________ (选填“增大”“减小”或“不变”)。
(2)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ∆H1,如图是该反应的能量变化图:
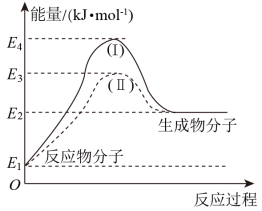
①通过图中信息可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的∆H1___________ (选填“>”“=”或“<”)0
②图中途径(Ⅱ)使用了催化剂。则途径(Ⅱ)的活化能___________ (选填“>”“=”或“<”)途径(Ⅰ)的活化能。
③已知下列两个热化学方程式:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ∆H2
H2(g)+ O2(g)=H2O(g) ∆H3
O2(g)=H2O(g) ∆H3
则∆H2=___________ (用∆H1和∆H3的代数式表达)
(1)汽车尾气中含有NO,N2与O2生成NO的过程如下:

①1molO2与1molN2的总能量比2molNO的总能量
②N2(g)+O2(g)=2NO(g)的∆H=
③NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)⇌2CO2(g)+N2(g)∆H=akJ∙mol-1,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的NO与CO转化成无害物质排出。上述反应在使用“催化转化器”后,a值
(2)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ∆H1,如图是该反应的能量变化图:

①通过图中信息可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的∆H1
②图中途径(Ⅱ)使用了催化剂。则途径(Ⅱ)的活化能
③已知下列两个热化学方程式:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ∆H2
H2(g)+
 O2(g)=H2O(g) ∆H3
O2(g)=H2O(g) ∆H3则∆H2=
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】活化能
(1)有效碰撞理论
①基元反应:大多数的化学反应往往经过多个反应步骤才能实现。其中_______ 都称为基元反应。如2HI=H2+I2的2个基元反应为2HI→H2+2I·、2I·→I2。
②反应机理:先后进行的_______ 反映了化学反应的反应历程,反应历程又称_______ 。
③基元反应发生的先决条件
基元反应发生的先决条件是反应物的分子必须发生_______ ,但是并不是每一次分子碰撞都能发生化学反应。
④有效碰撞
概念:_______ 。
条件:具有足够的_______ ;具有合适的_______ 。
与反应速率的关系:有效碰撞的频率越高,则反应速率_______ 。
⑤活化能和活化分子
活化分子:能够发生_______ 的分子。对于某一化学反应来说,在一定条件下,反应物分子中活化分子的百分数是_______ 的。
活化能:活化分子具有的_______ 与反应物分子具有的平均能量之差,叫做反应的活化能。
(2)有效碰撞理论对影响化学反应速率因素的解释
①浓度:反应物浓度增大→单位体积内活化分子数_______ →单位时间内有效碰撞的次数_______ →反应速率_______ ;反之,反应速率_______ 。
②压强:增大压强→气体体积缩小→反应物浓度增大→单位体积内活化分子数_______ →单位时间内有效碰撞的次数_______ →反应速率_______ ;反之,反应速率_______ 。即压强对化学反应速率的影响,可转化成浓度对化学反应速率的影响。
③温度:微观解释:升高温度→活化分子的百分数_______ →单位时间内有效碰撞的次数_______ →反应速率_______ ;反之,反应速率_______ 。
④催化剂:使用催化剂→改变了反应的历程,反应的活化能_______ →活化分子的百分数_______ →单位时间内有效碰撞的几率_______ →反应速率_______ 。
(1)有效碰撞理论
①基元反应:大多数的化学反应往往经过多个反应步骤才能实现。其中
②反应机理:先后进行的
③基元反应发生的先决条件
基元反应发生的先决条件是反应物的分子必须发生
④有效碰撞
概念:
条件:具有足够的
与反应速率的关系:有效碰撞的频率越高,则反应速率
⑤活化能和活化分子
活化分子:能够发生
活化能:活化分子具有的
(2)有效碰撞理论对影响化学反应速率因素的解释
①浓度:反应物浓度增大→单位体积内活化分子数
②压强:增大压强→气体体积缩小→反应物浓度增大→单位体积内活化分子数
③温度:微观解释:升高温度→活化分子的百分数
④催化剂:使用催化剂→改变了反应的历程,反应的活化能
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】活化能
理论解释
(1)活化分子、活化能、有效碰撞
i.活化分子:能够发生_______ 的分子。
ii.活化能:如图
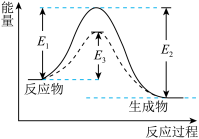
图中:E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2.(注:E2为逆反应的活化能)
iii.有效碰撞:活化分子之间能够引发_______ 的碰撞。
iii.用碰撞理论理解化学反应的过程
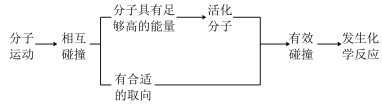
(2)活化分子、有效碰撞与反应速率的关系
有效碰撞的频率越高,则反应速率_______ 。
(3)正确理解活化能与反应热的关系
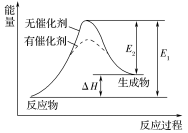
①催化剂能降低反应所需活化能,但不影响_______ 的大小
②在无催化剂的情况下,E1为正反应的活化能,E2为逆反应的活化能,即:E1=E2+ΔH
(4)影响化学反应速率的内因——活化能
①相同条件下,不同化学反应的速率不同,主要是内因——活化能大小不同所致,活化能小的化学反应速率_______ ,活化能大的反应速率_______
②活化能是指为了能发生化学反应,普通分子(具有平均能量的分子)变成活化分子所需要吸收的最小能量,即活化分子比普通分子所多出的那部分能量
③化学反应速率与分子间的有效碰撞频率有关,所有能够改变内能、运动速率,以及碰撞几率的方法,都可以用来改变、控制反应的速率,即:活化分子百分数和单位体积活化分子数增大时,化学反应速率也就增大
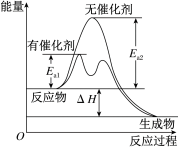
(5)过渡态理论对催化剂影响化学反应速率的解释:使用催化剂→改变了反应的路径(如图),反应的活化能_______ →活化分子的百分数_______ →反应速率_______ 。
理论解释
(1)活化分子、活化能、有效碰撞
i.活化分子:能够发生
ii.活化能:如图

图中:E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2.(注:E2为逆反应的活化能)
iii.有效碰撞:活化分子之间能够引发
iii.用碰撞理论理解化学反应的过程

(2)活化分子、有效碰撞与反应速率的关系
有效碰撞的频率越高,则反应速率
(3)正确理解活化能与反应热的关系

①催化剂能降低反应所需活化能,但不影响
②在无催化剂的情况下,E1为正反应的活化能,E2为逆反应的活化能,即:E1=E2+ΔH
(4)影响化学反应速率的内因——活化能
①相同条件下,不同化学反应的速率不同,主要是内因——活化能大小不同所致,活化能小的化学反应速率
②活化能是指为了能发生化学反应,普通分子(具有平均能量的分子)变成活化分子所需要吸收的最小能量,即活化分子比普通分子所多出的那部分能量
③化学反应速率与分子间的有效碰撞频率有关,所有能够改变内能、运动速率,以及碰撞几率的方法,都可以用来改变、控制反应的速率,即:活化分子百分数和单位体积活化分子数增大时,化学反应速率也就增大
| 外界因素 | 活化能 | 分子总数 | 活化分子总数 | 活化分子百分数 | 单位体积活化分子数 | 有效碰撞次数 | 反应速率 |
| 增大反应 物的浓度 | 不变 | 增多 | 增多 | 不变 | 增多 | 增多 | 加快 |
| 增大反应物的压强 | 不变 | 不变 | 不变 | 不变 | 增多 | 增多 | 加快 |
| 升高反应 物的温度 | 不变 | 不变 | 增多 | 增多 | 增多 | 增多 | 加快 |
| 使用催化剂 | 降低 | 不变 | 增多 | 增多 | 增多 | 增多 | 加快 |
(5)过渡态理论对催化剂影响化学反应速率的解释:使用催化剂→改变了反应的路径(如图),反应的活化能

您最近一年使用:0次

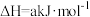

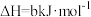
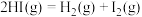
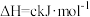
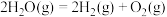

 。
。