为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)25℃、101kPa时,使1.0g乙烯与足量的氧气反应,生成CO2和液态H2O并放出50KJ的热量,表示乙烯燃烧热的热化学方程式为_____________________________________ 。
(2)比较下列热化学方程式中△H的大小关系。
CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H1
CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H2
则△H1____ △H2
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) △H1
2H2(g)+O2(g )=2H2O(l) △H2
2C2H2(g)+5O2(g )=4CO2(g)+2H2O(1) △H3
则2C(s,石墨)+H2(g)=C2H2(g)反应的△H的表达式为:△H=____ 。
(4)已知热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=﹣48kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+18kJ/mol
写出FeO(s)被CO(g)还原成Fe(g)和CO2(g)的热化学方程式________________ 。
(5)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
已知反应N2(g)+3H2(g) 2NH3(g)△H=a kJ/mol。试根据表中所列键能数据计算a为
2NH3(g)△H=a kJ/mol。试根据表中所列键能数据计算a为_______ 。
(6)已知:①Al2O3(s)+3C(s)===2Al(s)+3CO(g) ΔH1=+1 344.1 kJ·mol-1
②2AlCl3(g)===2Al(s)+3Cl2(g) ΔH2=+1 169.2 kJ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为__________________________________________ 。
(1)25℃、101kPa时,使1.0g乙烯与足量的氧气反应,生成CO2和液态H2O并放出50KJ的热量,表示乙烯燃烧热的热化学方程式为
(2)比较下列热化学方程式中△H的大小关系。
CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H1
CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H2
则△H1
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) △H1
2H2(g)+O2(g )=2H2O(l) △H2
2C2H2(g)+5O2(g )=4CO2(g)+2H2O(1) △H3
则2C(s,石墨)+H2(g)=C2H2(g)反应的△H的表达式为:△H=
(4)已知热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=﹣48kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+18kJ/mol
写出FeO(s)被CO(g)还原成Fe(g)和CO2(g)的热化学方程式
(5)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 | H-H | N-H | N N N |
| 键能/kJ•mol﹣1 | 436 | 391 | 946 |
 2NH3(g)△H=a kJ/mol。试根据表中所列键能数据计算a为
2NH3(g)△H=a kJ/mol。试根据表中所列键能数据计算a为(6)已知:①Al2O3(s)+3C(s)===2Al(s)+3CO(g) ΔH1=+1 344.1 kJ·mol-1
②2AlCl3(g)===2Al(s)+3Cl2(g) ΔH2=+1 169.2 kJ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为
更新时间:2020-10-12 16:43:19
|
相似题推荐
计算题
|
适中
(0.65)
名校
解题方法
【推荐1】甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.8 kJ/mol;
②CH3OH(l)+ O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
(1)表示甲醇完全燃烧热的的热化学方程式为________________ ;
(2)反应②中的能量变化如图所示,则ΔH2=__________ 。(用E1、E2的相关式子表示);

(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq) △H1
(NH4)2CO3(aq) △H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) NH4HCO3(aq) △H2
NH4HCO3(aq) △H2
反应Ⅲ: (NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq) △H3
2NH4HCO3(aq) △H3
则ΔH3与ΔH1 、ΔH2与之间的关系为ΔH3 =_________ ;
(4)拆开1mol气态物质中某种共价键需要吸收的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量:
已知反应N2(g)+3H2(g) 2NH3(g) ΔH=akJ/mol,试根据表中所列键能数据估算a的值
2NH3(g) ΔH=akJ/mol,试根据表中所列键能数据估算a的值______ 。(注明“+”或“﹣”)。
①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.8 kJ/mol;
②CH3OH(l)+
 O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol(1)表示甲醇完全燃烧热的的热化学方程式为
(2)反应②中的能量变化如图所示,则ΔH2=

(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)
 (NH4)2CO3(aq) △H1
(NH4)2CO3(aq) △H1反应Ⅱ:NH3(l)+H2O(l)+CO2(g)
 NH4HCO3(aq) △H2
NH4HCO3(aq) △H2反应Ⅲ: (NH4)2CO3(aq)+H2O(l)+CO2(g)
 2NH4HCO3(aq) △H3
2NH4HCO3(aq) △H3则ΔH3与ΔH1 、ΔH2与之间的关系为ΔH3 =
(4)拆开1mol气态物质中某种共价键需要吸收的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量:
| 化学键 | H﹣H | N﹣H | N≡N |
| 键能/kJ/mol | 436 | 391 | 945 |
已知反应N2(g)+3H2(g)
 2NH3(g) ΔH=akJ/mol,试根据表中所列键能数据估算a的值
2NH3(g) ΔH=akJ/mol,试根据表中所列键能数据估算a的值
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】(12分)为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇。“绿色自由”构想的部分技术流程如下

(1)合成塔中反应的化学方程式为_____________ ;△H<0。从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了________________ 。
(2)从合成塔分离出甲醇的原理与下列______ 操作的原理比较相符(填字母)
工业流程中一定包括“循环利用”,“循环利用”是提高效益、节能环保的重要措施。“绿色自由”构想技术流程中能够“循环利用”的,除K2CO3溶液和CO2、H2外,还包括__________ .
(3)在体积为2L的合成塔中,充人2 mol CO2和6 mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
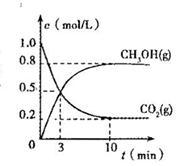
从反应开始到平衡,V(H2) =______________ ;能使平衡体系中nCH3OH)/n(CO2)增大的措施有____________ 。
A、加入催化剂
B、充入He(g),使体系压强增大
C、将H2O(g)从体系中分离
D、降低温度
(4) 如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
已知CH4(g) + 2O2(g)=CO2(g)+ 2H2O(l) ΔH1=― 890.3 kJ/mol
H2(g) + 1/2O2(g)=H2O(l) ΔH2=-285.8 kJ/mol
写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式________________ 。

(1)合成塔中反应的化学方程式为
(2)从合成塔分离出甲醇的原理与下列
| A.过滤 | B.分液 | C.蒸馏 | D.结晶 |
(3)在体积为2L的合成塔中,充人2 mol CO2和6 mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

从反应开始到平衡,V(H2) =
A、加入催化剂
B、充入He(g),使体系压强增大
C、将H2O(g)从体系中分离
D、降低温度
(4) 如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
已知CH4(g) + 2O2(g)=CO2(g)+ 2H2O(l) ΔH1=― 890.3 kJ/mol
H2(g) + 1/2O2(g)=H2O(l) ΔH2=-285.8 kJ/mol
写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐1】(1)N2(g)和H2(g)反应生成1molNH3(g),放出46.1kJ热量,该反应的热化学方程式为____________________________ 。
(2)已知断裂1mol H2(g)中的H—H键需要吸收436kJ的能量,断裂1mol O2(g)中的共价键需要吸收498kJ的能量,生成H2O(g)中的1mol H—O放出463kKJ的能量。试写出O2(g)与H2(g)反应生成H2O(g)的热化学方程式____________________________ 。
(3)发射“神舟六号”载人飞船的长征火箭是用肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:N2(g) + 2O2(g) = 2NO2(g)
△H=—67.7kJ·mol-1;N2H4(g) + O2(g) = N2(g) + 2H2O(g)△H=-534kJ·mol-1。则肼与二氧化氮反应的热化学方程式为______________________________________ 。
(4)已知:2H2(g) + O2(g)=2H2O(g)△H=-483kJ·moL-1
N2(g) + 2O2(g)=2NO2(g)△H=+68kJ·moL-1
则H2还原NO2生成水蒸气的热化学方程式是:__________ 。
(2)已知断裂1mol H2(g)中的H—H键需要吸收436kJ的能量,断裂1mol O2(g)中的共价键需要吸收498kJ的能量,生成H2O(g)中的1mol H—O放出463kKJ的能量。试写出O2(g)与H2(g)反应生成H2O(g)的热化学方程式
(3)发射“神舟六号”载人飞船的长征火箭是用肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:N2(g) + 2O2(g) = 2NO2(g)
△H=—67.7kJ·mol-1;N2H4(g) + O2(g) = N2(g) + 2H2O(g)△H=-534kJ·mol-1。则肼与二氧化氮反应的热化学方程式为
(4)已知:2H2(g) + O2(g)=2H2O(g)△H=-483kJ·moL-1
N2(g) + 2O2(g)=2NO2(g)△H=+68kJ·moL-1
则H2还原NO2生成水蒸气的热化学方程式是:
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题
(1)已知:2SO2(g)+O2(g)=2SO3(g) ΔH= -x kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH= -y kJ·mol-1
则反应NO2(g)+SO2(g)=SO3(g)+NO(g)的ΔH=_______ kJ·mol-1。
(2)已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
查阅文献资料,化学键的键能如下表:
①氨分解反应NH3(g)= N2(g)+
N2(g)+ H2(g)的活化能Eal=300kJ·mol-1,则合成氨反应
H2(g)的活化能Eal=300kJ·mol-1,则合成氨反应 N2(g)+
N2(g)+ H2(g)=NH3(g)的活化能Ea2=
H2(g)=NH3(g)的活化能Ea2=_______ kJ·mol-1。
②氨气完全燃烧生成N2(g)和气态水的热化学方程式为_______ 。
(3)研究氮氧化物与悬浮的大气中海盐粒子的相互作用时,涉及如下反应:
I.2NO2(g)+NaCl(s)=NaNO3(s)+ClNO(g) ΔH1<0
II.2NO(g)+Cl2(g)=2ClNO(g) ΔH2<0
则反应4NO2(g)+2NaCl(s)=2NaNO3(s)+2NO(g)+Cl2(g)的ΔH=_______ (用ΔH1、ΔH2表示);
(1)已知:2SO2(g)+O2(g)=2SO3(g) ΔH= -x kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH= -y kJ·mol-1
则反应NO2(g)+SO2(g)=SO3(g)+NO(g)的ΔH=
(2)已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
查阅文献资料,化学键的键能如下表:
| 化学键 | H—H键 | N≡N键 | N—H键 |
| E/(kJ·mol-1) | 436 | 946 | 391 |
①氨分解反应NH3(g)=
 N2(g)+
N2(g)+ H2(g)的活化能Eal=300kJ·mol-1,则合成氨反应
H2(g)的活化能Eal=300kJ·mol-1,则合成氨反应 N2(g)+
N2(g)+ H2(g)=NH3(g)的活化能Ea2=
H2(g)=NH3(g)的活化能Ea2=②氨气完全燃烧生成N2(g)和气态水的热化学方程式为
(3)研究氮氧化物与悬浮的大气中海盐粒子的相互作用时,涉及如下反应:
I.2NO2(g)+NaCl(s)=NaNO3(s)+ClNO(g) ΔH1<0
II.2NO(g)+Cl2(g)=2ClNO(g) ΔH2<0
则反应4NO2(g)+2NaCl(s)=2NaNO3(s)+2NO(g)+Cl2(g)的ΔH=
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐3】回答下列问题:
(1)实验测得常温下16 g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25 kJ的热量,试写出甲醇燃烧热的热化学方程式:_______ 。
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程。已知反应:N2(g)+3H2(g)⇌2NH3(g) △H=a kJ/mol。有关键能数据如下:
试根据表中所列键能数据估算a的数值_______ 。
(3)用盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。已知:
C(s,石墨)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599 kJ/mol
请写出由C(s,石墨)和H2(g)生成1 mol C2H2(g)的热化学方程式:_______ 。
(4)某金属氧化物的化学式为M2O,电子总数为30,已知氧原子核内有8个中子,M2O的相对分子质量为62,则M原子核内中子数为_______ 。
(1)实验测得常温下16 g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25 kJ的热量,试写出甲醇燃烧热的热化学方程式:
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程。已知反应:N2(g)+3H2(g)⇌2NH3(g) △H=a kJ/mol。有关键能数据如下:
| 化学键 | H-H | N-H | N≡N |
| 键能(kJ/mol) | 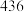 | 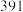 | 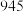 |
试根据表中所列键能数据估算a的数值
(3)用盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。已知:
C(s,石墨)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599 kJ/mol
请写出由C(s,石墨)和H2(g)生成1 mol C2H2(g)的热化学方程式:
(4)某金属氧化物的化学式为M2O,电子总数为30,已知氧原子核内有8个中子,M2O的相对分子质量为62,则M原子核内中子数为
您最近一年使用:0次
【推荐1】碳是常见的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
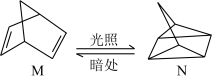 ΔH=+88.6kJ·mol-1。
ΔH=+88.6kJ·mol-1。
则M、N相比,较稳定的是_____ 。
(2)已知CH3OH(l)的燃烧热ΔH=-726.5kJ·mol-1,CH3OH(l)+ O2(g)= CO2(g)+2H2(g) ΔH=-akJ·mol-1,则a
O2(g)= CO2(g)+2H2(g) ΔH=-akJ·mol-1,则a________ 726.5(填“>”“<”或“=”)。
(3)煤气化制合成气(CO和H2)
已知:①C(s)+H2O(g)=CO(g)+H2(g)ΔH1=+131.3kJ·mol-1
②C(s)+2H2O(g)=CO2(g)+2H2(g)ΔH2=+90kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是________ 。
(4)已知E1=134kJ·mol-1、E2=368kJ·mol-1,请参考题中图表,按要求填空:


①图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是________ (填“增大”“减小”或“不变”,下同),ΔH的变化是________ 。NO2和CO反应的热化学方程式为________ 。
②下表所示是部分化学键的键能参数:
已知P4(g)+5O2(g)=P4O10(g) ΔH=-dkJ·mol-1,P4及P4O10的结构如图Ⅱ所示。表中x=________ (用含a、b、c、d的代数式表示)。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
 ΔH=+88.6kJ·mol-1。
ΔH=+88.6kJ·mol-1。则M、N相比,较稳定的是
(2)已知CH3OH(l)的燃烧热ΔH=-726.5kJ·mol-1,CH3OH(l)+
 O2(g)= CO2(g)+2H2(g) ΔH=-akJ·mol-1,则a
O2(g)= CO2(g)+2H2(g) ΔH=-akJ·mol-1,则a(3)煤气化制合成气(CO和H2)
已知:①C(s)+H2O(g)=CO(g)+H2(g)ΔH1=+131.3kJ·mol-1
②C(s)+2H2O(g)=CO2(g)+2H2(g)ΔH2=+90kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是
(4)已知E1=134kJ·mol-1、E2=368kJ·mol-1,请参考题中图表,按要求填空:


①图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是
②下表所示是部分化学键的键能参数:
| 化学键 | P—P | P—O | O=O | P=O |
| 键能/(kJ·mol-1) | a | b | C | x |
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】(1)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)ΔH1=-1048.9kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g)ΔH2=-534.2kJ/mol
则N2(g)+2O2(g)=N2O4(l)ΔH3=___________ kJ/mol
(2)化学反应中放出的热能(焓变,ΔH)与反应物和生成物在反应过程中断键和形成新键过程中吸收和放出能量的大小有关。
已知:H2(g)+Cl2(g)=2HCl(g)ΔH=-183kJ/mol,断裂1molH-H键吸收的能量为436kJ,断裂1molCl-Cl键吸收的能量为243kJ,则形成1molH-Cl键放出的能量为___________ kJ。
(3)根据以下三个热化学方程式:
2H2S(g)+3O2(g)===2SO2(g)+2H2O(l)ΔH=-Q1kJ/mol,
2H2S(g)+O2(g)===2S(s)+2H2O(l)ΔH=-Q2kJ/mol,
2H2S(g)+O2(g)===2S(s)+2H2O(g)ΔH=-Q3kJ/mol。
判断Q1、Q2、Q3三者大小关系___________>___________>___________,___________
已知:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)ΔH1=-1048.9kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g)ΔH2=-534.2kJ/mol
则N2(g)+2O2(g)=N2O4(l)ΔH3=
(2)化学反应中放出的热能(焓变,ΔH)与反应物和生成物在反应过程中断键和形成新键过程中吸收和放出能量的大小有关。
已知:H2(g)+Cl2(g)=2HCl(g)ΔH=-183kJ/mol,断裂1molH-H键吸收的能量为436kJ,断裂1molCl-Cl键吸收的能量为243kJ,则形成1molH-Cl键放出的能量为
(3)根据以下三个热化学方程式:
2H2S(g)+3O2(g)===2SO2(g)+2H2O(l)ΔH=-Q1kJ/mol,
2H2S(g)+O2(g)===2S(s)+2H2O(l)ΔH=-Q2kJ/mol,
2H2S(g)+O2(g)===2S(s)+2H2O(g)ΔH=-Q3kJ/mol。
判断Q1、Q2、Q3三者大小关系___________>___________>___________,
您最近一年使用:0次

 溶液和KOH溶液反应时有热量放出,已知反应物的总能量为E1,生成物的总能量为E2。试回答下列问题:
溶液和KOH溶液反应时有热量放出,已知反应物的总能量为E1,生成物的总能量为E2。试回答下列问题: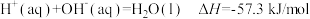 ,计算下列中和反应中放出的热量。
,计算下列中和反应中放出的热量。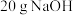 配成稀溶液与足量稀盐酸反应,放出
配成稀溶液与足量稀盐酸反应,放出 配成稀溶液与足量稀硝酸反应,放出
配成稀溶液与足量稀硝酸反应,放出

