在25 ℃时,某稀溶液中由水电离产生的H+浓度为1.0×10-13 mol/L,下列有关该溶液的叙述,正确的是( )
| A.该溶液可能呈酸性 | B.该溶液一定呈碱性 |
| C.该溶液的pH一定是1 | D.该溶液的pH不可能为13 |
15-16高二上·内蒙古巴彦淖尔·期中 查看更多[18]
(已下线)第2讲 溶液的酸碱性和pH计算甘肃省兰州市天水市第三中学等2校2022-2023学年高二上学期10月期中化学试题甘肃省临夏甘南两地联考2022-2023学年高二上学期12月期中考试化学试题江西省南昌市知行中学2021-2022学年高二上学期期中化学试题(已下线)第22讲 水的电离与溶液的pH(讲)-2023年高考化学一轮复习讲练测(新教材新高考)云南省曲靖市罗平县第五中学2021-2022学年高二4月月考化学试题黑龙江省鹤岗市第一中学2021-2022学年高二上学期期中考试化学试题(已下线)第22讲 水的电离与溶液的pH(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)专题3.2.1 水的电离和溶液的酸碱性(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)河北正定中学2020-2021学年高二上学期第一次半月考化学试题(已下线)课时40 水的电离与溶液的酸碱性-2022年高考化学一轮复习小题多维练(全国通用)内蒙古集宁新世纪中学2020-2021学年高二下学期质量检测月考化学试题四川省苍溪实验中学校2020-2021学年高二上学期期中质量检测化学试题第26讲 水的电离和溶液的pH (精讲)-2021年高考化学一轮复习讲练测吉林省汪清县第六中学2020-2021学年高二上学期期中考试化学试题江西省上饶市横峰中学2020-2021学年高二上学期第一次月考化学(统招班)试题2015-2016学年内蒙古巴彦淖尔一中高二普通班上期中化学试卷2015-2016学年内蒙古巴彦淖尔一中高二上期中化学试卷
更新时间:2020-11-09 22:24:59
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】常温常压下,某同学向20.00mLc0mol•L-1氨水中逐滴加入0.1000mol•L-1的盐酸,实验测得溶液的pH随加入盐酸体积的变化如图所示,其中N点为反应终点(此时盐酸与氨水恰好完全反应),此时消耗盐酸的体积为17.20mL。下列说法中正确的是
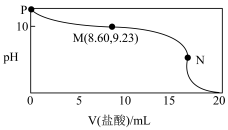

| A.选择甲基橙作指示剂,比选用酚酞作指示剂的误差大 |
B.M点的溶液中存在:c(NH3•H2O)>c(Cl-)>c(NH ) ) |
| C.N点溶液中:c(H+)-c(OH-)<c(Cl-)-c(NH3•H2O) |
| D.P、M、N三点对应溶液中水的电离程度最大的为M点 |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐2】砷(As)是一些工厂和矿山废水中的污染元素。常温下,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与加NaOH溶液调节pH的关系如图所示(已知:pKa=-lgKa),下列说法错误的是
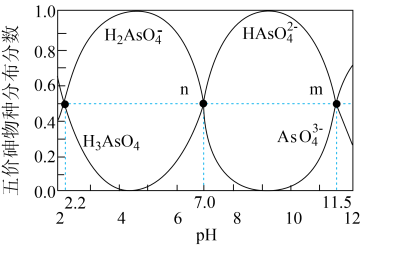

| A.Na2HAsO4溶液显碱性 |
| B.H3AsO4溶液pKa2为2.2 |
| C.m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1 |
D.n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO )=c(H2AsO4-)>c(H+)=c(OH-) )=c(H2AsO4-)>c(H+)=c(OH-) |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】常温下,对于pH均为9的NaOH溶液CH3COONa溶液,下列说法正确的是
| A.两溶液稀释10倍后,pH相等 |
| B.两溶液加热至相同的温度后,pH相等 |
| C.两溶液中各加入等体积的pH等于5的HCl溶液后,pH相等 |
| D.两溶液中水的离子积相等 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其中pH与溶液体积V的关系如图所示,下列说法正确的是


| A.稀释前,A、B两酸溶液的物质的量浓度一定相等 |
| B.稀释后,A酸溶液的酸性比B酸溶液强 |
| C.a=5时,A是强酸,B是弱酸 |
| D.稀释导致B酸的电离程度减小 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列溶液肯定呈酸性的是
| A.c(OH-)<c(H+)的溶液 | B.c(H+)水=10-11 mol/L |
| C.含H+的溶液 | D.pH<7的溶液 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列说法中正确的是
| A.pH<7 的溶液一定是酸溶液 |
| B.25℃时,pH=5 的溶液和 pH=3 的溶液中,前者的c(OH-)是后者的 100 倍 |
| C.滴入石蕊,溶液呈紫色,该溶液一定是中性的 |
| D.改变条件使 1mol/L 的氨水中的 NH4+的浓度增大时,溶液的 pH 值也一定增大 |
您最近半年使用:0次

 ,随着
,随着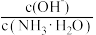 先不断减小后不变
先不断减小后不变
 和纯水的
和纯水的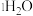 和
和 分子分别构成的水的pH不相同
分子分别构成的水的pH不相同 、SO
、SO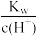 =0.1mol·L-1的溶液中:K+、NH3·H2O、SO
=0.1mol·L-1的溶液中:K+、NH3·H2O、SO 、NO
、NO 、AlO
、AlO 、Cl-、NO
、Cl-、NO

