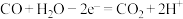已知:①N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
下列能表示N2H4(g)和N2O4(g)反应的热化学方程式的是( )
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
下列能表示N2H4(g)和N2O4(g)反应的热化学方程式的是( )
| A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7 kJ·mol-1 |
B.N2H4(g)+ N2O4(g)= N2O4(g)= N2(g)+2H2O(g) ΔH=-542.7kJ·mol-1 N2(g)+2H2O(g) ΔH=-542.7kJ·mol-1 |
| C.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-542.7 kJ·mol-1 |
| D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(l) ΔH=-1076.7 kJ·mol-1 |
19-20高二·全国·课时练习 查看更多[4]
(已下线)1.1.3 反应焓变的计算 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 第二节 反应热的计算 课时1 盖斯定律(已下线)选择性必修1 期中检测(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)浙江省温州市平阳县万全综合高级中学2021-2022学年高二上学期期中考试化学试题
更新时间:2020-10-12 18:46:10
|
相似题推荐
单选题
|
容易
(0.94)
名校
【推荐1】已知反应:2NO(g)+Br2(g)=2NOBr(g) △H=-akJ·mol-1(a>0),其反应机理如下:
①NO(g)+Br2(g)=NOBr2(g) △H1快反应;
②NO(g)+NOBr2(g)=2NOBr(g) △H2慢反应。
下列说法不正确的是( )
①NO(g)+Br2(g)=NOBr2(g) △H1快反应;
②NO(g)+NOBr2(g)=2NOBr(g) △H2慢反应。
下列说法不正确的是( )
| A.△H=△H1+△H2 |
| B.该反应的速率主要取决于反应① |
| C.NOBr2是该反应的中间产物,不是催化剂 |
| D.恒容时,增大Br2(g)的浓度能增加单位体积活化分子总数,加快反应速率 |
您最近一年使用:0次
单选题
|
容易
(0.94)
【推荐2】根据碘与氢气反应的热化学方程式:
①I2(g)+H2(g) 2HI(g) △H=-9.48 k.J·mol-1
2HI(g) △H=-9.48 k.J·mol-1
②I2(s)+H2((g) 2HI(g)△H=+26.48k.J·mol-1
2HI(g)△H=+26.48k.J·mol-1
下列判断正确的是
①I2(g)+H2(g)
 2HI(g) △H=-9.48 k.J·mol-1
2HI(g) △H=-9.48 k.J·mol-1②I2(s)+H2((g)
 2HI(g)△H=+26.48k.J·mol-1
2HI(g)△H=+26.48k.J·mol-1下列判断正确的是
| A.254gI(g)中通入2gH2(g),反应放热9.48kJ |
| B.1mol固态碘与1mol气态碘所含的能量相差17.00kJ |
| C.反应②的反应物总能量比反应①的反应物总能量低 |
| D.反应①的生成物比反应②的生成物稳定 |
您最近一年使用:0次

 在太阳能作用下将
在太阳能作用下将 转变成
转变成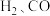 。其过程如下:
。其过程如下: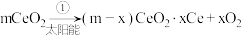
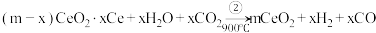
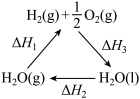
 起到了催化作用
起到了催化作用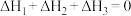
 和
和 构成的碱性燃料电池的负极反应式为
构成的碱性燃料电池的负极反应式为