某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,按照需要完成回收硫酸亚铁和铜的简单实验方案。
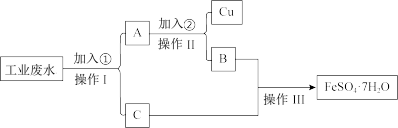
(1)试剂①应选择加入_______ 。
(2)操作Ⅰ、II、Ⅲ名称依次为______ 、______ 、______ 。
(3)加入②的试剂_______ (填“能”或者“不能”)用稀盐酸,原因为:________ 。
(4)取上述流程中回收的Cu加到1 L FeCl3溶液中,可溶解Cu的最大质量是32 g,则c(FeCl3)=___ mol/L。

(1)试剂①应选择加入
(2)操作Ⅰ、II、Ⅲ名称依次为
(3)加入②的试剂
(4)取上述流程中回收的Cu加到1 L FeCl3溶液中,可溶解Cu的最大质量是32 g,则c(FeCl3)=
更新时间:2020/11/21 09:39:17
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】甲同学发布了一份无色溶液检测报告,结果如下(水电离的H+、OH-忽略不计):
溶液①中所含全部离子及其浓度
(1)试分析判断:上述检测结果是否可靠,说明理由。结果是否可靠_________ 理由______
(2)乙同学对可能含有下列6种离子的溶液进行如下实验:Cl-、SO 、NH
、NH 、CO
、CO 、K+、Na+
、K+、Na+
已知:
a.取200mL上述溶液,向其中加入足量BaCl2溶液,反应后将沉淀过滤,洗涤,干燥,得沉淀4.30g,向沉淀中加入足量的盐酸,有2.33g沉淀不溶。
b.向a的滤液中加入足量的NaOH溶液,加热,产生标况下的气体1.12L(气体全部逸出)
①溶液中一定存在的离子有_____ ,可能存在的离子有_____ 。
写出a中发生的离子方程式_______ (写出任意一个即可)
②原溶液中c(CO )=
)=_____  ,c(NH
,c(NH )
)____________ c(SO )(填“>”“<”“=”,下同)
)(填“>”“<”“=”,下同)
溶液①中所含全部离子及其浓度
| 离子 | 浓度 mol·L-1 | 离子 | 浓度 mol·L-1 |
| Na+ | 0.1 | Cu2+ | 0.2 |
| Ba2+ | 0.5 | NO | 1.5 |
| Mg2+ | 0.3 | Cl- | 0.6 |
(2)乙同学对可能含有下列6种离子的溶液进行如下实验:Cl-、SO
 、NH
、NH 、CO
、CO 、K+、Na+
、K+、Na+已知:

a.取200mL上述溶液,向其中加入足量BaCl2溶液,反应后将沉淀过滤,洗涤,干燥,得沉淀4.30g,向沉淀中加入足量的盐酸,有2.33g沉淀不溶。
b.向a的滤液中加入足量的NaOH溶液,加热,产生标况下的气体1.12L(气体全部逸出)
①溶液中一定存在的离子有
写出a中发生的离子方程式
②原溶液中c(CO
 )=
)= ,c(NH
,c(NH )
) )(填“>”“<”“=”,下同)
)(填“>”“<”“=”,下同)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】为测定CuSO4溶液的浓度,甲同学用下列实验方案进行实验。回答下列问题:
实验原理:CuSO4+BaCl2=BaSO4↓+CuCl2
实验步骤:
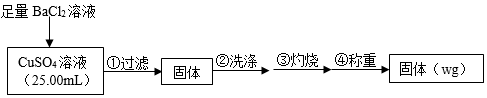
(1)判断SO 沉淀是否完全所选用的试剂为
沉淀是否完全所选用的试剂为________________ 。
(2)步骤②判断沉淀是否洗净的实验操作是________________________ 。
(3)步骤③灼烧时盛装样品的仪器名称为______________________ 。
(4)固体质量为w g,则c(CuSO4)=______________________ mol·L−1。
(5)若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得c(CuSO4)__________ (填“偏高”、“偏低”或“无影响”)。
实验原理:CuSO4+BaCl2=BaSO4↓+CuCl2
实验步骤:

(1)判断SO
 沉淀是否完全所选用的试剂为
沉淀是否完全所选用的试剂为(2)步骤②判断沉淀是否洗净的实验操作是
(3)步骤③灼烧时盛装样品的仪器名称为
(4)固体质量为w g,则c(CuSO4)=
(5)若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得c(CuSO4)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】下图是化学实验室浓盐酸试剂标签上的部分内容。
(1)写出工业上制 的化学方程式
的化学方程式___________ ,在实验室中进行该反应,现象是___________ 。
(2)该盐酸的物质的量浓度为___________ 。
(3)同学计划用该浓盐酸配制 的稀盐酸,现实验需要稀盐酸
的稀盐酸,现实验需要稀盐酸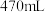 ,可供选用的仪器有:A.胶头滴管;B.烧瓶;C.烧杯;D.药匙;E.玻璃棒。
,可供选用的仪器有:A.胶头滴管;B.烧瓶;C.烧杯;D.药匙;E.玻璃棒。
①配制稀盐酸时,选择的仪器有:___________ (填序号),还缺少的仪器有___________ 。
②经计算,配制 的稀盐酸需要用量筒量取上述浓盐酸的体积为
的稀盐酸需要用量筒量取上述浓盐酸的体积为___________  。
。
③测定所配制的稀盐酸,发现其浓度大于 ,引起误差的原因可能是
,引起误差的原因可能是___________ (填序号)。
A.将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入容量瓶
B.转移溶液后,未洗涤烧杯和玻璃棒
C.定容时俯视容量瓶刻度线
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
| 盐酸 分子式:  相对分子质量:36.5 密度约   的质量分数:36.5% 的质量分数:36.5% |
 的化学方程式
的化学方程式(2)该盐酸的物质的量浓度为
(3)同学计划用该浓盐酸配制
 的稀盐酸,现实验需要稀盐酸
的稀盐酸,现实验需要稀盐酸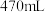 ,可供选用的仪器有:A.胶头滴管;B.烧瓶;C.烧杯;D.药匙;E.玻璃棒。
,可供选用的仪器有:A.胶头滴管;B.烧瓶;C.烧杯;D.药匙;E.玻璃棒。①配制稀盐酸时,选择的仪器有:
②经计算,配制
 的稀盐酸需要用量筒量取上述浓盐酸的体积为
的稀盐酸需要用量筒量取上述浓盐酸的体积为 。
。③测定所配制的稀盐酸,发现其浓度大于
 ,引起误差的原因可能是
,引起误差的原因可能是A.将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入容量瓶
B.转移溶液后,未洗涤烧杯和玻璃棒
C.定容时俯视容量瓶刻度线
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】长期放置的 溶液易被氧化而变质,某兴趣小组进行了如下实验:
溶液易被氧化而变质,某兴趣小组进行了如下实验:
(1)设计实验检验 溶液的变质程度,请将方案补充完整。
溶液的变质程度,请将方案补充完整。
③若要用酸性高锰酸钾检验 ,方法是
,方法是___________ 。(写离子反应方程式)
(2)利用部分变质的 溶液制备
溶液制备 ,请在括号内填写所需试剂①
,请在括号内填写所需试剂①___________ ;②氢氧化钠溶液;③加热;
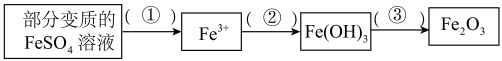
④若200mL该变质溶液制得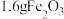 ,则变质过程中所需空气在标准状况下的体积约为
,则变质过程中所需空气在标准状况下的体积约为___________ L(结果保留两位小数)。
(3) 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 ,以利于人体吸收。为了验证这一猜想,设计了如下实验:
,以利于人体吸收。为了验证这一猜想,设计了如下实验:
实验方案:取适量 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。
溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。
实验现象:紫色褪去。
由上述实验能否得出“维生素C可将 转化为
转化为 ”的结论?请说明结论和理由:
”的结论?请说明结论和理由:___________ 。
 溶液易被氧化而变质,某兴趣小组进行了如下实验:
溶液易被氧化而变质,某兴趣小组进行了如下实验:(1)设计实验检验
 溶液的变质程度,请将方案补充完整。
溶液的变质程度,请将方案补充完整。| 实验方案 | 实验现象 | 实验结论 | |
| 步骤1 | 取待检测液于试管中,向其中滴加 ① | 溶液变红 |  溶液部分变质 溶液部分变质 |
| 步骤2 | 取待检测液于试管中,向其中滴加 ② | 生成蓝色沉淀 | |
 ,方法是
,方法是(2)利用部分变质的
 溶液制备
溶液制备 ,请在括号内填写所需试剂①
,请在括号内填写所需试剂①
④若200mL该变质溶液制得
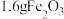 ,则变质过程中所需空气在标准状况下的体积约为
,则变质过程中所需空气在标准状况下的体积约为(3)
 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 ,以利于人体吸收。为了验证这一猜想,设计了如下实验:
,以利于人体吸收。为了验证这一猜想,设计了如下实验:实验方案:取适量
 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。
溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。实验现象:紫色褪去。
由上述实验能否得出“维生素C可将
 转化为
转化为 ”的结论?请说明结论和理由:
”的结论?请说明结论和理由:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】绿矾(FeSO4·nH2O)在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。请回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化;再向试管中通入空气,溶液逐渐变红。请解释变红的原因________________________ 。
(2)为测定某绿矾中结晶水含量,按下图组装好仪器并检查气密性。将石英玻璃管(带两端开关K1和K2)(设整个为装置A)称重,记为80.120g。将样品装入石英玻璃管中,再次将装置A称重,记为 107.020g。按下图连接好装置进行实验。
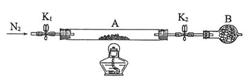
①仪器B的名称是____________________ 。
②实验操作步骤为: 第一步: 打开K1和K2,缓缓通入N2 ; 第二步:点燃酒精灯,小心加热;第三步:熄灭酒精灯 ;第四步:冷却到室温 ; 第五步:关闭K1和K2 ; 第六步:称量A 。 请问: 第一步缓缓通入N2 的目的是________________________ 。
重复上述操作步骤,直至A恒重,记为95.320g。
③计算绿矾化学式中结晶水n=________________ (保留一位小数)。
(3)同学们查找资料可知,硫酸亚铁在高温下分解产物为Fe2O3 以及 SO2和SO3。为了验证硫酸亚铁分解的气体产物,将已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加强热充分反应后,管中残留固体为_______ 色粉末。

C、D中的溶液依次为________ 、________ (填标号)。
a.品红 b.NaOH c.BaCl2 d.浓硫酸
(4)“严谨不仅仅是一种生活态度,更是科学精神”。检查装置气密性是化学实验中的重要操作之一,在上述32题实验装置气密性检查的操作是_______________________________ 。
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化;再向试管中通入空气,溶液逐渐变红。请解释变红的原因
(2)为测定某绿矾中结晶水含量,按下图组装好仪器并检查气密性。将石英玻璃管(带两端开关K1和K2)(设整个为装置A)称重,记为80.120g。将样品装入石英玻璃管中,再次将装置A称重,记为 107.020g。按下图连接好装置进行实验。

①仪器B的名称是
②实验操作步骤为: 第一步: 打开K1和K2,缓缓通入N2 ; 第二步:点燃酒精灯,小心加热;第三步:熄灭酒精灯 ;第四步:冷却到室温 ; 第五步:关闭K1和K2 ; 第六步:称量A 。 请问: 第一步缓缓通入N2 的目的是
重复上述操作步骤,直至A恒重,记为95.320g。
③计算绿矾化学式中结晶水n=
(3)同学们查找资料可知,硫酸亚铁在高温下分解产物为Fe2O3 以及 SO2和SO3。为了验证硫酸亚铁分解的气体产物,将已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加强热充分反应后,管中残留固体为


C、D中的溶液依次为
a.品红 b.NaOH c.BaCl2 d.浓硫酸
(4)“严谨不仅仅是一种生活态度,更是科学精神”。检查装置气密性是化学实验中的重要操作之一,在上述32题实验装置气密性检查的操作是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】铅单质及其化合物在新能源领域应用广泛,工业上利用方铅精矿(主要成分为PbS)制备PbSO4的工艺流程如下:

已知:①PbCl2(s)+2Cl-(aq) PbCl4-(aq) △H>0 ②Ksp(PbSO4)=1.0×10-8,Ksp(PbCl2)=1.6×10-5③Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH值分别为3.2、7.0。
PbCl4-(aq) △H>0 ②Ksp(PbSO4)=1.0×10-8,Ksp(PbCl2)=1.6×10-5③Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH值分别为3.2、7.0。
(1)步骤Ⅰ中发现有淡黄色沉淀生成,请写出离子反应方程式:_______________________ ;
(2)步骤Ⅰ原料预处理过程中写出一种除搅拌外加快反应速率的办法:_________________ ;反应温度不宜过高,且需加入过量盐酸保证溶液呈强酸性,原因是:____________________ ;
(3)操作①应为:_______ ;操作②应为:_________ ;
A、趁热过滤 B、蒸发浓缩,冷却结晶; C、蒸发结晶 D、重结晶
(4)写出步骤III中PbCl2生成PbSO4的离子反应方程式:___________________________ ,该反应的平衡常数K=_______ ;
(5)铅蓄电池(Pb-PbO2-H2SO4)充电时的阳极反应方程式:_________________________ ;
(6)某铅蓄电池放电时电流为0.2A,可持续放电时间96500s,此时参加反应的Pb的质量为41.4g,求该电池放电的能量转化率α=_________ 。(电池能量转化率的定义:α=实际输出电量/理论输出电量×100%,结果保留两位有效数字,已知法拉第常数为96500C/mol)

已知:①PbCl2(s)+2Cl-(aq)
 PbCl4-(aq) △H>0 ②Ksp(PbSO4)=1.0×10-8,Ksp(PbCl2)=1.6×10-5③Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH值分别为3.2、7.0。
PbCl4-(aq) △H>0 ②Ksp(PbSO4)=1.0×10-8,Ksp(PbCl2)=1.6×10-5③Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH值分别为3.2、7.0。(1)步骤Ⅰ中发现有淡黄色沉淀生成,请写出离子反应方程式:
(2)步骤Ⅰ原料预处理过程中写出一种除搅拌外加快反应速率的办法:
(3)操作①应为:
A、趁热过滤 B、蒸发浓缩,冷却结晶; C、蒸发结晶 D、重结晶
(4)写出步骤III中PbCl2生成PbSO4的离子反应方程式:
(5)铅蓄电池(Pb-PbO2-H2SO4)充电时的阳极反应方程式:
(6)某铅蓄电池放电时电流为0.2A,可持续放电时间96500s,此时参加反应的Pb的质量为41.4g,求该电池放电的能量转化率α=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】钴是一种重要的战略金属,可由铜钴矿(杂质为铁)去铜除铁后回收制得。相关工业流程如图所示。

已知:①针铁矿成分为FeOOH,是一种有利用价值、易于沉淀的物质;
②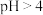 时
时 水解生成
水解生成 胶体。
胶体。
(1)写出“还原”步骤中,把 还原为
还原为 的离子方程式
的离子方程式______
(2)①加入试剂X,将 转化为FeOOH,则试剂X最好选用
转化为FeOOH,则试剂X最好选用______
A. 溶液 B.
溶液 B. 溶液 C.浓
溶液 C.浓 D.
D.
②写出 转化FeOOH的离子方程式
转化FeOOH的离子方程式______
(3)溶液pH对回收钴有影响密切,如图所示。

①pH的合适取值为______
②已知浸出液的主要成分为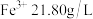 、
、 、
、 ,(
,( 的
的 ),则
),则 开始沉淀的
开始沉淀的
______
③ 大于4时,钴回收率骤降的原因
大于4时,钴回收率骤降的原因______

已知:①针铁矿成分为FeOOH,是一种有利用价值、易于沉淀的物质;
②
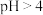 时
时 水解生成
水解生成 胶体。
胶体。(1)写出“还原”步骤中,把
 还原为
还原为 的离子方程式
的离子方程式(2)①加入试剂X,将
 转化为FeOOH,则试剂X最好选用
转化为FeOOH,则试剂X最好选用A.
 溶液 B.
溶液 B. 溶液 C.浓
溶液 C.浓 D.
D.
②写出
 转化FeOOH的离子方程式
转化FeOOH的离子方程式(3)溶液pH对回收钴有影响密切,如图所示。

①pH的合适取值为
②已知浸出液的主要成分为
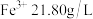 、
、 、
、 ,(
,( 的
的 ),则
),则 开始沉淀的
开始沉淀的
③
 大于4时,钴回收率骤降的原因
大于4时,钴回收率骤降的原因
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】软锰矿的主要成分是MnO2,还含有少量金属铁、铝、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:
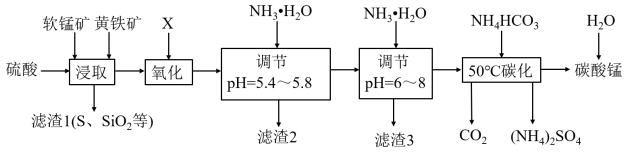
已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
(1)提高浸出率可采取的措施有__________ 、________________
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是________________ 
(3)已知几种氧化剂氧化能力的强弱顺序为(NH4)2S2O8>H2O2>Cl2>MnO2>Fe3+,则氧化剂X宜选择_______ (填字母)
A.(NH4)2S2O8 B.MnO2 C.H2O2 D.Cl2
(4)为确保Cu2+沉淀完全调节pH范围为__________
(5)“滤渣2”的主要成分化学式是____________ 、____________
(6)采用“50℃碳化”反应的离子方程式为____________ ;“50℃碳化”过程中,不用碳酸钠溶液替代NH4HCO3溶液,可能的原因是:____
(7)碳酸锰是制造电信器材软磁铁氧体,制造其他锰盐的原料。溶于稀无机酸,不溶于水和乙醇,MnCO3溶于稀无机酸,其实质是溶解平衡的移动。若工业流程中用稀盐酸酸浸,浸出液中c(Mn2+)=10-1mol/L,则c(CO )在浸出液中的最大浓度为
)在浸出液中的最大浓度为________ mol/L[Ksp(MnCO3)=1.8×10-11]

已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率可采取的措施有
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是

(3)已知几种氧化剂氧化能力的强弱顺序为(NH4)2S2O8>H2O2>Cl2>MnO2>Fe3+,则氧化剂X宜选择
A.(NH4)2S2O8 B.MnO2 C.H2O2 D.Cl2
(4)为确保Cu2+沉淀完全调节pH范围为
(5)“滤渣2”的主要成分化学式是
(6)采用“50℃碳化”反应的离子方程式为
(7)碳酸锰是制造电信器材软磁铁氧体,制造其他锰盐的原料。溶于稀无机酸,不溶于水和乙醇,MnCO3溶于稀无机酸,其实质是溶解平衡的移动。若工业流程中用稀盐酸酸浸,浸出液中c(Mn2+)=10-1mol/L,则c(CO
 )在浸出液中的最大浓度为
)在浸出液中的最大浓度为
您最近一年使用:0次



