X、Y、Z、M、W、Q、R是7种短周期元素,其性质如下:
完成下列填空:
(1)上述元素中,X在周期表中的位置是__ ,由Y、Q形成的简单离子半径大小关系是Y___ Q(填“>”或“<”)。
(2)由W或Q与R两种元素组成的微粒中,都是10e-体参与的离子反应方程式为___ ,是18e-分子的有__ 种。
(3)写出证明Z、M非金属性强弱的化学方程式为__ 。
(4)Z、W、Q、R四种元素按原子个数比为1:1:4:5形成某化合物,则该化合物中化学键类型为___ 。(填选项)
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
| 元素代号 | X | Y | Z | M | W | Q | R |
| 原子半径/nm | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | ||
| 主要化合价 | +3 | +6,﹣2 | +7,﹣1 | +5,﹣3 | ﹣2 | ||
| 其它 | 焰色为黄色 | 形成气体单质密度最小 |
(1)上述元素中,X在周期表中的位置是
(2)由W或Q与R两种元素组成的微粒中,都是10e-体参与的离子反应方程式为
(3)写出证明Z、M非金属性强弱的化学方程式为
(4)Z、W、Q、R四种元素按原子个数比为1:1:4:5形成某化合物,则该化合物中化学键类型为
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
更新时间:2020-11-14 15:36:00
|
相似题推荐
解答题-无机推断题
|
较易
(0.85)
名校
【推荐1】元素周期表与元素周期律在化学学习研究中有很重要的作用。如表是元素周期表的一部分,回答下列问题(用相关化学用语回答)。
(1)③、⑥、⑨的简单离子半径由小到大的顺序___________ (用离子符号表示)。
(2)写出元素⑪的单质与水反应的化学方程式___________ 。
(3)元素③、④、⑩的简单气态氢化物的稳定性最强的是___________ (用化学式表示)。
(4)配制0.1mol/L500mL元素⑤的氢氧化物溶液,需用托盘天平称取该氢氧化物的质量是___________ g。
(5)⑤2⑨③3在加热条件下发生分解反应生成两种盐,其中氧化产物与还原产物的物质的量之比为3:1,该反应的化学方程式:___________ 。
(6)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是___________(填字母)。
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
| 四 | ⑪ |
(2)写出元素⑪的单质与水反应的化学方程式
(3)元素③、④、⑩的简单气态氢化物的稳定性最强的是
(4)配制0.1mol/L500mL元素⑤的氢氧化物溶液,需用托盘天平称取该氢氧化物的质量是
(5)⑤2⑨③3在加热条件下发生分解反应生成两种盐,其中氧化产物与还原产物的物质的量之比为3:1,该反应的化学方程式:
(6)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是___________(填字母)。
| A.比较这两种元素单质的沸点 |
| B.比较这两种元素单质与氢气化合的难易 |
| C.比较这两种元素的最高价氧化物对应水化物的酸性强弱 |
| D.比较这两种元素的单质与酸或碱反应的难易程度 |
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐2】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
(1)Z在元素周期表中的位置是______________________________ 。
(2)元素Q和R形成的化合物A是果实催熟剂,用A制备乙醇的化学方程式是_________ 。
(3)单质铜和元素M的最高价氧化物对应水化物的稀溶液发生反应的离子方程式为_______________________________________________________ 。
(4)元素X的金属性比元素Y___ (填“强”或“弱”),用原子结构的知识解释原因___________ 。
(5)元素Q、元素Z的含量影响钢铁性能,采用下图装置A在高温下将钢样中元素Q、元素Z转化为QO2、ZO2。
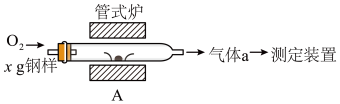
①气体a的成分是________________ (填化学式)。
②若钢样中元素Z以FeZ的形式存在,在A中反应生成ZO2和稳定的黑色氧化物,则反应的化学方程式是________________________________________ 。
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合价 | +2 | +3 | +6,−2 | +5,−3 | +4,−4 | +1 |
(2)元素Q和R形成的化合物A是果实催熟剂,用A制备乙醇的化学方程式是
(3)单质铜和元素M的最高价氧化物对应水化物的稀溶液发生反应的离子方程式为
(4)元素X的金属性比元素Y
(5)元素Q、元素Z的含量影响钢铁性能,采用下图装置A在高温下将钢样中元素Q、元素Z转化为QO2、ZO2。

①气体a的成分是
②若钢样中元素Z以FeZ的形式存在,在A中反应生成ZO2和稳定的黑色氧化物,则反应的化学方程式是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐3】下表为元素周期表的一部分。
回答下列问题
(1)W元素在周期表中的位置为__________ 。
(2)表中元素原子半径最大的是(写元素符号)__________ 。
(3)写出由上表中两种元素组成,可用作制冷剂的一种化合物的电子式__________ 。
(4)下列事实不能说明Z元素的非金属性比S元素的非金属性强的是__________ ;
A.Z单质与H2S溶液反应,溶液变浑浊
B.在氧化还原反应中,1molY单质比1molS得电子多
C.Z和S两元素的简单氢化物受热分解,前者的分解温度高
(5)X与W两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式____________________ 。
| 碳 | Y | Z | |
| X | 硫 | W |
(1)W元素在周期表中的位置为
(2)表中元素原子半径最大的是(写元素符号)
(3)写出由上表中两种元素组成,可用作制冷剂的一种化合物的电子式
(4)下列事实不能说明Z元素的非金属性比S元素的非金属性强的是
A.Z单质与H2S溶液反应,溶液变浑浊
B.在氧化还原反应中,1molY单质比1molS得电子多
C.Z和S两元素的简单氢化物受热分解,前者的分解温度高
(5)X与W两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐1】百度指数显示,2022年12月5日至12月11日,除各类感冒药外,电解质水的搜索指数整体同比陡增。美国《航空航天环境医学》(ASEM)杂志还通过饮用等量的电解质饮料和纯净水4小时后体内的水分贮存量对比显示,电解质水在人体内的贮留时间更长,更利于滋润身体。
(1)家庭自制电解质水,可用的电解质是_______
A.冰醋酸 B.葡萄糖 C.小苏打 D.酒精 E.鸡蛋清 F.二氧化碳
(2)上述物质中属于直线型分子的电子式为_______ ;小苏打中的化学键(类型)是_______ 。
(3)如何证明碳和硫的非金属性强弱?(写化学方程式)_______ 。
(4)配平下列反应:______________________ 。
_____KMnO4+____CS2+____H2SO4=___K2SO4+___MnSO4+____SO2↑+___CO2↑+____H2O
(1)家庭自制电解质水,可用的电解质是
A.冰醋酸 B.葡萄糖 C.小苏打 D.酒精 E.鸡蛋清 F.二氧化碳
(2)上述物质中属于直线型分子的电子式为
(3)如何证明碳和硫的非金属性强弱?(写化学方程式)
(4)配平下列反应:
_____KMnO4+____CS2+____H2SO4=___K2SO4+___MnSO4+____SO2↑+___CO2↑+____H2O
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐2】下表为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)以上11种元素的最高价氧化物的水化物,碱性最强的是_______ ,酸性最强的是_______ 。
(2)②③⑧元素形成的简单离子半径由大到小的顺序是_______ (填离子符号)。
(3)①和⑨两元素形成化合物的电子式为_______ ,该化合物的溶液与元素⑧的单质反应的离子方程式为_______ 。
(4)元素①最高价氧化物对应的水化物能与⑤的最高价氧化物对应的水化物发生反应,该化学方程式为_______ 。
(5)⑧⑨⑪三种元素形成的气态氢化物中最稳定的是_______ (填化学式),元素的非金属性⑧_______ ⑨(填“>”或“<”),下列事实不能证明上述结论的是_______ 。
A.元素⑧的单质与⑨的氢化物的水溶液反应,溶液变为黄色
B.元素⑧的最高价氧化物对应水化物的酸性比元素⑨的强
C.元素⑧和⑨的氢化物受热分解,前者的分解温度高
D.元素⑧的氢化物的水溶液的酸性比元素⑨的弱
E.元素⑧的对应的离子还原性比元素⑨对应的离子还原性弱
| 组 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | ⑪ | |||||
| 三 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 四 | ② | ④ | ⑨ |
(1)以上11种元素的最高价氧化物的水化物,碱性最强的是
(2)②③⑧元素形成的简单离子半径由大到小的顺序是
(3)①和⑨两元素形成化合物的电子式为
(4)元素①最高价氧化物对应的水化物能与⑤的最高价氧化物对应的水化物发生反应,该化学方程式为
(5)⑧⑨⑪三种元素形成的气态氢化物中最稳定的是
A.元素⑧的单质与⑨的氢化物的水溶液反应,溶液变为黄色
B.元素⑧的最高价氧化物对应水化物的酸性比元素⑨的强
C.元素⑧和⑨的氢化物受热分解,前者的分解温度高
D.元素⑧的氢化物的水溶液的酸性比元素⑨的弱
E.元素⑧的对应的离子还原性比元素⑨对应的离子还原性弱
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐3】元素周期律是重要的化学学习工具。随着原子序数变化,7种短周期元素(用字母表示)原子半径的相对大小、最高正化合价或最低负化合价的变化如图所示。
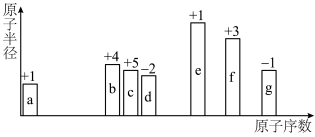
(1)b在元素周期表中的位置是_______ 周期_______ 族。7种元素中金属性最强的是_______ (用元素符号表示,下同),与d处于同一主族的短周期元素是_______ 。
(2)b和c的最高价氧化物的水化物中,酸性较强的是_______ (用化学式表示,下同),c和d的简单氢化物的稳定性较弱的是_______ 。
(3)d和f形成的化合物为_______ (用化学式表示),该化合物在熔融状态下能导电,属于_______ 化合物(填“离子”或“共价”),该化合物与盐酸反应的离子方程式为_______ 。
(4)d、e的单质在加热条件下反应生成的化合物中存在的化学键有_______ 。
(5)用电子式表示由a、c两种元素形成的化合物的形成过程______________ 。

(1)b在元素周期表中的位置是
(2)b和c的最高价氧化物的水化物中,酸性较强的是
(3)d和f形成的化合物为
(4)d、e的单质在加热条件下反应生成的化合物中存在的化学键有
(5)用电子式表示由a、c两种元素形成的化合物的形成过程
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐1】下表列出了①~⑥短周期元素在周期表中的位置:
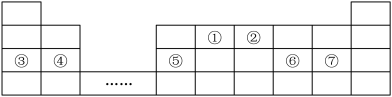
请按要求回答下列问题。
(1)元素⑥在元素周期表的位置是_______ 。
(2)元素⑥与⑦的简单气态氢化物中热稳定性更好的是(填化学式)_______ 。
(3)这七种元素中,最高价氧化物对应的水化物中碱性最强的碱是(填化学式)_______ 。
(4)元素②的简单离子的离子结构示意图为_______ 。
(5)③④⑤⑥的简单离子半径由大到小的顺序是(用对应的离子符号表示)_______ 。
(6)在盛有水的小烧杯中加入元素③的单质,发生反应的离子方程式为_______ ;向上述反应后的溶液中再加入元素⑤的单质,发生反应的化学方程式为_______ 。

请按要求回答下列问题。
(1)元素⑥在元素周期表的位置是
(2)元素⑥与⑦的简单气态氢化物中热稳定性更好的是(填化学式)
(3)这七种元素中,最高价氧化物对应的水化物中碱性最强的碱是(填化学式)
(4)元素②的简单离子的离子结构示意图为
(5)③④⑤⑥的简单离子半径由大到小的顺序是(用对应的离子符号表示)
(6)在盛有水的小烧杯中加入元素③的单质,发生反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐2】 X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
(1)Y在元素周期表中的位置是____________________ ;R在自然界中有质量数为35和37的两种核素,它们之间的关系互为__________ 。
(2)Q的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物反应的离子方程式是____________________ 。
(3)下列事实能证明Y与R非金属性强弱的是_______ (选填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态 b.稳定性XR >YX4 c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是_________________ 。
(5)X单质与氧气在强碱性条件下形成燃料电池时的负极反应式为__________________ 。
(6)请用电子式表示Z2M的形成过程___________________________ 。
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(2)Q的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物反应的离子方程式是
(3)下列事实能证明Y与R非金属性强弱的是
a.常温下Y的单质呈固态,R的单质呈气态 b.稳定性XR >YX4 c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是
(5)X单质与氧气在强碱性条件下形成燃料电池时的负极反应式为
(6)请用电子式表示Z2M的形成过程
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐3】短周期主族元素A、B、C、D、E的原子序数依次增大。已知:
①A原子最外层电子数是次外层电子数的两倍;B的阴离子与C的阳离子跟氖原于的电子层结构相同; B 与 D 同主族;
②常温下B2是气体,相同条件下它相对氢气的密度是16;
③C的单质能在B2中燃烧,生成淡黄色固体甲;
回答下列问题:
(1)A在元素周期表中的位置为___________ ;C的离子结构示意图为 ___________ ;E的最高价氧化物对应的水化物是 ___________ (填化学式);
(2)五种元素中,原子半径最大的是___________ (填元素符号);D、E的简单氢化物中热稳定性较差的是 ___________ (填化学式);
①A原子最外层电子数是次外层电子数的两倍;B的阴离子与C的阳离子跟氖原于的电子层结构相同; B 与 D 同主族;
②常温下B2是气体,相同条件下它相对氢气的密度是16;
③C的单质能在B2中燃烧,生成淡黄色固体甲;
回答下列问题:
(1)A在元素周期表中的位置为
(2)五种元素中,原子半径最大的是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐1】前四周期元素A、B、C、D、E原子序数依次增大,其相关性质如表所示:
请根据以上情况,回答下列问题:
(1)E元素基态原子核外有_______ 种能量不同的电子,其价电子排布式为__________ 。
(2)B和C可形成一种同时含有共价键和离子键的化合物,写出此化合物与水反应的化学方程式_______ 。
(3)B、C、D三种元素的简单离子的半径由大到小的顺序为_______ (用离子符号表示)。
(4)A的简单氢化物与最高价氧化物对应的水化物可以发生反应,则生成物中阳离子的结构式为_______ 。
(5)检测元素C的常见方法是____________ 。
| A | 2p能级电子半充满 |
| B | 与A同周期,且原子核外有2个未成对电子 |
| C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
| D | 其基态原子外围电子排布式为nsn-1npn+1 |
| E | 前四周期元素中,E元素基态原子未成对电子数最多 |
(1)E元素基态原子核外有
(2)B和C可形成一种同时含有共价键和离子键的化合物,写出此化合物与水反应的化学方程式
(3)B、C、D三种元素的简单离子的半径由大到小的顺序为
(4)A的简单氢化物与最高价氧化物对应的水化物可以发生反应,则生成物中阳离子的结构式为
(5)检测元素C的常见方法是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐2】A、B、C、D是四中短周期元素,原子序数依次增大,且只有C为金属元素,A、C位于同一主族,B的最外层电子数为次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等,请回答下列问题:
(1)D元素在元素周期表中的位置____________ ,写出实验室制取D单质的化学方程式_____________ 。
(2)A、B、C形成的化合物所含化学键类型___________________ 。
(3)用电子式表示C、D构成化合物形成过程______________
(4)由元素B和D形成的单质或化合物能用于自来水消毒的是_________ 、_________ 。
(1)D元素在元素周期表中的位置
(2)A、B、C形成的化合物所含化学键类型
(3)用电子式表示C、D构成化合物形成过程
(4)由元素B和D形成的单质或化合物能用于自来水消毒的是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐3】下表为元素周期表的短周期区域一部分,回答下列问题:
(1)⑤的简单离子结构示意图为 ,此元素在周期表中的位置为
,此元素在周期表中的位置为________ ,同主族元素中,非金属性强于此元素的有___________ (填元素符号)。
(2)④与⑤组成的化合物常用于食品调味,用电子式表示此化合物的形成过程__________ 。
(3)②、③、④元素的简单离子半径由大到小的顺序为_________ (填离子符号)。
(4)由③、④组成的化合物中可能含有化学键的类型为_______________ 。
(5)②与③的简单氢化物稳定性更强的是_______ (填化学式)。
(6)设计实验证明②的非金属性强于①:____________________ 。
| ① | ② | ③ | ||||
| ④ | ⑤ |
 ,此元素在周期表中的位置为
,此元素在周期表中的位置为(2)④与⑤组成的化合物常用于食品调味,用电子式表示此化合物的形成过程
(3)②、③、④元素的简单离子半径由大到小的顺序为
(4)由③、④组成的化合物中可能含有化学键的类型为
(5)②与③的简单氢化物稳定性更强的是
(6)设计实验证明②的非金属性强于①:
您最近一年使用:0次



