依据题中所给信息完成指定问题:
(1)地康法制氯气可按下列催化过程进行:
CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=+83 kJ·mol-1
Cl2(g) ΔH1=+83 kJ·mol-1
CuCl(s)+ O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则反应4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=________ kJ·mol-1。
(2)用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH溶液反应测定中和热,实验中测得起始平均温度为20.4℃,反应后最高温度为23.4 ℃,反应后溶液的比热容为4.2 J·g-1·℃-1,盐酸和NaOH溶液的密度都近似认为是1 g·cm-3,则中和热ΔH=________ ;
(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下16 g SiH4自燃放出热量750 kJ。SiH4自燃的热化学方程式为___________ 。
(1)地康法制氯气可按下列催化过程进行:
CuCl2(s)=CuCl(s)+
 Cl2(g) ΔH1=+83 kJ·mol-1
Cl2(g) ΔH1=+83 kJ·mol-1CuCl(s)+
 O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则反应4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=
(2)用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH溶液反应测定中和热,实验中测得起始平均温度为20.4℃,反应后最高温度为23.4 ℃,反应后溶液的比热容为4.2 J·g-1·℃-1,盐酸和NaOH溶液的密度都近似认为是1 g·cm-3,则中和热ΔH=
(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下16 g SiH4自燃放出热量750 kJ。SiH4自燃的热化学方程式为
更新时间:2020-12-09 23:11:32
|
相似题推荐
计算题
|
适中
(0.65)
名校
【推荐1】(1)SiH4是一种无色的气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O,已知室温下2gSiH4自燃放出热量89.2kJ,其热化学方程式为:___________ 。
(2)某次发射火箭,用气态N2H4(肼)在NO2气体中燃烧,生成N2、液态H2O。
已知:①N2(g)+2O2(g)=2NO2(g) ΔH1=+67.2kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH2=-534kJ/mol,
假如都在相同状态下,请写出发射火箭反应的热化学方程式____________ 。
(2)某次发射火箭,用气态N2H4(肼)在NO2气体中燃烧,生成N2、液态H2O。
已知:①N2(g)+2O2(g)=2NO2(g) ΔH1=+67.2kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH2=-534kJ/mol,
假如都在相同状态下,请写出发射火箭反应的热化学方程式
您最近半年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】回答下列问题:
(1)工业上用H2和Cl2反应制HCl,各键能数据为:H-H:436kJ/mol,Cl-Cl:243kJ/mol,H-Cl:431kJ/mol。该反应的热化学方程式是_______ ;
(2)已知25℃、101kPa时:①2SO2(g)+O2(g)⇌2SO3(g) ΔH1=-197kJ·mol-1
②H2O(g)=H2O(l) ΔH2=-44kJ·mol-1
③2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) ΔH3=-545kJ·mol-1
则SO3(g)与H2O(l)反应的热化学方程式为_______ ;
(3)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(中的ΔH表示生成1mol产物的数据)。
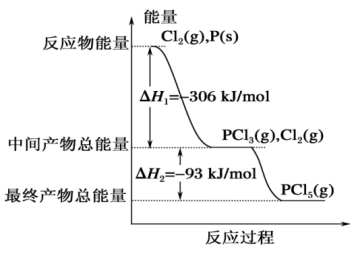
根据上图回答问题:PCl5(g)=PCl3(g)+Cl2(g) ΔH2=_______ ;
(1)工业上用H2和Cl2反应制HCl,各键能数据为:H-H:436kJ/mol,Cl-Cl:243kJ/mol,H-Cl:431kJ/mol。该反应的热化学方程式是
(2)已知25℃、101kPa时:①2SO2(g)+O2(g)⇌2SO3(g) ΔH1=-197kJ·mol-1
②H2O(g)=H2O(l) ΔH2=-44kJ·mol-1
③2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) ΔH3=-545kJ·mol-1
则SO3(g)与H2O(l)反应的热化学方程式为
(3)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(中的ΔH表示生成1mol产物的数据)。

根据上图回答问题:PCl5(g)=PCl3(g)+Cl2(g) ΔH2=
您最近半年使用:0次
计算题
|
适中
(0.65)
【推荐3】燃煤烟气中的 、
、 可通入碱液或利用电解池装置进行吸收处理。
可通入碱液或利用电解池装置进行吸收处理。
Ⅰ. 常温下, 是一种有特殊臭味、稳定性较差的淡蓝色气体。
是一种有特殊臭味、稳定性较差的淡蓝色气体。 氧化性强于
氧化性强于 ,能更有效地氧化
,能更有效地氧化 。
。
(1)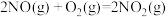


 (活化能
(活化能 )
)
则

_______  (活化能
(活化能 )
)
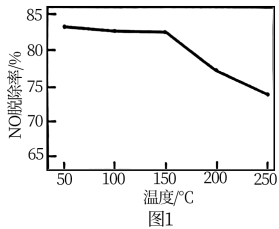
(2)为分析氧化时温度对 脱除率的影响,将
脱除率的影响,将 与
与 混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,
混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时, 脱除率随
脱除率随 与
与 混合反应时温度变化如图1所示。温度在
混合反应时温度变化如图1所示。温度在 时,随着温度升高,
时,随着温度升高, 脱除率无明显变化;温度超过
脱除率无明显变化;温度超过 时,随着温度升高,
时,随着温度升高, 脱除率下降。其可能原因是
脱除率下降。其可能原因是_______ 。
Ⅱ.一定条件下 水溶液中可发生如下反应:
水溶液中可发生如下反应: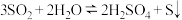 ,部分物质的物质的量的变化如图2所示。
,部分物质的物质的量的变化如图2所示。

(3)曲线 表示
表示_______ 的变化(填名称)。 时反应达到平衡状态,用
时反应达到平衡状态,用 表示反应的平均速率为
表示反应的平均速率为_______ 。
(4)下列不能说明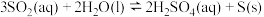 反应已达到平衡状态的是
反应已达到平衡状态的是_______ 。
A.
B. 绝热恒容时,反应的化学平衡常数不再变化
C. 恒温恒容时,混合溶液中硫酸的密度不再变化
D. 反应过程中,溶液中分子总数不再改变
Ⅲ. 若烟气主要成分为 、
、 ,可通过电解法除去,其原理如图3所示。阳极的电极反应式为
,可通过电解法除去,其原理如图3所示。阳极的电极反应式为_______ 。电解过程中得到的产物为_______ 。

 、
、 可通入碱液或利用电解池装置进行吸收处理。
可通入碱液或利用电解池装置进行吸收处理。Ⅰ. 常温下,
 是一种有特殊臭味、稳定性较差的淡蓝色气体。
是一种有特殊臭味、稳定性较差的淡蓝色气体。 氧化性强于
氧化性强于 ,能更有效地氧化
,能更有效地氧化 。
。(1)
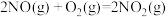


 (活化能
(活化能 )
)则


 (活化能
(活化能 )
)(2)为分析氧化时温度对
 脱除率的影响,将
脱除率的影响,将 与
与 混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,
混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时, 脱除率随
脱除率随 与
与 混合反应时温度变化如图1所示。温度在
混合反应时温度变化如图1所示。温度在 时,随着温度升高,
时,随着温度升高, 脱除率无明显变化;温度超过
脱除率无明显变化;温度超过 时,随着温度升高,
时,随着温度升高, 脱除率下降。其可能原因是
脱除率下降。其可能原因是
Ⅱ.一定条件下
 水溶液中可发生如下反应:
水溶液中可发生如下反应: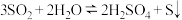 ,部分物质的物质的量的变化如图2所示。
,部分物质的物质的量的变化如图2所示。
(3)曲线
 表示
表示 时反应达到平衡状态,用
时反应达到平衡状态,用 表示反应的平均速率为
表示反应的平均速率为(4)下列不能说明
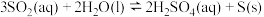 反应已达到平衡状态的是
反应已达到平衡状态的是A.

B. 绝热恒容时,反应的化学平衡常数不再变化
C. 恒温恒容时,混合溶液中硫酸的密度不再变化
D. 反应过程中,溶液中分子总数不再改变
Ⅲ. 若烟气主要成分为
 、
、 ,可通过电解法除去,其原理如图3所示。阳极的电极反应式为
,可通过电解法除去,其原理如图3所示。阳极的电极反应式为
您最近半年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题:
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.3 kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234 kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=179.5 kJ·mol-1
请写出CO和NO2生成N2、CO2的热化学方程式_________________________ 。
(2)亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g) 2C1NO(g),已知几种化学键的键能数据如下表(NO的结构为N≡O,亚硝酸氯的结构为Cl-N=O):
2C1NO(g),已知几种化学键的键能数据如下表(NO的结构为N≡O,亚硝酸氯的结构为Cl-N=O):
则2NO(g)+C12(g) 2C1NO(g)反应的ΔH和a的关系为ΔH=
2C1NO(g)反应的ΔH和a的关系为ΔH=________ kJ·mol-1。
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.3 kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234 kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=179.5 kJ·mol-1
请写出CO和NO2生成N2、CO2的热化学方程式
(2)亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)
 2C1NO(g),已知几种化学键的键能数据如下表(NO的结构为N≡O,亚硝酸氯的结构为Cl-N=O):
2C1NO(g),已知几种化学键的键能数据如下表(NO的结构为N≡O,亚硝酸氯的结构为Cl-N=O):| 化学键 | N≡O | Cl- Cl | Cl-N | N=O |
| 键能/kJ·mol-1 | 630 | 243 | a | 607 |
则2NO(g)+C12(g)
 2C1NO(g)反应的ΔH和a的关系为ΔH=
2C1NO(g)反应的ΔH和a的关系为ΔH=
您最近半年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__ 。
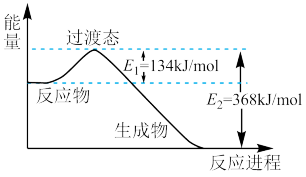
(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1molC2H2(g)反应的焓变:△H=__ 。

(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1molC2H2(g)反应的焓变:△H=
您最近半年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐1】按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式___________ 。
(2)已知在25℃、101 kPa下,10 g乙醇在氧气中充分燃烧生成二氧化碳和液态水释放出295 kJ的热量,试写出乙醇燃烧热的热化学方程式___________ 。
(3)制取甲胺的反应为CH3OH(g)+NH3(g)⇌CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如表:
则该反应的ΔH=___________ kJ·mol-1
(4)下列热化学方程式:Zn(s)+ O2(g)=ZnO(s) ∆H1=-351.1kJ/mol;Hg(l)+
O2(g)=ZnO(s) ∆H1=-351.1kJ/mol;Hg(l)+ O2(g)=HgO(s) ∆H2=-90.7 kJ/mol。由此可知:Zn(s)+HgO(s)=ZnO(s)+Hg(l) ∆H3=
O2(g)=HgO(s) ∆H2=-90.7 kJ/mol。由此可知:Zn(s)+HgO(s)=ZnO(s)+Hg(l) ∆H3=___________
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式
(2)已知在25℃、101 kPa下,10 g乙醇在氧气中充分燃烧生成二氧化碳和液态水释放出295 kJ的热量,试写出乙醇燃烧热的热化学方程式
(3)制取甲胺的反应为CH3OH(g)+NH3(g)⇌CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如表:
| 共价键 | C-O | H-O | N-H | C-N |
键能/kJ mol-1 mol-1 | 351 | 463 | 393 | 293 |
则该反应的ΔH=
(4)下列热化学方程式:Zn(s)+
 O2(g)=ZnO(s) ∆H1=-351.1kJ/mol;Hg(l)+
O2(g)=ZnO(s) ∆H1=-351.1kJ/mol;Hg(l)+ O2(g)=HgO(s) ∆H2=-90.7 kJ/mol。由此可知:Zn(s)+HgO(s)=ZnO(s)+Hg(l) ∆H3=
O2(g)=HgO(s) ∆H2=-90.7 kJ/mol。由此可知:Zn(s)+HgO(s)=ZnO(s)+Hg(l) ∆H3=
您最近半年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热化学方程式__________________________ .
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热化学方程式___________________ .
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+O2(g)=H2O(l) ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式_______________ .
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热化学方程式
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热化学方程式
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+O2(g)=H2O(l) ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式
您最近半年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐3】在恒压下化学反应所吸收或放出的热量,称为化学反应的焓变。回答下列问题:
(1)25℃、101 kPa时,1 g氨气完全燃烧放出18.6 kJ的热量,则4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H=______ kJ·mol-1。
(2)常压下,某铝热反应的温度与能量变化如图所示:
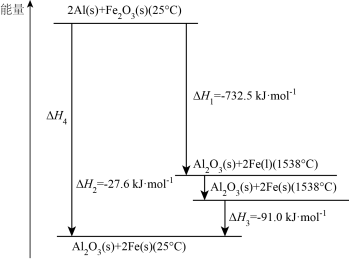
①常压、1538℃时,Fe(s)→Fe(l) △H=______ kJ·mol-1。
②常压、25℃时,该铝热反应的热化学方程式为__________ 。
(3)在稀溶液中酸与碱发生中和反应生成1 mol水时所释放的热量称为中和热。部分酸与碱反应的中和热如下表:
①I、IV的热化学方程式(用离子方程式形式表示)依次为_____ 、_____ 。
②I、II的△H相同,III、IV、V的△H比I、II大,其原因是__________ 。
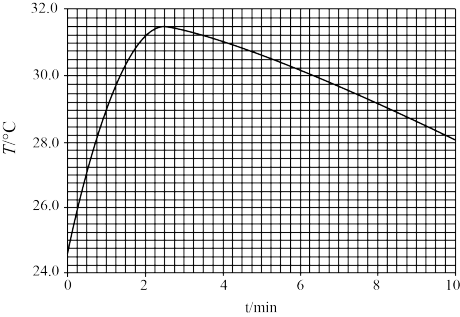
③体积和浓度均为25.0 mL 1.00 mol·L-1的硝酸和NaOH溶液(起始温度相同)混合时,测得混合溶液的温度与时间的关系如图所示,已知硝酸和NaOH溶液的密度均为1.00 g·mL-1,混合溶液的比热容为4.18 J·g-1·℃-1。由实验数据可计算出该反应的中和热△H为______ kJ·mol-1(结果保留1位小数)。
(1)25℃、101 kPa时,1 g氨气完全燃烧放出18.6 kJ的热量,则4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H=
(2)常压下,某铝热反应的温度与能量变化如图所示:

①常压、1538℃时,Fe(s)→Fe(l) △H=
②常压、25℃时,该铝热反应的热化学方程式为
(3)在稀溶液中酸与碱发生中和反应生成1 mol水时所释放的热量称为中和热。部分酸与碱反应的中和热如下表:
| 组别 | 酸与碱 | 中和热△H/(kJ/mol) |
| Ⅰ | HCl+NaOH | -57.1 |
| Ⅱ | HNO3+KOH | -57.1 |
| Ⅲ | CH3COOH+NaOH | -56.1 |
| Ⅳ | HCl+NH3·H2O | -53.4 |
| Ⅴ | CH3COOH+NH3·H2O | -50.4 |
②I、II的△H相同,III、IV、V的△H比I、II大,其原因是
③体积和浓度均为25.0 mL 1.00 mol·L-1的硝酸和NaOH溶液(起始温度相同)混合时,测得混合溶液的温度与时间的关系如图所示,已知硝酸和NaOH溶液的密度均为1.00 g·mL-1,混合溶液的比热容为4.18 J·g-1·℃-1。由实验数据可计算出该反应的中和热△H为

您最近半年使用:0次





