NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1mol·L-1NH4Al(SO4)2中c(NH )
)___ (填“等于”、“大于”或“小于”)0.1mol·L-1NH4HSO4中c(NH )。
)。
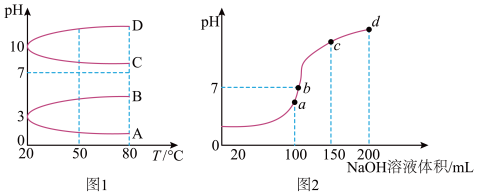
(2)如图1是0.1mol·L-1电解质溶液的pH随温度变化的图象。
①其中符合0.1mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是____ (填字母)。
②室温(20℃)时,0.1mol·L-1NH4Al(SO4)2中2c(SO )-c(NH
)-c(NH )-3c(Al3+)=
)-3c(Al3+)=___ mol·L-1(填数值表达式)。
(3)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。
试分析图中a、b、c、d四个点,水的电离程度最大的是____ ;在b点,溶液中各离子浓度由大到小的排列顺序是____ 。

(1)相同条件下,0.1mol·L-1NH4Al(SO4)2中c(NH
 )
) )。
)。(2)如图1是0.1mol·L-1电解质溶液的pH随温度变化的图象。
①其中符合0.1mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是
②室温(20℃)时,0.1mol·L-1NH4Al(SO4)2中2c(SO
 )-c(NH
)-c(NH )-3c(Al3+)=
)-3c(Al3+)=(3)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。
试分析图中a、b、c、d四个点,水的电离程度最大的是
更新时间:2020-12-23 16:27:27
|
【知识点】 盐类水解在解题方面的应用解读
相似题推荐
填空题
|
适中
(0.65)
【推荐1】现有下列几种物质:①CH3COONa ② NaClO ③ Na2CO3④ 明矾⑤ HCl⑥ Mg(OH)2,回答下列问题:
(1)已知相同条件下,同浓度的CH3COOH和HClO的pH前者小,则同浓度的①和②溶液的pH相比:①___ ②(填“>”“<”或“=”)
(2)写出③的溶液中电荷守恒关系式___ 。
(3)用离子方程式说明④能净水的原理___ 。
(4)常温下,0.1 mol/L HCl 溶液中,水电离出的c(OH-) =___ mol/L。
(5)向①的酚酞溶液中加入少量的NaCl固体,则溶液颜色__ (填“变深”“变浅”或“不变”)。向⑥的饱和溶液中加入少量的MgCl2固体,则⑥的Ksp____ (填“增大”“减小”或“不变”)。该溶液的pH___ (填“增大”“减小”或“不变”)。
(6)上述几种物质中,属于弱电解质的是___ (填序号)。
(1)已知相同条件下,同浓度的CH3COOH和HClO的pH前者小,则同浓度的①和②溶液的pH相比:①
(2)写出③的溶液中电荷守恒关系式
(3)用离子方程式说明④能净水的原理
(4)常温下,0.1 mol/L HCl 溶液中,水电离出的c(OH-) =
(5)向①的酚酞溶液中加入少量的NaCl固体,则溶液颜色
(6)上述几种物质中,属于弱电解质的是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】NH4A1(SO4)2和Na2CO3常作食品加工中的食品添加剂;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)纯碱(Na2CO3)溶液呈_____ (填“酸性”、“碱性”或“中性”),原因是__________ (用离子方程式说明)。
(2)均为0.1mol/L的几种电解质溶液的pH随温度变化的曲线如图甲所示。
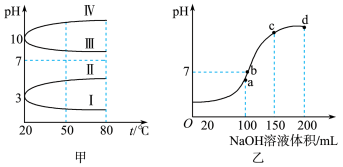
①其中符合0.1 mol/L Na2CO3溶液的pH随温度变化的曲线是_____ (填罗马数字),导致Na2CO3溶液的pH随温度变化的原因是__ 。
②20℃时(KW=1.0×10﹣14),0.1mol/L Na2CO3溶液中c(Na+)-2c(CO )-c(HCO
)-c(HCO )=
)=__ mol/L
(1)纯碱(Na2CO3)溶液呈
(2)均为0.1mol/L的几种电解质溶液的pH随温度变化的曲线如图甲所示。

①其中符合0.1 mol/L Na2CO3溶液的pH随温度变化的曲线是
②20℃时(KW=1.0×10﹣14),0.1mol/L Na2CO3溶液中c(Na+)-2c(CO
 )-c(HCO
)-c(HCO )=
)=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】水溶液中的离子平衡是中学学习的一个重要内容。
(1)甲同学用pH试纸分别测定了 0.1 mol/L NaOH溶液的pH=13、0.1 mol/LCH3COOH溶液的pH=3、0.001 mol/L HCl溶液的pH=3。请写出pH试纸使用方法:_____ 根据测量结果,甲推测等浓度的NaOH溶液、CH3COOH溶液中,由水电离出的H+浓度c(H+)NaOH____ c(H+)CH3COOH(填“大于”“小于”或“等于”)
(2)乙同学分别取了pH=3的CH3COOH溶液和HCl溶液各10mL,测量导电能力发现HCl溶液导电能力______________ CH3COOH溶液导电能力(填“大于”“小于”或“等于”)。然后分别加水稀释到100 mL后,再次测量,稀释后的HCl溶液导电能力______________ CH3COOH溶液导电能力(填“大于”“小于”或“等于”)
(3)丙同学查阅资料发现,人体血液里存在重要的酸碱平衡:CO2+H2O H2CO3
H2CO3 HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
①正常人体血液中,HCO3-的水解程度____ 电离程度(填“>”、“<”或“=”);
②人体血液酸中毒时,可注射________ (填选项)缓解;
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序___________
④已知25 ℃时,CO32-水解反应的平衡常数Kh=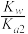 =
=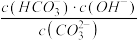 =2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,溶液的pH=
=2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,溶液的pH=________ ;
(4)丁同学探究难溶电解质在水溶液中的性质,查阅资料发现25 ℃时,AgCl的Ksp=1.8×10-10,该温度下向1 L 0.03 mol/L的AgNO3溶液中加入1 L 0.01 mol/L的NaCl溶液之后,溶液中c(Cl-)=______ mol/L(忽略混合前后溶液体积的变化)。平衡后,若向该体系中再加入少量AgCl固体,则c(Cl-)_____ (填“增大”或“减小”或“不变”)。
(1)甲同学用pH试纸分别测定了 0.1 mol/L NaOH溶液的pH=13、0.1 mol/LCH3COOH溶液的pH=3、0.001 mol/L HCl溶液的pH=3。请写出pH试纸使用方法:
(2)乙同学分别取了pH=3的CH3COOH溶液和HCl溶液各10mL,测量导电能力发现HCl溶液导电能力
(3)丙同学查阅资料发现,人体血液里存在重要的酸碱平衡:CO2+H2O
 H2CO3
H2CO3 HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:| c(HCO3-) ∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
②人体血液酸中毒时,可注射
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序
④已知25 ℃时,CO32-水解反应的平衡常数Kh=
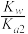 =
=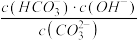 =2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,溶液的pH=
=2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,溶液的pH=(4)丁同学探究难溶电解质在水溶液中的性质,查阅资料发现25 ℃时,AgCl的Ksp=1.8×10-10,该温度下向1 L 0.03 mol/L的AgNO3溶液中加入1 L 0.01 mol/L的NaCl溶液之后,溶液中c(Cl-)=
您最近一年使用:0次



