元素周期表前四周期的元素a、b、c、d、e、f的原子序数依次增大。元素e的基态原子的3d轨道上有2个电子,a、c的基态原子中都有2个未成对电子,d与c同主族,f原子最外层只有1个电子,次外层的所有原子轨道均充满电子。请回答下列问题:
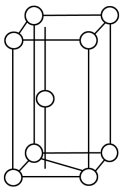
(1)元素e在元素周期表中的位置为________ ;e的单质的晶胞如图所示,该晶胞的堆积方式为________ 堆积。
(2)基态原子未成对电子数与b相同的前四周期元素中,除了与b同主族的元素外,还有________ 元素(填元素符号)。
(3)共价分子(ab)2中所有原子均满足8电子稳定结构,则(ab)2中π键与σ键个数之比为________ 。
(4)ec2常用作白色颜料,纳米ec2也可作催化剂,实例如图所示。

①化合物M的熔沸点明显低于化合物N,其主要原因是_____________________ 。
②化合物N中C原子的杂化类型为________ ,元素C、N、O的第一电离能由小到大的顺序为___________ 。
(5)e元素的主要化合价是+2、+4。某晶体中的阳离子是由c、e两元素形成的链状聚合形式的离子,结构如图所示。该阳离子中c、e两原子个数比为________ 。

(6)d和f能形成化合物Q,其晶胞结构及晶胞参数如图4所示。已知阿伏加德罗常数的值为NA,则Q的密度为________ g·cm-3(用含a、b、c、NA的代数式表示)。

(1)元素e在元素周期表中的位置为

(2)基态原子未成对电子数与b相同的前四周期元素中,除了与b同主族的元素外,还有
(3)共价分子(ab)2中所有原子均满足8电子稳定结构,则(ab)2中π键与σ键个数之比为
(4)ec2常用作白色颜料,纳米ec2也可作催化剂,实例如图所示。

①化合物M的熔沸点明显低于化合物N,其主要原因是
②化合物N中C原子的杂化类型为
(5)e元素的主要化合价是+2、+4。某晶体中的阳离子是由c、e两元素形成的链状聚合形式的离子,结构如图所示。该阳离子中c、e两原子个数比为

(6)d和f能形成化合物Q,其晶胞结构及晶胞参数如图4所示。已知阿伏加德罗常数的值为NA,则Q的密度为

20-21高三上·四川成都·阶段练习 查看更多[3]
山西省潞城第一中学2020-2021学年高二下学期3月月考化学试卷题(已下线)大题09 物质结构与性质(二)(选修)-【考前抓大题】备战2021年高考化学(全国通用)四川师范大学附属中学2021届高三12月月考理综化学试题
更新时间:2020-12-24 11:02:21
|
【知识点】 物质结构与性质综合考查解读
相似题推荐
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】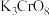 、
、 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题:
(1)基态Cr原子的未成对电子数为________________ 。
(2)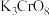 的结构如图所示。
的结构如图所示。
①下列有关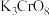 的说法正确的是
的说法正确的是__________ (填标号)。
A.含离子键、σ键 B.含离子键、σ键和π键
C.氧原子与中心原子间形成配位键 D.铬显+10价
②已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,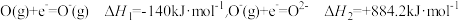 。氧的第一电子亲和能E1为
。氧的第一电子亲和能E1为__________ kJ/mol;△H2>0,其原因是_____________________________________ 。
(3)雷氏盐的化学式为 。
。
①H、C、N、O四种元素的电负性由大到小的顺序为__________________ 。
②其阳离子的中心原子的杂化方式为_________________ ,配体之一NH3分子的立体构型为______ 。
③与配体NCSˉ互为等电子体的阴离子有 等,分子有
等,分子有_____________________ (写1种);画出 的结构式:
的结构式:_____________________________ 。
(4)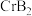 的晶体密度为
的晶体密度为 ,晶体结构(如下图)为六棱柱,底边边长为
,晶体结构(如下图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加 德罗常数的值为NA,则a2c=
,设阿伏加 德罗常数的值为NA,则a2c=_______________ (列出计算式)。
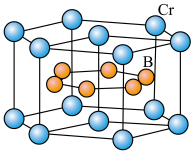
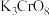 、
、 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题:
(1)基态Cr原子的未成对电子数为
(2)
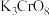 的结构如图所示。
的结构如图所示。①下列有关
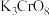 的说法正确的是
的说法正确的是A.含离子键、σ键 B.含离子键、σ键和π键
C.氧原子与中心原子间形成配位键 D.铬显+10价
②已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,
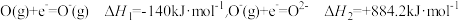 。氧的第一电子亲和能E1为
。氧的第一电子亲和能E1为(3)雷氏盐的化学式为
 。
。①H、C、N、O四种元素的电负性由大到小的顺序为
②其阳离子的中心原子的杂化方式为
③与配体NCSˉ互为等电子体的阴离子有
 等,分子有
等,分子有 的结构式:
的结构式:(4)
 的晶体密度为
的晶体密度为 ,晶体结构(如下图)为六棱柱,底边边长为
,晶体结构(如下图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加 德罗常数的值为NA,则a2c=
,设阿伏加 德罗常数的值为NA,则a2c=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】【物质结构与性质】
硅电池、锂离子电池都是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(l) LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与 的结构密切相关,
的结构密切相关, 的立体构型为
的立体构型为____ 。P、O、S的电负性从大到小的顺序为______________
(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸(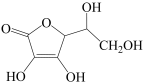 )常被用作碳包覆的碳源,其易溶于水的原因是
)常被用作碳包覆的碳源,其易溶于水的原因是 ___ ,抗坏血酸中碳原子的杂化方式为 ___ ,1mol抗坏血酸中手性碳原子的数目为______ 。(取材于选修3课本51页)。
(3) Li+过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是____ (填标号)。
A.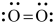 B.
B.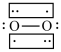 C.
C.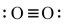 D.
D.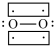
(4)目前最常用的电极材料有锂钴复合氧化物和石墨。
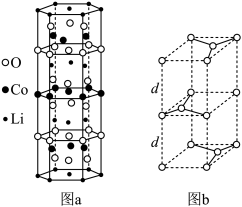
①锂钴复合氧化物中Li、Co、O分别形成了六边层状结构(图a),按照Li-O-Co-O-Li–O-Co-O- Li--顺序排列,则该化合物的化学式为____ ,Co3+的价层电子排布式为_____ 。
②石墨晶胞(图b)层间距为d pm,C—C键长为a pm,石墨晶体的密度为p g/cm3,列式表示阿伏加 德罗常数为____ mol-l。
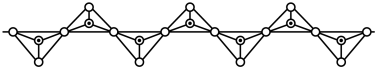
(5)硅酸盐中Si元素一般显+4价,如下图所示是一种无限长单键的多聚硅酸根离子的结构,其中“ ”表示Si原子,“
”表示Si原子,“ ”表示氧原子,则该长链硅酸根离子的通式为
”表示氧原子,则该长链硅酸根离子的通式为________________________ 。
硅电池、锂离子电池都是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(l) LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与
 的结构密切相关,
的结构密切相关, 的立体构型为
的立体构型为(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸(
 )常被用作碳包覆的碳源,其易溶于水的原因是
)常被用作碳包覆的碳源,其易溶于水的原因是 (3) Li+过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是
A.
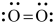 B.
B. C.
C.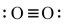 D.
D.
(4)目前最常用的电极材料有锂钴复合氧化物和石墨。
①锂钴复合氧化物中Li、Co、O分别形成了六边层状结构(图a),按照Li-O-Co-O-Li–O-Co-O- Li--顺序排列,则该化合物的化学式为
②石墨晶胞(图b)层间距为d pm,C—C键长为a pm,石墨晶体的密度为p g/cm3,列式表示阿伏加 德罗常数为

(5)硅酸盐中Si元素一般显+4价,如下图所示是一种无限长单键的多聚硅酸根离子的结构,其中“
 ”表示Si原子,“
”表示Si原子,“ ”表示氧原子,则该长链硅酸根离子的通式为
”表示氧原子,则该长链硅酸根离子的通式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】在稀土开采技术方面,我国遥遥领先,无论是美国的芒廷帕斯还是澳大利亚的稀土矿山,均为在我国技术的参与下才实现产出。我国科学家最早研究的是稀土—钴化合物的结构。请回答下列问题:
(1)钴原子的价层电子的电子排布式为___________ ,Co4+中存在___________ 种不同能级的电子。
(2)Co3+在水中易被还原成 Co2+,而在氨水中可稳定存在,其原因为___________ 。
(3)一种钴的配合物乙二胺四乙酸合钴的结构为 ,1mol 该配合物形成的配位键有
,1mol 该配合物形成的配位键有___________ mol,配位原子是___________ ,碳原子的杂化类型有___________ 。
(4)钴蓝晶胞结构如下图所示,该立方晶胞由4个I型和4个型小立方体构成,其化学式为___________ ,晶体中Al3+占据O2-形成的___________ (填 “四面体空隙”或 “八面体空隙”)。NA为阿伏加德罗常数的值,钴蓝晶体的密度为___________ g·cm-3(列计算式;1nm=10-9m)。

(1)钴原子的价层电子的电子排布式为
(2)Co3+在水中易被还原成 Co2+,而在氨水中可稳定存在,其原因为
(3)一种钴的配合物乙二胺四乙酸合钴的结构为
 ,1mol 该配合物形成的配位键有
,1mol 该配合物形成的配位键有(4)钴蓝晶胞结构如下图所示,该立方晶胞由4个I型和4个型小立方体构成,其化学式为

您最近一年使用:0次



