(1)已知C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1则0.5 mol丙烷完全燃烧释放的热量为___________ kJ。
(2)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1,2C(s)+O2(g)= 2CO(g) ΔH=-221 kJ·mol-1,写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:___________
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似,化学性质比较活泼。已知断裂1 mol N—N键吸收193 kJ热量,断裂1mol N≡N键吸收941 kJ热量,断裂1 mol N—H键吸收391 kJ热量,断裂1 mol H—H键吸收436 kJ热量,则:
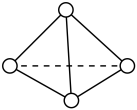
①1 mol N4气体转化为2 mol N2时要放出___________ kJ能量。
②写出N4与H2反应生成NH3的热化学方程式:___________ 。
(4)已知:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1。下列反应中能放出57.3 kJ热量的是__________ 。
a.1 L 1 mol·L-1的稀H2SO4与足量NaOH溶液反应
b.稀盐酸与氨水反应生成1 mol H2O
c.稀盐酸与稀Ba(OH)2溶液反应生成1 mol 水
d.稀NaOH与95%浓硫酸反应生成1 mol 水
(2)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1,2C(s)+O2(g)= 2CO(g) ΔH=-221 kJ·mol-1,写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似,化学性质比较活泼。已知断裂1 mol N—N键吸收193 kJ热量,断裂1mol N≡N键吸收941 kJ热量,断裂1 mol N—H键吸收391 kJ热量,断裂1 mol H—H键吸收436 kJ热量,则:

①1 mol N4气体转化为2 mol N2时要放出
②写出N4与H2反应生成NH3的热化学方程式:
(4)已知:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1。下列反应中能放出57.3 kJ热量的是
a.1 L 1 mol·L-1的稀H2SO4与足量NaOH溶液反应
b.稀盐酸与氨水反应生成1 mol H2O
c.稀盐酸与稀Ba(OH)2溶液反应生成1 mol 水
d.稀NaOH与95%浓硫酸反应生成1 mol 水
更新时间:2021/01/13 15:19:52
|
相似题推荐
计算题
|
适中
(0.65)
名校
解题方法
【推荐1】化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是______ (填字母)。
A.Na2O与水反应 B.甲烷的燃烧反应C.CaCO3受热分解 D.锌与盐酸反应
(2)获取能量变化的途径① 通过化学键的键能计算。已知:
计算可得:2H2(g)+ O2(g) =2H2O(g) ∆H=____________ kJ·mol-1
②通过盖斯定律可计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+ O2(g) =Na2O(s)△H=-414kJ·mol-1
O2(g) =Na2O(s)△H=-414kJ·mol-1
Ⅱ.2Na(s)+O2(g) =Na2O2(s)△H=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式__________ 。
③ 利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50 mL 0.50 mol·L-1的盐酸,则还需加入________ (填序号)。
A.50 mL 0.50 mol·L-1NaOH溶液B.50 mL 0.55 mol·L-1NaOH溶液 C.1.0 g NaOH固体
(1)下列反应中,属于吸热反应的是
A.Na2O与水反应 B.甲烷的燃烧反应C.CaCO3受热分解 D.锌与盐酸反应
(2)获取能量变化的途径① 通过化学键的键能计算。已知:
| 化学键种类 | H—H | O=O | O—H |
| 键能(kJ/mol) | 436 | 498 | 463.4 |
计算可得:2H2(g)+ O2(g) =2H2O(g) ∆H=
②通过盖斯定律可计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+
 O2(g) =Na2O(s)△H=-414kJ·mol-1
O2(g) =Na2O(s)△H=-414kJ·mol-1Ⅱ.2Na(s)+O2(g) =Na2O2(s)△H=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式
③ 利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50 mL 0.50 mol·L-1的盐酸,则还需加入
A.50 mL 0.50 mol·L-1NaOH溶液B.50 mL 0.55 mol·L-1NaOH溶液 C.1.0 g NaOH固体
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐2】依据题中所给信息完成指定问题:
(1)地康法制氯气可按下列催化过程进行:
CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=+83 kJ·mol-1
Cl2(g) ΔH1=+83 kJ·mol-1
CuCl(s)+ O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则反应4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=________ kJ·mol-1。
(2)用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH溶液反应测定中和热,实验中测得起始平均温度为20.4℃,反应后最高温度为23.4 ℃,反应后溶液的比热容为4.2 J·g-1·℃-1,盐酸和NaOH溶液的密度都近似认为是1 g·cm-3,则中和热ΔH=________ ;
(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下16 g SiH4自燃放出热量750 kJ。SiH4自燃的热化学方程式为___________ 。
(1)地康法制氯气可按下列催化过程进行:
CuCl2(s)=CuCl(s)+
 Cl2(g) ΔH1=+83 kJ·mol-1
Cl2(g) ΔH1=+83 kJ·mol-1CuCl(s)+
 O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则反应4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=
(2)用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH溶液反应测定中和热,实验中测得起始平均温度为20.4℃,反应后最高温度为23.4 ℃,反应后溶液的比热容为4.2 J·g-1·℃-1,盐酸和NaOH溶液的密度都近似认为是1 g·cm-3,则中和热ΔH=
(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下16 g SiH4自燃放出热量750 kJ。SiH4自燃的热化学方程式为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
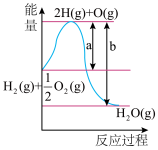
【推荐3】(1)已知:1molH2燃烧反应过程中能量变化如图,且H2O(g)=H2O(l)ΔH=-ckJ·mol-1,请写出H2燃烧热的热化学方程式:___ 。
(2)如果向100mL0.4mol·L-1的稀盐酸中加入足量氢氧化钡溶液充分反应后,放出2.2kJ的热量,请写出稀盐酸与氢氧化钡溶液中和热的热化学方程式:___ 。
(3)利用CO和H2在催化剂的作用下合成甲醇,反应如下:CO(g)+2H2(g) CH3OH(g)△H
CH3OH(g)△H
已知反应中的相关的化学键键能数据如下:
由此计算△H=___ kJ•mol-1。
(4)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-akJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-bkJ·mol-1(b>0)
若用标准状况下3.36LNO2氧化CO至CO2(NO2完全反应生成N2)的整个过程中转移电子的物质的量为__ mol,放出的热量为__ kJ(用含有a和b的代数式表示)。

(2)如果向100mL0.4mol·L-1的稀盐酸中加入足量氢氧化钡溶液充分反应后,放出2.2kJ的热量,请写出稀盐酸与氢氧化钡溶液中和热的热化学方程式:
(3)利用CO和H2在催化剂的作用下合成甲醇,反应如下:CO(g)+2H2(g)
 CH3OH(g)△H
CH3OH(g)△H已知反应中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | CO | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H=
(4)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-akJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-bkJ·mol-1(b>0)
若用标准状况下3.36LNO2氧化CO至CO2(NO2完全反应生成N2)的整个过程中转移电子的物质的量为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐1】利用如图所示装置测定中和热的实验步骤如下:
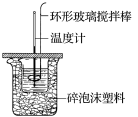
①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为_____ 。
(2)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热ΔH=________ (结果保留一位小数)。
(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2gSiH4自燃放出热量89.2kJ。SiH4自燃的热化学方程式为___________ 。
(4)标准摩尔生成焓是指在25℃和101kPa时,最稳定的单质生成1mol化合物的焓变。已知25℃和101kPa时下列反应:
①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ΔH=-3116kJ·mol-1
②C(石墨,s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
写出乙烷标准摩尔生成焓的热化学方程式:___________ 。

①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为
(2)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=
(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2gSiH4自燃放出热量89.2kJ。SiH4自燃的热化学方程式为
(4)标准摩尔生成焓是指在25℃和101kPa时,最稳定的单质生成1mol化合物的焓变。已知25℃和101kPa时下列反应:
①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ΔH=-3116kJ·mol-1
②C(石墨,s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
写出乙烷标准摩尔生成焓的热化学方程式:
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐2】苯乙烯(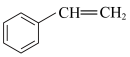 )常用来合成橡胶,还广泛应用于制药、染料、农药等行业,是石化行业的重要基础原料,苯乙烯与各物质之间反应的能量变化如下:
)常用来合成橡胶,还广泛应用于制药、染料、农药等行业,是石化行业的重要基础原料,苯乙烯与各物质之间反应的能量变化如下:
I.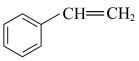



II.

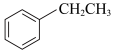
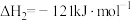
III.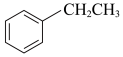


IV.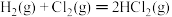

回答下列问题:
(1)①根据上述反应计算得△H3=___________ kJ/mol。
②设NA为阿伏加德罗常数的值。反应II每生成5.3 g苯乙烷,放出的热量为___________ kJ,转移的电子数为___________ NA。
(2)相关化学键的键能数据如下表所示。
①x=___________ 。
②完全燃烧5.2 g苯乙烯,消耗氧气___________ mol。
 )常用来合成橡胶,还广泛应用于制药、染料、农药等行业,是石化行业的重要基础原料,苯乙烯与各物质之间反应的能量变化如下:
)常用来合成橡胶,还广泛应用于制药、染料、农药等行业,是石化行业的重要基础原料,苯乙烯与各物质之间反应的能量变化如下:I.




II.



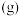
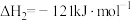
III.



IV.
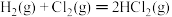

回答下列问题:
(1)①根据上述反应计算得△H3=
②设NA为阿伏加德罗常数的值。反应II每生成5.3 g苯乙烷,放出的热量为
(2)相关化学键的键能数据如下表所示。
| 化学键 | Cl-Cl | H-Cl | H-H |
| 键能/(kJ/mol) | 243 | x | 436 |
②完全燃烧5.2 g苯乙烯,消耗氧气
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐3】(1)已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态时,含有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如图所示:
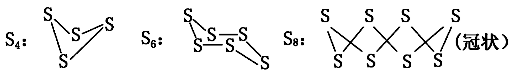
①在一定温度下,测得硫蒸气的平均摩尔质量为80 g·mol-1,则该蒸气中S2分子的体积分数不小于_______ 。
②若已知硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,S(s)+O2(g)===SO2(g) ΔH=-a kJ·mol-1,则S8分子硫硫键的键能为________ 。
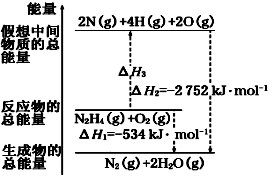
(2)肼(H2N—NH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O===O为500、N—N为154,则断裂1 mol N—H键所需的能量是_____________ kJ
(3)如表所示是某些物质的燃烧热数据:
①煤油的组成可看作C12H26,煤油燃烧生成液态水时的热化学方程式为________________ 。
②由上表中的数据_____ (填“能”或“不能”)计算出反应:C2H4(g)+H2(g)―→C2H6(g)的反应热。若能,该反应△H= _____ (若不能,此空不填);若不能,原因是 (若能, 此空不填)。

①在一定温度下,测得硫蒸气的平均摩尔质量为80 g·mol-1,则该蒸气中S2分子的体积分数不小于
②若已知硫氧键的键能为d kJ·mol-1,氧氧键的键能为e kJ·mol-1,S(s)+O2(g)===SO2(g) ΔH=-a kJ·mol-1,则S8分子硫硫键的键能为
(2)肼(H2N—NH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O===O为500、N—N为154,则断裂1 mol N—H键所需的能量是

(3)如表所示是某些物质的燃烧热数据:
| 物质 | C(s) | H2(g) | C2H4(g) | C2H6(g) | C3H8(g) | C12H26(l) |
| ΔH/ kJ·mol-1 | -393.5 | -285.8 | -1 411.0 | -1 559.8 | -2 219.9 | -8 571.4 |
①煤油的组成可看作C12H26,煤油燃烧生成液态水时的热化学方程式为
②由上表中的数据
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】按要求书写热化学方程式:
(1)已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式_________________________
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)ΔH1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g)ΔH2=-393.5kJ/mol
③H2(g)+ O2(g)=H2O(l)ΔH3=-285.8kJ/mol
O2(g)=H2O(l)ΔH3=-285.8kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式________________
(4)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
(1)已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)ΔH1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g)ΔH2=-393.5kJ/mol
③H2(g)+
 O2(g)=H2O(l)ΔH3=-285.8kJ/mol
O2(g)=H2O(l)ΔH3=-285.8kJ/mol写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式
(4)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】合成氨工业中,每生产2molNH3,放出92.4kJ热量。
(1)写出合成氨反应的热化学方程式为_______________ 。
(2)已知:

1mol N-H键断裂吸收的能量等于______ kJ。
(3)已知关于铁的氧化物存在下列三个热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol ①
Fe2O3(s)+ CO(g)=
CO(g)=  Fe3O4(s)+
Fe3O4(s)+ CO2(g) ΔH=-15.73 kJ/mol ②
CO2(g) ΔH=-15.73 kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol ③
则CO还原FeO的热化学方程式为CO(g)+FeO(s)===Fe(s)+CO2(g) ΔH=________ kJ/mol。
(1)写出合成氨反应的热化学方程式为
(2)已知:

1mol N-H键断裂吸收的能量等于
(3)已知关于铁的氧化物存在下列三个热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol ①
Fe2O3(s)+
 CO(g)=
CO(g)=  Fe3O4(s)+
Fe3O4(s)+ CO2(g) ΔH=-15.73 kJ/mol ②
CO2(g) ΔH=-15.73 kJ/mol ② Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol ③
则CO还原FeO的热化学方程式为CO(g)+FeO(s)===Fe(s)+CO2(g) ΔH=
您最近一年使用:0次

 是一种温室气体,其存储能量的能力是
是一种温室气体,其存储能量的能力是 的12000~20000倍。表中是几种化学键的键能:
的12000~20000倍。表中是几种化学键的键能:


 )
) 和
和 制备
制备

