重氮化合物是一类活泼的化合物,在有机合成方面有着重要应用。重氮化合物A在光照及甲醇参与反应的条件下经过一系列活泼中间体转化为F的路线如下:

回答下列问题:
(1)为研究反应历程,A中的一碳原子用13C标记,这种研究方法称为_______ 。
(2)B1中的一个碳原子含有未共用电子对,易与B2相互转化或转化为C,B2的官能团名称为_______ ;上述路线中与B1、B2互为同分异构体的是_______ (填标号);核磁共振氢谱、核磁共振碳谱都常用于分析有机化合物的结构,B1或B2的核磁共振碳谱有_______ 种碳原子的吸收峰。
(3)从结果上看,C和CH3OH生成E的反应类型为_______ ;写出CH2=C=O与CH3CH2OH反应的化学方程式_______ (不要求写出中间体)。
(4)E不稳定,能自发转化为F,说明稳定性C=O_______ C=C(填“大于”“小于”或“等于”),理由是_______ (从化学键的角度说明)。
(5)X、Y是二十多年前才发现的两种生物碱,在室温下可相互转化:

含N+的中间体的结构简式为_______ ;平衡时X、Y的物质的量之比n(X):n(Y)=3:2,则X转化为Y的平衡转化率为_______ 。

回答下列问题:
(1)为研究反应历程,A中的一碳原子用13C标记,这种研究方法称为
(2)B1中的一个碳原子含有未共用电子对,易与B2相互转化或转化为C,B2的官能团名称为
(3)从结果上看,C和CH3OH生成E的反应类型为
(4)E不稳定,能自发转化为F,说明稳定性C=O
(5)X、Y是二十多年前才发现的两种生物碱,在室温下可相互转化:

含N+的中间体的结构简式为
更新时间:2021-03-04 13:36:26
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】对化学反应原理的研究能让我们更加深刻地认识化学反应,也是化学中最有魅力和挑战性的领域,依据所学的化学反应原理知识和题干信息回答下列问题:
I.面对气候变化,我国承诺二氧化碳排放力争2030年前达到峰值,力争2060年前实现碳中和。“碳达峰、碳中和”目标下,必须加强对二氧化碳资源开发利用的研究。
(1)往容积为2L的恒容密闭容器中通入2mol 和6mol
和6mol ,一定温度下发生反应:
,一定温度下发生反应: ,20min时达到化学平衡状态,测得水蒸气的物质的量为2mol,前20min内,用
,20min时达到化学平衡状态,测得水蒸气的物质的量为2mol,前20min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为___________  ,
, 的平衡转化率
的平衡转化率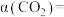
___________ %(保留一位小数)。[注:转化率等于反应物消耗的物质的量与反应物初始的物质的量之比。]
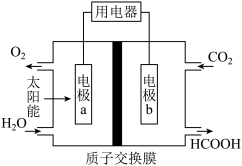
(2)一种 电化学制甲酸的装置如图所示,电极a为
电化学制甲酸的装置如图所示,电极a为___________ 极(填“正”或“负”),写出电极b的电极反应式___________ 。
II.催化剂的研究是化学反应原理中一个重要领域,催化剂往往是化学工业过程和技术改造更新的关键。化学反应中的活化能会显著影响化学反应速率,活化能越低,化学反应速率越快。催化剂能加快化学反应速率是因为它能改变反应的路径,降低反应的活化能。
(3) 与
与 经催化重整,制得合成气:
经催化重整,制得合成气: 。反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
。反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
由上表判断,催化剂X______ Y(填“优于”或“劣于”),理由是_____ 。
(4)催化剂的存在会显著地加快 的分解,某兴趣小组研究
的分解,某兴趣小组研究 催化分解
催化分解 历程如下:
历程如下:
第一步: (慢反应)
(慢反应)
第二步:______(快反应)
反应的活化能较大的为第___________ 步(填“一”或“二”),第二步反应的离子方程式为___________ 。
I.面对气候变化,我国承诺二氧化碳排放力争2030年前达到峰值,力争2060年前实现碳中和。“碳达峰、碳中和”目标下,必须加强对二氧化碳资源开发利用的研究。
(1)往容积为2L的恒容密闭容器中通入2mol
 和6mol
和6mol ,一定温度下发生反应:
,一定温度下发生反应: ,20min时达到化学平衡状态,测得水蒸气的物质的量为2mol,前20min内,用
,20min时达到化学平衡状态,测得水蒸气的物质的量为2mol,前20min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为 ,
, 的平衡转化率
的平衡转化率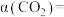
(2)一种
 电化学制甲酸的装置如图所示,电极a为
电化学制甲酸的装置如图所示,电极a为
II.催化剂的研究是化学反应原理中一个重要领域,催化剂往往是化学工业过程和技术改造更新的关键。化学反应中的活化能会显著影响化学反应速率,活化能越低,化学反应速率越快。催化剂能加快化学反应速率是因为它能改变反应的路径,降低反应的活化能。
(3)
 与
与 经催化重整,制得合成气:
经催化重整,制得合成气: 。反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
。反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:积碳反应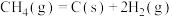 | 消碳反应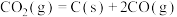 | ||
活性能/ | 催化剂X | 33 | 91 |
| 催化剂Y | 43 | 72 | |
(4)催化剂的存在会显著地加快
 的分解,某兴趣小组研究
的分解,某兴趣小组研究 催化分解
催化分解 历程如下:
历程如下:第一步:
 (慢反应)
(慢反应)第二步:______(快反应)
反应的活化能较大的为第
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】研发二氧化碳利用技术,已成为世界科学领域研究的热点。请回答下列问题:
Ⅰ.二氧化碳催化加氢制甲醇,不仅有利于降低空气中二氧化碳含量,同时可以制备清洁能源,其总反应可表示为: 。
。
(1)一定温度下,此反应的反应历程与体系能量变化关系如图1所示,则第二步反应的热化学方程式为_______ 。

(2)第一步反应的正反应速率方程为 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中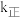 、
、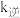 分别为正、逆反应的速率常数,只受温度影响。
分别为正、逆反应的速率常数,只受温度影响。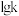 与
与 (温度的倒数)的关系如图2所示,①、②、③、④四条斜线中,表示
(温度的倒数)的关系如图2所示,①、②、③、④四条斜线中,表示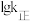 的是
的是_______ 。图中A、B、C、D点的纵坐标分别为a+2、a+1、a-1、a-2,则温度为 时,第一步反应的化学平衡常数
时,第一步反应的化学平衡常数
_______ 。

(3)总反应在起始物质的量 时,不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在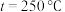 时
时 随压强(P)的变化及在
随压强(P)的变化及在 时
时 随温度(t)的变化如图所示。
随温度(t)的变化如图所示。

①图中对应等温过程的曲线是_______ (填“a”或“b”),判断的理由是_______ 。
②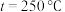 时,当
时,当 时,
时, 的平衡转化率为
的平衡转化率为_______  (保留小数点后一位)。
(保留小数点后一位)。
Ⅱ.我国科学家以Bi为电极,在酸性水溶液中实现电催化还原,两种途径的反应机理如图所示,其中 表示过渡态、数字表示微粒的相对总能量。
表示过渡态、数字表示微粒的相对总能量。

(4)途径一, 电还原经两步反应生成
电还原经两步反应生成 :第一步为
:第一步为 (*表示微粒与
(*表示微粒与 的接触位点):第二步为
的接触位点):第二步为_______ 。
(5) 电还原的选择性以途径一为主,理由是
电还原的选择性以途径一为主,理由是_______ 。
Ⅰ.二氧化碳催化加氢制甲醇,不仅有利于降低空气中二氧化碳含量,同时可以制备清洁能源,其总反应可表示为:
 。
。(1)一定温度下,此反应的反应历程与体系能量变化关系如图1所示,则第二步反应的热化学方程式为

(2)第一步反应的正反应速率方程为
 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中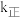 、
、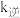 分别为正、逆反应的速率常数,只受温度影响。
分别为正、逆反应的速率常数,只受温度影响。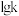 与
与 (温度的倒数)的关系如图2所示,①、②、③、④四条斜线中,表示
(温度的倒数)的关系如图2所示,①、②、③、④四条斜线中,表示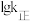 的是
的是 时,第一步反应的化学平衡常数
时,第一步反应的化学平衡常数

(3)总反应在起始物质的量
 时,不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在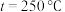 时
时 随压强(P)的变化及在
随压强(P)的变化及在 时
时 随温度(t)的变化如图所示。
随温度(t)的变化如图所示。
①图中对应等温过程的曲线是
②
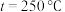 时,当
时,当 时,
时, 的平衡转化率为
的平衡转化率为 (保留小数点后一位)。
(保留小数点后一位)。Ⅱ.我国科学家以Bi为电极,在酸性水溶液中实现电催化还原,两种途径的反应机理如图所示,其中
 表示过渡态、数字表示微粒的相对总能量。
表示过渡态、数字表示微粒的相对总能量。
(4)途径一,
 电还原经两步反应生成
电还原经两步反应生成 :第一步为
:第一步为 (*表示微粒与
(*表示微粒与 的接触位点):第二步为
的接触位点):第二步为(5)
 电还原的选择性以途径一为主,理由是
电还原的选择性以途径一为主,理由是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】 催化加氢可合成二甲醚,发生的主要反应有:
催化加氢可合成二甲醚,发生的主要反应有:
反应Ⅰ:
 kJ•mol
kJ•mol
反应Ⅱ:
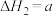 kJ⋅mol
kJ⋅mol
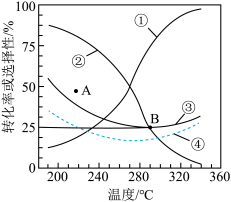
向恒压密闭容器中充入1mol 和3mol
和3mol ,若仅考虑上述反应,平衡时
,若仅考虑上述反应,平衡时 的选择性、CO的选择性和
的选择性、CO的选择性和 的转化率随温度的变化如图中实线所示。
的转化率随温度的变化如图中实线所示。
[ 的选择性
的选择性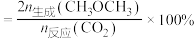 ]
]
(1)图中曲线___________ 表示平衡时CO的选择性。
(2)反应Ⅱ的热化学方程式中a___________ 0(选填>、<或=)。
(3)在175~300℃范围内,随着温度的升高,平衡时 的选择性如图所示变化的原因是
的选择性如图所示变化的原因是___________ 。
(4)温度高于300℃,随着温度的升高, 的平衡转化率如图所示变化的原因是
的平衡转化率如图所示变化的原因是___________ 。
(5)平衡时 的转化率随温度的变化
的转化率随温度的变化___________ (填“可能”或“不可能”)如图中虚线④所示。
(6)220℃时,在催化剂作用下 与H₂反应一段时间后,测得
与H₂反应一段时间后,测得 的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高
的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高 选择性的措施有
选择性的措施有___________ 。
(7)反应状态达B点时,容器中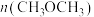 为
为___________ mol。
 催化加氢可合成二甲醚,发生的主要反应有:
催化加氢可合成二甲醚,发生的主要反应有:反应Ⅰ:

 kJ•mol
kJ•mol
反应Ⅱ:

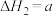 kJ⋅mol
kJ⋅mol
向恒压密闭容器中充入1mol
 和3mol
和3mol ,若仅考虑上述反应,平衡时
,若仅考虑上述反应,平衡时 的选择性、CO的选择性和
的选择性、CO的选择性和 的转化率随温度的变化如图中实线所示。
的转化率随温度的变化如图中实线所示。
[
 的选择性
的选择性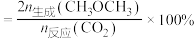 ]
](1)图中曲线
(2)反应Ⅱ的热化学方程式中a
(3)在175~300℃范围内,随着温度的升高,平衡时
 的选择性如图所示变化的原因是
的选择性如图所示变化的原因是(4)温度高于300℃,随着温度的升高,
 的平衡转化率如图所示变化的原因是
的平衡转化率如图所示变化的原因是(5)平衡时
 的转化率随温度的变化
的转化率随温度的变化(6)220℃时,在催化剂作用下
 与H₂反应一段时间后,测得
与H₂反应一段时间后,测得 的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高
的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高 选择性的措施有
选择性的措施有(7)反应状态达B点时,容器中
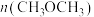 为
为
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
解题方法
【推荐1】某芳香族化合物A的结构简式是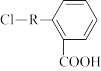 (其中R为饱和烃基),A在一定条件下有如下图所示的转化关系。已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2。
(其中R为饱和烃基),A在一定条件下有如下图所示的转化关系。已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2。
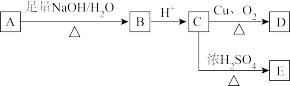
(1)E的分子式是_______ 。
(2)关于上述各步转化中,下列说法正确的是_______ 。
a.以上各步没有涉及加成反应
b.E比C的相对分子质量小18
c.A、B、C、D中都含有—COOH
d.A与C发生酯化反应后得到的有机物分子式可能是C18H18O4Cl
(3)写出所有符合下列要求的E的同分异构体的结构简式:_______
①分子中苯环上有三个取代基,且苯环上的一氯代物有两种
②1mol该有机物与足量银氨溶液反应能产生4mol Ag
(4)针对以下不同情况分别回答:
①若E能使溴的四氯化碳溶液褪色,还能与NaHCO3溶液反应生成F;D能发生银镜反应。则D的结构简式是_______ 。欲由A通过一步反应得到F,该反应的化学方程式是_______ 。
②若E中除苯环外,还含有一个六元环,则C→E的化学方程式是_______ 。
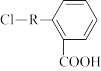 (其中R为饱和烃基),A在一定条件下有如下图所示的转化关系。已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2。
(其中R为饱和烃基),A在一定条件下有如下图所示的转化关系。已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2。
(1)E的分子式是
(2)关于上述各步转化中,下列说法正确的是
a.以上各步没有涉及加成反应
b.E比C的相对分子质量小18
c.A、B、C、D中都含有—COOH
d.A与C发生酯化反应后得到的有机物分子式可能是C18H18O4Cl
(3)写出所有符合下列要求的E的同分异构体的结构简式:
①分子中苯环上有三个取代基,且苯环上的一氯代物有两种
②1mol该有机物与足量银氨溶液反应能产生4mol Ag
(4)针对以下不同情况分别回答:
①若E能使溴的四氯化碳溶液褪色,还能与NaHCO3溶液反应生成F;D能发生银镜反应。则D的结构简式是
②若E中除苯环外,还含有一个六元环,则C→E的化学方程式是
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
解题方法
【推荐2】分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物质,某实验室的科技人员设计了下列合成路线:

试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现_____________ 种峰;峰面积比为_____________ 。
(2)C物质的官能团名称_____________ 。
(3)上述合成路线中属于取代反应的是_____________ (填编号);
(4)写出反应④、⑤、⑥的化学方程式:
④______________________________ 。
⑤______________________________ 。
⑥______________________________ 。
(5)F有多种同分异构体,请写出符合下列条件的所有结构简式:①属于芳香族化合物,且含有与F相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为-CH2COOCH3;_____________ 。

试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现
(2)C物质的官能团名称
(3)上述合成路线中属于取代反应的是
(4)写出反应④、⑤、⑥的化学方程式:
④
⑤
⑥
(5)F有多种同分异构体,请写出符合下列条件的所有结构简式:①属于芳香族化合物,且含有与F相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为-CH2COOCH3;
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
【推荐3】高分子材料G在工业上有重要用途。G可由某石油化工产品R为原料合成,其流程如下:
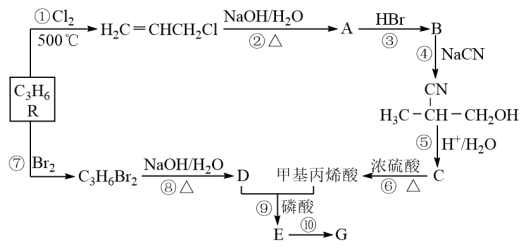
已知以下信息:
I.磷酸的结构式为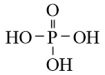
Ⅱ.G的结构简式为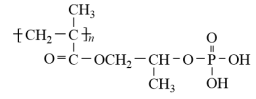
回答下列问题:
(1)A分子中官能团名称是_____________ 、D的名称是____________ 。
(2)①、⑩的反应类型是____________ 、____________ 。
(3)lmolE与足量的NaOH溶液反应时,消耗NaOH物质的量是_______ mol。
(4)满足下列条件的C的同分异构体共有__________ 种。
a.能发生银镜反应 b.能与Na反应产生氢气 c.能发生水解反应
(5)写出④步反应的方程式________________________________ 。
(6)磷的化合物三氯氰磷(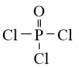 )与季戊四醇(
)与季戊四醇(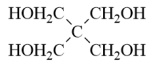 )以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。X的核磁共振氢谱如右图所示。
)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。X的核磁共振氢谱如右图所示。
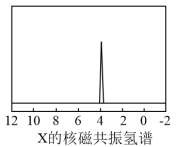
①酸性气体是___________________ (填化学式)
②X的结构简式是_____________________________________ 。

已知以下信息:
I.磷酸的结构式为
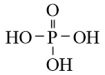
Ⅱ.G的结构简式为
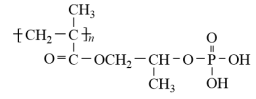
回答下列问题:
(1)A分子中官能团名称是
(2)①、⑩的反应类型是
(3)lmolE与足量的NaOH溶液反应时,消耗NaOH物质的量是
(4)满足下列条件的C的同分异构体共有
a.能发生银镜反应 b.能与Na反应产生氢气 c.能发生水解反应
(5)写出④步反应的方程式
(6)磷的化合物三氯氰磷(
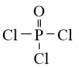 )与季戊四醇(
)与季戊四醇(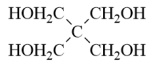 )以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。X的核磁共振氢谱如右图所示。
)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。X的核磁共振氢谱如右图所示。
①酸性气体是
②X的结构简式是
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
【推荐1】阿莫西林是一种最常用的半合成青霉素类广谱β-内酰胺类抗生素,某研究小组按图中路线合成:
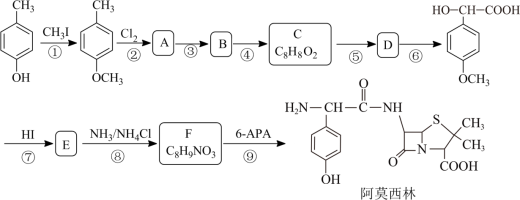
已知: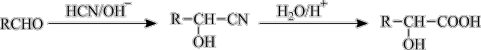
请回答:
(1)C的结构简式为___________ 。
(2)下列说法不正确的是___________ 。
A.化合物B含有羟基
B.反应⑤发生了加成反应
C.化合物D能发生消去反应
D.阿莫西林的分子式是C16H21N3O5S
(3)写出第⑨步反应的化学反应方程式___________ 。
(4)设计从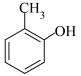 出发制备阿司匹林(
出发制备阿司匹林( 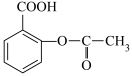 )的合成路线(用流程图表示,其他试剂任选)
)的合成路线(用流程图表示,其他试剂任选)___________ 。
(5)写出同时符合下列条件的F的所有同分异构体的结构简式___________ 。
①分子中有苯环且是苯环的对位二取代物
②分子中含有硝基且不与苯环直接相连
③分子不与金属钠反应放出氢气

已知:
请回答:
(1)C的结构简式为
(2)下列说法不正确的是
A.化合物B含有羟基
B.反应⑤发生了加成反应
C.化合物D能发生消去反应
D.阿莫西林的分子式是C16H21N3O5S
(3)写出第⑨步反应的化学反应方程式
(4)设计从
 出发制备阿司匹林(
出发制备阿司匹林(  )的合成路线(用流程图表示,其他试剂任选)
)的合成路线(用流程图表示,其他试剂任选)(5)写出同时符合下列条件的F的所有同分异构体的结构简式
①分子中有苯环且是苯环的对位二取代物
②分子中含有硝基且不与苯环直接相连
③分子不与金属钠反应放出氢气
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
【推荐2】双功能手性催化剂在药物合成中起到重要的作用。一种催化剂M的合成路线如图:

已知:
完成下列填空:
(1)写出B中含有的官能团名称是:_______
(2)⑤的反应类型是_______ ;反应②所需试剂与条件为_______
(3)设计反应②、③的目的是_______
(4)写出结构简式:E_______ ;试剂a_______ 。
(5)写出符合下列要求的C的同分异构体_______ (写一种)
i.能发生银镜反应
ii.分子中含有三种化学环境不同的氢原子
iii.不存在 结构
结构
(6)设计由 为原料合成A的合成路线
为原料合成A的合成路线_______ (合成路线常用的表示方式为:A B
B
 目标产物)
目标产物)

已知:

完成下列填空:
(1)写出B中含有的官能团名称是:
(2)⑤的反应类型是
(3)设计反应②、③的目的是
(4)写出结构简式:E
(5)写出符合下列要求的C的同分异构体
i.能发生银镜反应
ii.分子中含有三种化学环境不同的氢原子
iii.不存在
 结构
结构(6)设计由
 为原料合成A的合成路线
为原料合成A的合成路线 B
B
 目标产物)
目标产物)
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
解题方法
【推荐3】I.多项选择题。如下图所示,下列关于该物质(EGG)的叙述不正确 的是(____)

A.EGG的分子式为C15H14O7
B.EGG可在NaOH的醇溶液中发生消去反应
C.1molEGG与NaOH溶液 、溴水反应分别消耗5mol、4mol
D.EGG的核磁共振氢谱上有10组峰
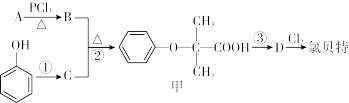
Ⅱ.氯贝特是临床上一种降脂抗血栓药物,其结构如图所示 。它的一条合成路线如下:提示:(图中部分反应条件及部分反应物、生成物已略去)
。它的一条合成路线如下:提示:(图中部分反应条件及部分反应物、生成物已略去)
已知:
R-ONa+Cl-R' R-O-R'+NaCl(R-、R'-代表烃基)
R-O-R'+NaCl(R-、R'-代表烃基)
(1)A的结构简式是________________ ,A→B的反应类型是____________ 。
(2)氯贝特的官能团名称为__________ ,写出氯贝特与足量NaOH溶液反应的化学方程式是_________________________________________________ 。
(3)要实现反应①所示的转化,加入下列物质不能达到目的的是__________ 。
a.NaOH b.NaCl c.NaHCO3 d. Na
(4)写出D→氯贝特的化学方程式为______________________ 。
(5)有机物甲有多种同分异构体,则同时满足以下条件的甲的所有同分异构体有__________ 种。①苯环上有2个取代基;②属于酯类;③既能与FeCl3溶液反应显紫色,又能发生银镜反应。其中峰面积比为1:2:2:6:1的结构简式为__________ 。

A.EGG的分子式为C15H14O7
B.EGG可在NaOH的醇溶液中发生消去反应
C.1molEGG与NaOH溶液 、溴水反应分别消耗5mol、4mol
D.EGG的核磁共振氢谱上有10组峰
Ⅱ.氯贝特是临床上一种降脂抗血栓药物,其结构如图所示
 。它的一条合成路线如下:提示:(图中部分反应条件及部分反应物、生成物已略去)
。它的一条合成路线如下:提示:(图中部分反应条件及部分反应物、生成物已略去)
已知:

R-ONa+Cl-R'
 R-O-R'+NaCl(R-、R'-代表烃基)
R-O-R'+NaCl(R-、R'-代表烃基)(1)A的结构简式是
(2)氯贝特的官能团名称为
(3)要实现反应①所示的转化,加入下列物质不能达到目的的是
a.NaOH b.NaCl c.NaHCO3 d. Na
(4)写出D→氯贝特的化学方程式为
(5)有机物甲有多种同分异构体,则同时满足以下条件的甲的所有同分异构体有
您最近一年使用:0次
【推荐1】二氧化碳转化甲醇技术是当前的研究热点,假设该过程仅发生如下3个反应:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) K1△H1
CH3OH(g)+H2O(g) K1△H1
反应II:2CH3OH(g) CH3OCH3(g)+H2O(g) K2△H2
CH3OCH3(g)+H2O(g) K2△H2
反应III:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) K3△H3
CH3OCH3(g)+3H2O(g) K3△H3
(1)上述反应的平衡常数K与温度T的关系都符合:lnK=A+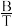 (A、B都为常数,且都大于零),则
(A、B都为常数,且都大于零),则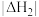
______ 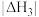 (填“>”、“<”或“=)。
(填“>”、“<”或“=)。
(2)在体积为1L的刚性容器中,仅发生反应I,投料比 =3,反应一段时间后,在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图所示。
=3,反应一段时间后,在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图所示。

①下列说法能作为反应I达到平衡状态的判据是______ (填字母)。
A.气体密度不再变化 B.CO2的体积分数不再变化
C.气体平均相对分子质量不再变化 D.CO2、H2的物质的量之比为1:3
②有分子筛时,P点之前甲醇的产率随温度升高而升高的原因是______ 。
③210℃下,反应达到平衡时,该容器中未通过膜的H2O分子占反应生成的H2O分子的百分比为_____ (用a表示)。
(3)CH3OH(g)在γ-Al2O3固体表面发生反应Ⅱ要经历:吸附→表面反应→脱附三个阶段,其机理如图所示。

①发生脱附的是历程______ (填数字)。
②已知历程5的化学方程式为:HO*+H*→H2O*(用*标注吸附的原子)。写出历程3的化学方程式:_____ 。
(4)甲醇可作为燃料电池的燃料。
①某甲醇燃料电池的部分结构如图所示,该电池的负极反应式为_____ 。

②已知氢气和甲醇的热值分别为143kJ/g和23kJ/g,与车载氢气供能模式相比,车载甲醇供能模式的优势是______ 。(已知燃料的能量密度单位为: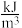 )
)
反应I:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) K1△H1
CH3OH(g)+H2O(g) K1△H1反应II:2CH3OH(g)
 CH3OCH3(g)+H2O(g) K2△H2
CH3OCH3(g)+H2O(g) K2△H2反应III:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) K3△H3
CH3OCH3(g)+3H2O(g) K3△H3(1)上述反应的平衡常数K与温度T的关系都符合:lnK=A+
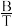 (A、B都为常数,且都大于零),则
(A、B都为常数,且都大于零),则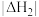
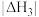 (填“>”、“<”或“=)。
(填“>”、“<”或“=)。(2)在体积为1L的刚性容器中,仅发生反应I,投料比
 =3,反应一段时间后,在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图所示。
=3,反应一段时间后,在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图所示。
①下列说法能作为反应I达到平衡状态的判据是
A.气体密度不再变化 B.CO2的体积分数不再变化
C.气体平均相对分子质量不再变化 D.CO2、H2的物质的量之比为1:3
②有分子筛时,P点之前甲醇的产率随温度升高而升高的原因是
③210℃下,反应达到平衡时,该容器中未通过膜的H2O分子占反应生成的H2O分子的百分比为
(3)CH3OH(g)在γ-Al2O3固体表面发生反应Ⅱ要经历:吸附→表面反应→脱附三个阶段,其机理如图所示。

①发生脱附的是历程
②已知历程5的化学方程式为:HO*+H*→H2O*(用*标注吸附的原子)。写出历程3的化学方程式:
(4)甲醇可作为燃料电池的燃料。
①某甲醇燃料电池的部分结构如图所示,该电池的负极反应式为

②已知氢气和甲醇的热值分别为143kJ/g和23kJ/g,与车载氢气供能模式相比,车载甲醇供能模式的优势是
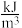 )
)
您最近一年使用:0次



