用还原法处理氮的氧化物,可减少环境污染。
(1) 催化还原
催化还原 、
、 的反应如下:
的反应如下:
a.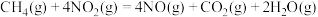
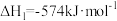
b.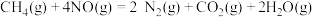

则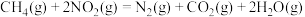

_______  。
。
(2)铂作催化剂,用 还原
还原 的反应为
的反应为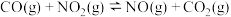
 ,其反应过程中的能量变化如图所示。
,其反应过程中的能量变化如图所示。

①不加催化剂时,该反应的正反应活化能为__  ,加入催化剂的是曲线
,加入催化剂的是曲线___ (填“a”或“b”)。
②上述反应的
_____ 。如果将 平衡转化率提高
平衡转化率提高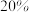 ,则
,则
___ (填“增大”“减小”或“不变”)。
(1)
 催化还原
催化还原 、
、 的反应如下:
的反应如下:a.
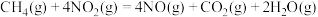
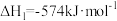
b.
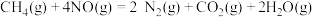

则
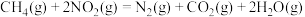

 。
。(2)铂作催化剂,用
 还原
还原 的反应为
的反应为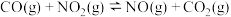
 ,其反应过程中的能量变化如图所示。
,其反应过程中的能量变化如图所示。
①不加催化剂时,该反应的正反应活化能为
 ,加入催化剂的是曲线
,加入催化剂的是曲线②上述反应的

 平衡转化率提高
平衡转化率提高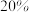 ,则
,则
更新时间:2021-03-15 20:31:40
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】碳及其化合物在有机合成、能源开发等工农业方面具有十分广泛的应用。
I.工业生产精细化工产品乙二醛(OHC-CHO)
(1)乙醇(CH3CH2OH)液相硝酸氧化法:在Cu(NO3)2催化下,用稀硝酸氧化乙醇制取乙二醛,此反应的化学方程式为_______________ 。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点____________ 。
(2)乙二醇(HOCH2CH2OH)气相氧化法
已知:2H2(g)+O2(g) 2H2O(g) ΔH=-484kJ/mol,化学平衡常数为K1
2H2O(g) ΔH=-484kJ/mol,化学平衡常数为K1
OHC-CHO(g)+2H2(g) HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g) OHC-CHO(g)+2H2O(g)的ΔH=
OHC-CHO(g)+2H2O(g)的ΔH=______ ;相同温度下,该反应的化学平衡常数K=______ (用含K1、K2的代数式表示)。
Ⅱ.CO2的综合利用
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中发生反应C(s)+CO2(g) 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______ (填字母)。
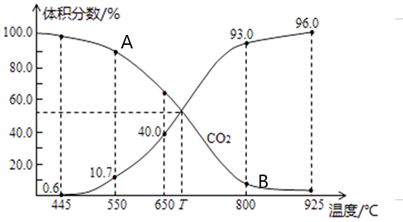
a.反应达平衡状态时,混合气体的平均相对分子质量保持不变
b.A点的正反应速率比B点正反应速率小
C.550℃时,若充入氦气,则V正、V逆均减小,平衡不移动
d.T℃时,反应达平衡后CO2的转化率为66.7%
e. T℃时,若再充入1molCO2和1molCO,平衡不移动
(4)氨气、CO2在一定条件下可合成尿素,其反应为2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
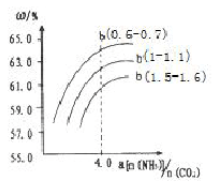
①b应控制在______
a.1.5-1.6 b.1-1.1 c.0.6-0.7
②a应控制在4.0的理由是_________
I.工业生产精细化工产品乙二醛(OHC-CHO)
(1)乙醇(CH3CH2OH)液相硝酸氧化法:在Cu(NO3)2催化下,用稀硝酸氧化乙醇制取乙二醛,此反应的化学方程式为
(2)乙二醇(HOCH2CH2OH)气相氧化法
已知:2H2(g)+O2(g)
 2H2O(g) ΔH=-484kJ/mol,化学平衡常数为K1
2H2O(g) ΔH=-484kJ/mol,化学平衡常数为K1OHC-CHO(g)+2H2(g)
 HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)
 OHC-CHO(g)+2H2O(g)的ΔH=
OHC-CHO(g)+2H2O(g)的ΔH=Ⅱ.CO2的综合利用
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中发生反应C(s)+CO2(g)
 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是
a.反应达平衡状态时,混合气体的平均相对分子质量保持不变
b.A点的正反应速率比B点正反应速率小
C.550℃时,若充入氦气,则V正、V逆均减小,平衡不移动
d.T℃时,反应达平衡后CO2的转化率为66.7%
e. T℃时,若再充入1molCO2和1molCO,平衡不移动
(4)氨气、CO2在一定条件下可合成尿素,其反应为2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
①b应控制在
a.1.5-1.6 b.1-1.1 c.0.6-0.7
②a应控制在4.0的理由是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】根据已知信息,完成下列问题
(1)汽车尾气中的NOx是大气污染物之一。压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2。
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1,
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2。
则2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g) ΔH3=____ (用ΔH1和ΔH2表示)。
(2)工业上用水煤气法制氢气,
已知:①C(s)+ O2(g)=CO(g) ΔH1=-110.5 kJ·mol-1,
O2(g)=CO(g) ΔH1=-110.5 kJ·mol-1,
②2H2(g)+O2(g)=2H2O(g) ΔH2=-483.6 kJ·mol-1。
则水煤气法制氢气C(s)+H2O(g)=CO(g)+H2(g) ΔH3=____ kJ·mol-1。
(3)Cu2O是一种半导体材料,
已知:①Cu2O(s)+1/2O2(g)=2CuO(s) ΔH1=-145 kJ·mol-1,
②CuO(s)+H2(g)=Cu(s)+H2O(l) ΔH2=-129 kJ·mol-1,
③H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1。
则反应2Cu(s)+H2O(l)=Cu2O(s)+H2(g) ΔH4=____ kJ·mol-1。
(4)工业上由金红石(TiO2)制取单质Ti,
已知:①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1,
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0 kJ·mol-1,
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3=+141.0 kJ·mol-1。
则反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g) ΔH4=____ kJ·mol-1。
(5)工业上用天然气制备CH3OH。
已知:①CH4(g)+O2(g)=CO(g)+H2(g)+H2O(g) ΔH1=-321.5 kJ·mol-1,
②CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH2=+250.3 kJ·mol-1,
③CO(g)+2H2(g)=CH3OH(g) ΔH3=-90.0 kJ·mol-1。
则CH4(g)与O2(g)反应生成CH3OH(g)的热化学方程式为____ 。
(6)已知1mol N2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622 kJ热量,则N2H4(l)燃烧的热化学方程式为____ 。
(7)已知0.5mol CH4(g)完全燃烧,生成CO2(g)和H2O(l)时,放出445 kJ热量,则CH4(g)燃烧的热化学方程式为____ 。
(8)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。已知在300℃、Fe做催化剂时,在氨气足量的情况下,烟气中c(NO2):c(NO)=1:1时脱氮效果最佳,且生成1mol N2(g)反应放出的热量为Q kJ(Q>0),此时对应的脱氮反应的热化学方程式为____ 。
(1)汽车尾气中的NOx是大气污染物之一。压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2。
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1,
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2。
则2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g) ΔH3=
(2)工业上用水煤气法制氢气,
已知:①C(s)+
 O2(g)=CO(g) ΔH1=-110.5 kJ·mol-1,
O2(g)=CO(g) ΔH1=-110.5 kJ·mol-1,②2H2(g)+O2(g)=2H2O(g) ΔH2=-483.6 kJ·mol-1。
则水煤气法制氢气C(s)+H2O(g)=CO(g)+H2(g) ΔH3=
(3)Cu2O是一种半导体材料,
已知:①Cu2O(s)+1/2O2(g)=2CuO(s) ΔH1=-145 kJ·mol-1,
②CuO(s)+H2(g)=Cu(s)+H2O(l) ΔH2=-129 kJ·mol-1,
③H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1。
则反应2Cu(s)+H2O(l)=Cu2O(s)+H2(g) ΔH4=
(4)工业上由金红石(TiO2)制取单质Ti,
已知:①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1,
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0 kJ·mol-1,
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3=+141.0 kJ·mol-1。
则反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g) ΔH4=
(5)工业上用天然气制备CH3OH。
已知:①CH4(g)+O2(g)=CO(g)+H2(g)+H2O(g) ΔH1=-321.5 kJ·mol-1,
②CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH2=+250.3 kJ·mol-1,
③CO(g)+2H2(g)=CH3OH(g) ΔH3=-90.0 kJ·mol-1。
则CH4(g)与O2(g)反应生成CH3OH(g)的热化学方程式为
(6)已知1mol N2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622 kJ热量,则N2H4(l)燃烧的热化学方程式为
(7)已知0.5mol CH4(g)完全燃烧,生成CO2(g)和H2O(l)时,放出445 kJ热量,则CH4(g)燃烧的热化学方程式为
(8)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。已知在300℃、Fe做催化剂时,在氨气足量的情况下,烟气中c(NO2):c(NO)=1:1时脱氮效果最佳,且生成1mol N2(g)反应放出的热量为Q kJ(Q>0),此时对应的脱氮反应的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】煤作为燃料,可以有下列两种途径(把煤看成由碳组成):
途径Ⅰ:C(s)+O2(g)= CO2(g) ΔH=-a kJ·mol-1
途径Ⅱ:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+b kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-c kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-d kJ·mol-1
试回答下列问题:
(1)燃烧等质量的煤,途径Ⅰ放出的热量____ 途径Ⅱ放出的热量(填“大于”、“小于”或“等于”)。
(2)b的数学关系式是______________ (用a、c、d表示)。
(3)由于制取水煤气反应中,反应物具有的总能量________ (填“大于”、“小于”或“等于”)生成物所具有的总能量,在反应时,反应物需要______ (填“吸收”或“放出”)能量才能转化为生成物。
(4)简述煤通过途径Ⅱ作为燃料的意义___________________________________ 。
途径Ⅰ:C(s)+O2(g)= CO2(g) ΔH=-a kJ·mol-1
途径Ⅱ:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+b kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-c kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-d kJ·mol-1
试回答下列问题:
(1)燃烧等质量的煤,途径Ⅰ放出的热量
(2)b的数学关系式是
(3)由于制取水煤气反应中,反应物具有的总能量
(4)简述煤通过途径Ⅱ作为燃料的意义
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】金属镁是一种活泼的常见金属,用途广泛。在25℃,101kPa条件下。有关物质的能量如下表所示(X2表示任意卤素单质):
回答下列问题:
(1)镁与卤素单质的反应属于_______ (“放热”或“吸热”)反应。
(2)镁与卤素单质反应的生成物中,热稳定性最差的是_________ 。
(3)镁与液溴反应的热化学方程式为________ 。
(4)反应F2(g)+MgCl2(s)=MgF2(s)+Cl2(g)的△H=_______ kJ·mol-1。
物质 | Mg | X2 | MgF2 | MgCl2 | MgBr2 | MgI2 |
能量/kJ‧mol-1 | 0 | 0 | -1124 | -641.3 | -524 | -364 |
回答下列问题:
(1)镁与卤素单质的反应属于
(2)镁与卤素单质反应的生成物中,热稳定性最差的是
(3)镁与液溴反应的热化学方程式为
(4)反应F2(g)+MgCl2(s)=MgF2(s)+Cl2(g)的△H=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l) ∆H=-570kJ/mol
②2H2O(g)=2H2(g)+O2(g) ∆H=+483.6kJ/mol
③2CO(g)=2C(s)+O2(g) ∆H=+220.8kJ/mol
④2C(s)+2O2(g)=2CO2(g) ∆H=-787kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是_______ (填写序号)。
(2)燃烧10gH2生成液态水,放出的热量为_______ 。
(3)C(s)的燃烧热的热化学方程式为_______
Ⅱ.已知:工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用下进行的,反应器中发生了下列反应:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.7kJ·mol-1 ①
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1 ②
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
(4)反应器中的总反应可表示为3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),计算该反应的ΔH=_______ 。
①2H2(g)+O2(g)=2H2O(l) ∆H=-570kJ/mol
②2H2O(g)=2H2(g)+O2(g) ∆H=+483.6kJ/mol
③2CO(g)=2C(s)+O2(g) ∆H=+220.8kJ/mol
④2C(s)+2O2(g)=2CO2(g) ∆H=-787kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是
(2)燃烧10gH2生成液态水,放出的热量为
(3)C(s)的燃烧热的热化学方程式为
Ⅱ.已知:工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用下进行的,反应器中发生了下列反应:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.7kJ·mol-1 ①
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1 ②
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
(4)反应器中的总反应可表示为3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),计算该反应的ΔH=
您最近一年使用:0次





