碘元素是人体的必需微量元素之一。某学习小组在实验室进行海带提碘的探究,实验过程如图:
Ⅰ.海带中碘元素的确定
海带 海带灰
海带灰
 海带灰浸取液
海带灰浸取液
(1)取海带灰浸取液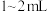 ,加入稀硫酸约
,加入稀硫酸约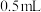 、5%的
、5%的 溶液约
溶液约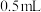 ,然后加入
,然后加入 约
约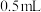 ,振荡后静置,可以观察到
,振荡后静置,可以观察到_______ ,证明海带中含有碘元素,该反应的离子方程式为_______ 。
Ⅱ.海带提碘
海带灰浸取液 含I2的水溶液
含I2的水溶液 碘的有机溶液→晶体碘
碘的有机溶液→晶体碘
(2)若向 碘水L中加入
碘水L中加入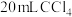 ,充分振荡、静置,此时碘在
,充分振荡、静置,此时碘在 中的物质的量浓度是水中的86倍,则萃取效率为
中的物质的量浓度是水中的86倍,则萃取效率为_______ %(结果保留小数点后两位)(萃取效率 )。
)。
(3)萃取实验中,若要使碘尽可能地完全转移到 中,可以采取的操作是
中,可以采取的操作是_______ 。
(4)某同学采取减压蒸馏(装置如图),可以很快完成碘和四氯化碳的分离,减压蒸馏时使用了克氏蒸馏头,克氏蒸馏头比普通蒸馏头增加了一个弯管,弯管的主要作用是_______ 。
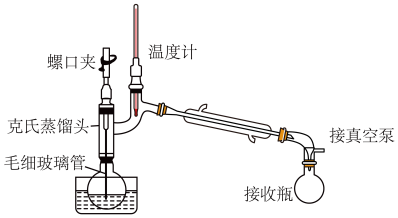
Ⅲ.海带中碘含量的测定
(5)若称取干海带 ,经灼烧、浸取、
,经灼烧、浸取、 氧化等过程后配制成
氧化等过程后配制成 溶液,移取
溶液,移取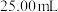 于锥形瓶中,用
于锥形瓶中,用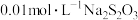 标准溶液滴定,待溶液由黄色变为浅黄色时,滴加两滴淀粉指示剂,继续滴定至蓝色刚好褪去,且半分钟内无变化,即为终点,平行滴定3次,记录所消耗的
标准溶液滴定,待溶液由黄色变为浅黄色时,滴加两滴淀粉指示剂,继续滴定至蓝色刚好褪去,且半分钟内无变化,即为终点,平行滴定3次,记录所消耗的 溶液的平均体积为
溶液的平均体积为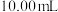 ,计算海带中含碘的质量分数为
,计算海带中含碘的质量分数为_______ %(结果保留小数点后两位)(已知 )。若滴定结束读数时俯视刻度线,会导致测定结果
)。若滴定结束读数时俯视刻度线,会导致测定结果_______ (填“偏高”“偏低”或“不影响”)。
Ⅰ.海带中碘元素的确定
海带
 海带灰
海带灰
 海带灰浸取液
海带灰浸取液(1)取海带灰浸取液
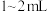 ,加入稀硫酸约
,加入稀硫酸约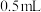 、5%的
、5%的 溶液约
溶液约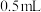 ,然后加入
,然后加入 约
约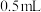 ,振荡后静置,可以观察到
,振荡后静置,可以观察到Ⅱ.海带提碘
海带灰浸取液
 含I2的水溶液
含I2的水溶液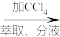 碘的有机溶液→晶体碘
碘的有机溶液→晶体碘(2)若向
 碘水L中加入
碘水L中加入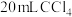 ,充分振荡、静置,此时碘在
,充分振荡、静置,此时碘在 中的物质的量浓度是水中的86倍,则萃取效率为
中的物质的量浓度是水中的86倍,则萃取效率为 )。
)。(3)萃取实验中,若要使碘尽可能地完全转移到
 中,可以采取的操作是
中,可以采取的操作是(4)某同学采取减压蒸馏(装置如图),可以很快完成碘和四氯化碳的分离,减压蒸馏时使用了克氏蒸馏头,克氏蒸馏头比普通蒸馏头增加了一个弯管,弯管的主要作用是

Ⅲ.海带中碘含量的测定
(5)若称取干海带
 ,经灼烧、浸取、
,经灼烧、浸取、 氧化等过程后配制成
氧化等过程后配制成 溶液,移取
溶液,移取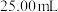 于锥形瓶中,用
于锥形瓶中,用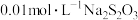 标准溶液滴定,待溶液由黄色变为浅黄色时,滴加两滴淀粉指示剂,继续滴定至蓝色刚好褪去,且半分钟内无变化,即为终点,平行滴定3次,记录所消耗的
标准溶液滴定,待溶液由黄色变为浅黄色时,滴加两滴淀粉指示剂,继续滴定至蓝色刚好褪去,且半分钟内无变化,即为终点,平行滴定3次,记录所消耗的 溶液的平均体积为
溶液的平均体积为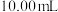 ,计算海带中含碘的质量分数为
,计算海带中含碘的质量分数为 )。若滴定结束读数时俯视刻度线,会导致测定结果
)。若滴定结束读数时俯视刻度线,会导致测定结果
更新时间:2021-04-06 14:48:47
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备K2SO4和Mn3O4的工艺流程如下:
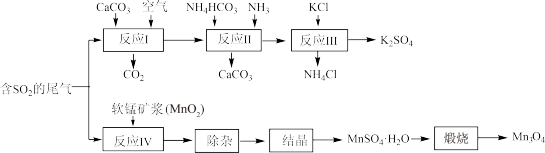
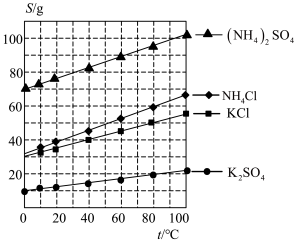

(1)几种盐的溶解度见上图。反应Ⅲ中,向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、______ 、洗涤、干燥等操作即得K2SO4产品。
(2)检验K2SO4样品是否含有氯化物杂质的实验操作是______ 。
(3)反应Ⅳ的化学方程式为______ 。
(4)Mn3O4与浓盐酸加热时发生反应的离子方程式为______ 。
(5)上图煅烧MnSO4·H2O时温度与剩余固体质量变化曲线。
①该曲线中B段所表示物质的化学式为______ 。
②煅烧过程中固体锰含量随温度的升高而增大,但当温度超过1000℃时,再冷却后,测得产物的总锰含量反而减小。试分析产物总锰含量减小的原因______ 。



(1)几种盐的溶解度见上图。反应Ⅲ中,向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、
(2)检验K2SO4样品是否含有氯化物杂质的实验操作是
(3)反应Ⅳ的化学方程式为
(4)Mn3O4与浓盐酸加热时发生反应的离子方程式为
(5)上图煅烧MnSO4·H2O时温度与剩余固体质量变化曲线。
①该曲线中B段所表示物质的化学式为
②煅烧过程中固体锰含量随温度的升高而增大,但当温度超过1000℃时,再冷却后,测得产物的总锰含量反而减小。试分析产物总锰含量减小的原因
您最近一年使用:0次
【推荐2】(1)将下列性质的编号,填入各小题后面对应的横线中:
A.脱水性;B.强酸性;C.氧化性;D.吸水性
①将胆矾放入装有浓H2SO4的干燥器中,过一段时间胆矾变白色。______
②在烧杯中放入蔗糖,滴入浓H2SO4变黑,并产生大量气体。______
③在冷浓HNO3中放入铝片没明显现象.______
④用稀硫酸清洗金属表面的氧化物。______
(2)矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的.此处所指的风化作用是指矿物与水和CO2同时作用的过程.例如钾长石(KAlSi3O8)风化生成高岭土[Al2Si2O5(OH)4],此反应的离子方程式为:2KAlSi3O8 +2 CO2 +7H2O = 2K+ + 2HCO3-+ 4H2SiO3 + Al2Si2O5(OH)4,这个反应能够发生的原因是______ 。
(3)为了验证木炭和浓H2SO4反应生成的CO2、SO2,选用下图所示仪器(内含物质)组装成实验装置:(每组只能选一次,不能重复选)

①如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):______ 接 ______ , ______ 接 ______ , ______ 接 ______ ;
②有怎样的实验现象才表明已检验出CO2?______ 。
A.脱水性;B.强酸性;C.氧化性;D.吸水性
①将胆矾放入装有浓H2SO4的干燥器中,过一段时间胆矾变白色。
②在烧杯中放入蔗糖,滴入浓H2SO4变黑,并产生大量气体。
③在冷浓HNO3中放入铝片没明显现象.
④用稀硫酸清洗金属表面的氧化物。
(2)矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的.此处所指的风化作用是指矿物与水和CO2同时作用的过程.例如钾长石(KAlSi3O8)风化生成高岭土[Al2Si2O5(OH)4],此反应的离子方程式为:2KAlSi3O8 +2 CO2 +7H2O = 2K+ + 2HCO3-+ 4H2SiO3 + Al2Si2O5(OH)4,这个反应能够发生的原因是
(3)为了验证木炭和浓H2SO4反应生成的CO2、SO2,选用下图所示仪器(内含物质)组装成实验装置:(每组只能选一次,不能重复选)

①如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
②有怎样的实验现象才表明已检验出CO2?
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】我们的生活离不开化学,化学物质在不同的领域发挥着重要的作用。
I、
(1)将氯化铝溶液加热蒸干灼烧得到的固体为______ , 是一种液态化合物,遇水剧烈反应,有白雾和使滴有品红试液的滤纸褪色的刺激性气味产生,实际工业上将
是一种液态化合物,遇水剧烈反应,有白雾和使滴有品红试液的滤纸褪色的刺激性气味产生,实际工业上将 与
与 混合共热,可得到无水
混合共热,可得到无水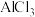 ,其原因是
,其原因是______ 。
Ⅱ、氯化亚砜(SOCl2)具有较强的巯基和羟基取代能力,广泛应用于有机合成中。工业上可以利用 与
与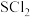 反应制得,装置如下图所示(夹持及加热装置已略去):
反应制得,装置如下图所示(夹持及加热装置已略去):

物质的相关性质如上表:
已知: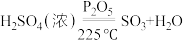 ;
;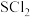 与
与 互溶。
互溶。
实验步骤如下:
①通入干燥的氮气(能够抑制三氧化硫气体逸出),观察A中气泡控制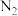 的流速;
的流速;
②将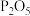 固体置于烧瓶B中,向B中分多次缓慢加入5.44 mL浓硫酸(密度为
固体置于烧瓶B中,向B中分多次缓慢加入5.44 mL浓硫酸(密度为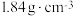 ,质量分数为98%),再向C中加入足量
,质量分数为98%),再向C中加入足量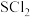 :
:
③冷凝管接入冷凝水后将烧瓶B升温至225℃,三氧化硫液体缓慢流入锥形瓶C中;
④反应完成后取下锥形瓶C,……(操作),得到高纯 产物。
产物。
回答下列问题:
(2)锥形瓶C中生成氯化亚砜的方程式为______ 。
(3)该制备 装置存在的缺陷为
装置存在的缺陷为______ 。
(4)实验步骤④中的操作为______ (填名称)。
(5)将得到的 溶于水生成两种酸,取所得溶液体积的十分之一用
溶于水生成两种酸,取所得溶液体积的十分之一用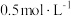 标准碘溶液滴定,选用
标准碘溶液滴定,选用______ 做指示剂,滴定终点消耗标准碘溶液的体积为13.00 mL,则 的产率为
的产率为______ (保留一位小数)。
I、
(1)将氯化铝溶液加热蒸干灼烧得到的固体为
 是一种液态化合物,遇水剧烈反应,有白雾和使滴有品红试液的滤纸褪色的刺激性气味产生,实际工业上将
是一种液态化合物,遇水剧烈反应,有白雾和使滴有品红试液的滤纸褪色的刺激性气味产生,实际工业上将 与
与 混合共热,可得到无水
混合共热,可得到无水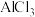 ,其原因是
,其原因是Ⅱ、氯化亚砜(SOCl2)具有较强的巯基和羟基取代能力,广泛应用于有机合成中。工业上可以利用
 与
与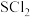 反应制得,装置如下图所示(夹持及加热装置已略去):
反应制得,装置如下图所示(夹持及加热装置已略去):
物质 |
|
|
|
熔点/℃ | 16.8 | -78 | -105 |
沸点/℃ | 44.8 | 60 | 78.8 |
与水反应 | 均能与水剧烈反应 | ||
已知:
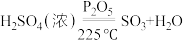 ;
;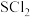 与
与 互溶。
互溶。实验步骤如下:
①通入干燥的氮气(能够抑制三氧化硫气体逸出),观察A中气泡控制
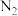 的流速;
的流速;②将
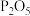 固体置于烧瓶B中,向B中分多次缓慢加入5.44 mL浓硫酸(密度为
固体置于烧瓶B中,向B中分多次缓慢加入5.44 mL浓硫酸(密度为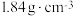 ,质量分数为98%),再向C中加入足量
,质量分数为98%),再向C中加入足量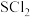 :
:③冷凝管接入冷凝水后将烧瓶B升温至225℃,三氧化硫液体缓慢流入锥形瓶C中;
④反应完成后取下锥形瓶C,……(操作),得到高纯
 产物。
产物。回答下列问题:
(2)锥形瓶C中生成氯化亚砜的方程式为
(3)该制备
 装置存在的缺陷为
装置存在的缺陷为(4)实验步骤④中的操作为
(5)将得到的
 溶于水生成两种酸,取所得溶液体积的十分之一用
溶于水生成两种酸,取所得溶液体积的十分之一用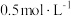 标准碘溶液滴定,选用
标准碘溶液滴定,选用 的产率为
的产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某兴趣小组利用下列装置,进行与氯气相关的实验。
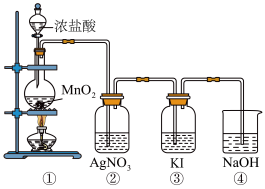
请回答:
(1)写出实验室用上述方法制取氯气的化学方程式_________ 。
(2)利用该原理和装置①进行实验,制得的氯气中往往含有的杂质可依次通入到_________ 、_________ 除去。
(3)装置②中出现白色沉淀,据此现象能否推测装置①中生成Cl2_________ (填“能”或者“否”),请说明理由_________ 。
(4)实验室从海带中提取碘的就是利用装置③的原理,请写出该溶液中发生反应的离子反应方程式_________ 。
(5)图中④所示的溶液是为了减少对环境的污染,请写出该溶液中发生反应的离子反应方程式_________ 。

请回答:
(1)写出实验室用上述方法制取氯气的化学方程式
(2)利用该原理和装置①进行实验,制得的氯气中往往含有的杂质可依次通入到
(3)装置②中出现白色沉淀,据此现象能否推测装置①中生成Cl2
(4)实验室从海带中提取碘的就是利用装置③的原理,请写出该溶液中发生反应的离子反应方程式
(5)图中④所示的溶液是为了减少对环境的污染,请写出该溶液中发生反应的离子反应方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:

(1)实验室焙烧海带,需要下列仪器中的________________ (填序号)。
a.试管b.烧杯c.坩埚d.泥三角e.铁三脚架f.酒精灯
(2)指出提取碘的过程中有关的实验操作③的名称是________________ ,所用主要仪器是________________ 。
(3)提取碘的过程中,可选择的有机试剂是________________
A.甲苯、酒精 B.四氯化碳、苯C.汽油、乙酸 D.汽油、甘油
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出实验装置图中的错误之处:
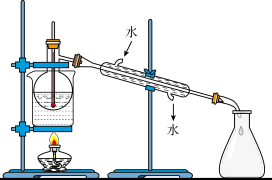
①________________ ;
②________________ ;
③________________ 。
(5)进行上述蒸馏操作时,使用水浴加热的原因是________________ ,最后晶态碘在________________ (填仪器名称)里聚集。

(1)实验室焙烧海带,需要下列仪器中的
a.试管b.烧杯c.坩埚d.泥三角e.铁三脚架f.酒精灯
(2)指出提取碘的过程中有关的实验操作③的名称是
(3)提取碘的过程中,可选择的有机试剂是
A.甲苯、酒精 B.四氯化碳、苯C.汽油、乙酸 D.汽油、甘油
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出实验装置图中的错误之处:

①
②
③
(5)进行上述蒸馏操作时,使用水浴加热的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某同学取海带灰加蒸馏水煮沸 ,冷却,过滤,获得含I-的溶液,并设计如图所示实验方案,从中提取I2。
,冷却,过滤,获得含I-的溶液,并设计如图所示实验方案,从中提取I2。
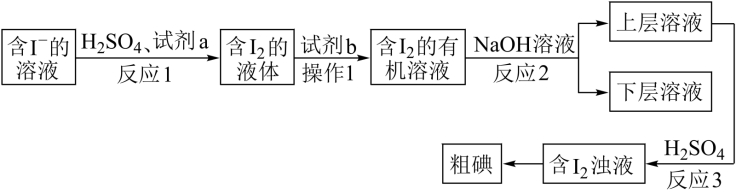
(1)反应1中硫酸的作用是提供酸性环境,则试剂a的作用是_______ 。
(2)试剂b应选择_______ (填标号)。
A.CCl4 B.酒精 C.醋酸
(3)操作1的名称是_______ 。实验室里进行操作1需要的玻璃仪器除烧杯外,还需要_______ ,有机层呈_______ 色
(4)反应2为3I2+6NaOH=5NaI+NaIO3+3H2O。此反应的氧化剂是_______ ,氧化产物是_______ 。
(5)反应3的离子方程式是_______ ,氧化产物和还原产物的物质的量之比_______
 ,冷却,过滤,获得含I-的溶液,并设计如图所示实验方案,从中提取I2。
,冷却,过滤,获得含I-的溶液,并设计如图所示实验方案,从中提取I2。
(1)反应1中硫酸的作用是提供酸性环境,则试剂a的作用是
(2)试剂b应选择
A.CCl4 B.酒精 C.醋酸
(3)操作1的名称是
(4)反应2为3I2+6NaOH=5NaI+NaIO3+3H2O。此反应的氧化剂是
(5)反应3的离子方程式是
您最近一年使用:0次



