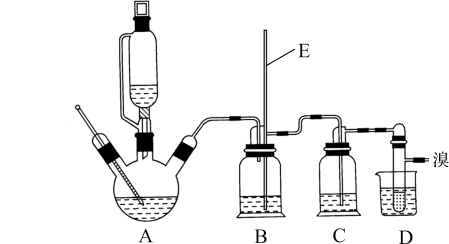
某兴趣小组利用下列装置,进行与氯气相关的实验。
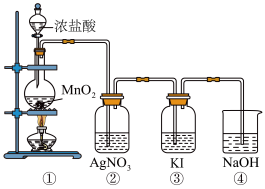
请回答:
(1)写出实验室用上述方法制取氯气的化学方程式_________ 。
(2)利用该原理和装置①进行实验,制得的氯气中往往含有的杂质可依次通入到_________ 、_________ 除去。
(3)装置②中出现白色沉淀,据此现象能否推测装置①中生成Cl2_________ (填“能”或者“否”),请说明理由_________ 。
(4)实验室从海带中提取碘的就是利用装置③的原理,请写出该溶液中发生反应的离子反应方程式_________ 。
(5)图中④所示的溶液是为了减少对环境的污染,请写出该溶液中发生反应的离子反应方程式_________ 。

请回答:
(1)写出实验室用上述方法制取氯气的化学方程式
(2)利用该原理和装置①进行实验,制得的氯气中往往含有的杂质可依次通入到
(3)装置②中出现白色沉淀,据此现象能否推测装置①中生成Cl2
(4)实验室从海带中提取碘的就是利用装置③的原理,请写出该溶液中发生反应的离子反应方程式
(5)图中④所示的溶液是为了减少对环境的污染,请写出该溶液中发生反应的离子反应方程式
更新时间:2019-11-29 12:38:53
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】三氯化磷(PCl3)是一种用于有机合成的重要催化剂。已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解。PCl3、POCl3的熔沸点见下表。
请答下面问题:
(1)选下图所示发生装置,可分别制备氯气
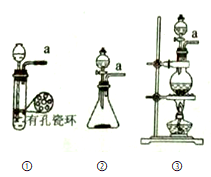
你选用的装置是___________ ,反应的离子方程式为____________
(2)实验室常用下图所示装置制取PCl3。
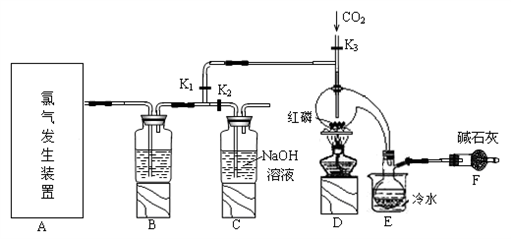
①玻璃管之间的连接需要用到胶皮管,连接的方法是:先把_______ ,然后稍稍用力即可把玻璃管插入橡皮管。
②B中所盛试剂是____________________ ,F中碱石灰的作用是_____________________ 。
③实验时,检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是______________________________ ,C装置中的K1、 K2的设计也出于类似的目的,为了达到这—实验目的,实验时与K1、 K2有关的操作是___________________ 。
(3)实验制得的粗产品中常含有POCl3、PCl5等。加入红磷加热除去PCl5,加入红磷时发生反应的化学方程式为_________________________ ,然后通过__________________ (填实验操作名称),即可得到较纯净的PCl3。
(4) 通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000 mol/L Na2S2O3溶液8.00mL.
已知:H3PO3+I2+H2O=H3PO4+2HI, I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为_______ 。
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)选下图所示发生装置,可分别制备氯气

你选用的装置是
(2)实验室常用下图所示装置制取PCl3。

①玻璃管之间的连接需要用到胶皮管,连接的方法是:先把
②B中所盛试剂是
③实验时,检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是
(3)实验制得的粗产品中常含有POCl3、PCl5等。加入红磷加热除去PCl5,加入红磷时发生反应的化学方程式为
(4) 通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000 mol/L Na2S2O3溶液8.00mL.
已知:H3PO3+I2+H2O=H3PO4+2HI, I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】二氯化二硫(S2Cl2)是一种常用于橡胶硫化、有机物氯化的试剂,查阅资料:①将干燥的氯气在110~140 ℃间与硫反应,即可得S2Cl2粗品;②有关物质的部分性质如表所示:
设计如图所示实验装置在实验室合成S2Cl2:
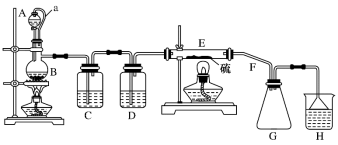
回答以下问题:
(1)a的作用是___________ 。B中所发生反应的化学方程式为___________ 。
(2)C装置的作用是___________ 。S2Cl2粗品中可能混有的杂质是___________ 。
(3)乙同学发现,该装置中除了E处的温度不能过高外,还有一处重大缺陷需改进,否则会导致S2Cl2的产率大大降低,原因是___________ (用化学方程式表示);请简要提出改进方案:___________ 。
(4)H中的溶液可以选择下列试剂中的___________ (填序号)。
①碳酸钠溶液 ②NaOH溶液 ③饱和NaCl溶液
| 物质 | 熔点/ | 沸点/ | 化学性质 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -77 | 137 | 一种橙黄色的液体,遇水易水解,有淡黄色固体出现,同时产生能使品红溶液褪色的气体;300以上完全分解;S2Cl2 + Cl2  2SCl2 。 2SCl2 。 |

回答以下问题:
(1)a的作用是
(2)C装置的作用是
(3)乙同学发现,该装置中除了E处的温度不能过高外,还有一处重大缺陷需改进,否则会导致S2Cl2的产率大大降低,原因是
(4)H中的溶液可以选择下列试剂中的
①碳酸钠溶液 ②NaOH溶液 ③饱和NaCl溶液
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】现用二氧化锰与浓盐酸反应制备纯净干燥的氯气,再用氯气与铜粉反应制取少量CuCl2,其装置如下:
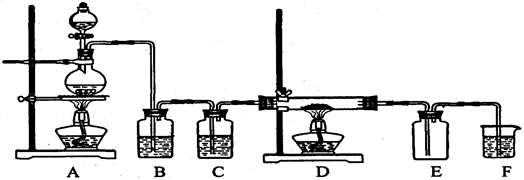
(1)写出装置A中发生反应的离子方程式_________________________ 。
(2)B中选用的试剂是饱和食盐水,其作用是除去Cl2中混有的__________ 杂质;装置E的作用是___________________ 。
(3)即使A装置中的MnO2和D装置中的Cu都是足量的,100mL 12mol/L浓盐酸经充分反应后得到的CuCl2也不足0.3mol,其原因是______________
A.装置漏气 B.A装置在加热过程中盐酸易挥发
C.CuCl2潮解吸水 D.A装置中反应生成的水要稀释盐酸,剩余的盐酸不再反应
(4)某实验小组的同学用经Cl2消毒的自来水配制下列溶液:①KI;②AgNO3;③AlCl3;④FeCl2;⑤稀盐酸,发现部分药品变质,它们是(请用序号作答)____________________ 。
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_____________________________________ 。
(6)一定条件下,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应。生成物中含有三种含氯元素的离子,其中ClO-、ClO 两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
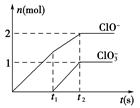
该过程中参加反应Cl2的物质的量是________ mol。若产生的n(C1-)为11mol,n(C1O3-)为2 mol,则参加反应的Ca(OH)2的物质的量为________ mol。

(1)写出装置A中发生反应的离子方程式
(2)B中选用的试剂是饱和食盐水,其作用是除去Cl2中混有的
(3)即使A装置中的MnO2和D装置中的Cu都是足量的,100mL 12mol/L浓盐酸经充分反应后得到的CuCl2也不足0.3mol,其原因是
A.装置漏气 B.A装置在加热过程中盐酸易挥发
C.CuCl2潮解吸水 D.A装置中反应生成的水要稀释盐酸,剩余的盐酸不再反应
(4)某实验小组的同学用经Cl2消毒的自来水配制下列溶液:①KI;②AgNO3;③AlCl3;④FeCl2;⑤稀盐酸,发现部分药品变质,它们是(请用序号作答)
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)
(6)一定条件下,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应。生成物中含有三种含氯元素的离子,其中ClO-、ClO
 两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
该过程中参加反应Cl2的物质的量是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】以 、
、 和KOH溶液为原料可制备高效水处理剂
和KOH溶液为原料可制备高效水处理剂 并测定样品中总铁的含量。
并测定样品中总铁的含量。
已知 具有下列性质:①紫色固体,可溶于水、微溶于浓KOH溶液,
具有下列性质:①紫色固体,可溶于水、微溶于浓KOH溶液,
②在0℃~5℃、强碱性溶液中比较稳定。
(1)制备 粗产品。在搅拌下将
粗产品。在搅拌下将 通入盛有
通入盛有 和KOH溶液的三颈瓶中(装置见图)。充分反应后,得到紫色固体和溶液,过滤得
和KOH溶液的三颈瓶中(装置见图)。充分反应后,得到紫色固体和溶液,过滤得 粗产品。
粗产品。
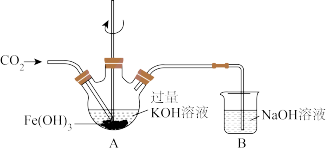
①装置A中 转化为
转化为 的离子方程式为
的离子方程式为_______ 。
②装置B的作用是_______ 。
③实验过程中应控制装置A中反应在0℃~5℃进行,实验中可采取的措施是_______ 。
(2)提纯 粗产品[含有
粗产品[含有 、KCl等杂质]的实验方案为:
、KCl等杂质]的实验方案为:_______ (实验中须使用的试剂有:稀KOH溶液、饱和KOH溶液,乙醇:除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱)。
(3) 样品纯度测定。实验检测原理为:
样品纯度测定。实验检测原理为:

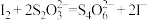
准确称取0.1400g样品,置于碘量瓶中,加入适量NaOH溶液和过量KI溶液,用玻璃棒将液面下样品颗粒压碎,使其充分溶解,加稀硫酸酸化,密封在暗处静置40min;用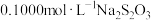 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点。平行滴定3次,平均消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点。平行滴定3次,平均消耗 溶液20.00mL。计算
溶液20.00mL。计算 样品的纯度:
样品的纯度:_______ (写出计算过程)。
 、
、 和KOH溶液为原料可制备高效水处理剂
和KOH溶液为原料可制备高效水处理剂 并测定样品中总铁的含量。
并测定样品中总铁的含量。已知
 具有下列性质:①紫色固体,可溶于水、微溶于浓KOH溶液,
具有下列性质:①紫色固体,可溶于水、微溶于浓KOH溶液,②在0℃~5℃、强碱性溶液中比较稳定。
(1)制备
 粗产品。在搅拌下将
粗产品。在搅拌下将 通入盛有
通入盛有 和KOH溶液的三颈瓶中(装置见图)。充分反应后,得到紫色固体和溶液,过滤得
和KOH溶液的三颈瓶中(装置见图)。充分反应后,得到紫色固体和溶液,过滤得 粗产品。
粗产品。
①装置A中
 转化为
转化为 的离子方程式为
的离子方程式为②装置B的作用是
③实验过程中应控制装置A中反应在0℃~5℃进行,实验中可采取的措施是
(2)提纯
 粗产品[含有
粗产品[含有 、KCl等杂质]的实验方案为:
、KCl等杂质]的实验方案为:(3)
 样品纯度测定。实验检测原理为:
样品纯度测定。实验检测原理为:
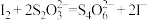
准确称取0.1400g样品,置于碘量瓶中,加入适量NaOH溶液和过量KI溶液,用玻璃棒将液面下样品颗粒压碎,使其充分溶解,加稀硫酸酸化,密封在暗处静置40min;用
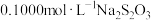 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点。平行滴定3次,平均消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点。平行滴定3次,平均消耗 溶液20.00mL。计算
溶液20.00mL。计算 样品的纯度:
样品的纯度:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】实验室合成溴苯的装置图(夹持装置略)及有关数据如下,按下列步骤回答有关问题。
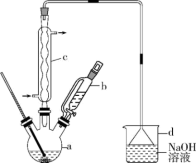
(1)实验装置中,仪器c的名称为_____ ,作用为_____ 。
(2)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白雾产生,是因为生成了HBr气体,继续滴加至液溴滴完。写出a中发生反应的化学方程式:____ 和____ 。
(3)液溴滴完后,经过下列步骤分离、提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑。
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。用NaOH溶液洗涤的目的是_____ 。
③向分出的粗溴苯中加入少量的无水氯化钙(一种干燥剂),静置、过滤。加入无水氯化钙的目的是____ 。
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为_____ 。

| 苯 | 溴 | 溴苯 | |
| 密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解性 | 微溶 | 微溶 | 微溶 |
(2)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白雾产生,是因为生成了HBr气体,继续滴加至液溴滴完。写出a中发生反应的化学方程式:
(3)液溴滴完后,经过下列步骤分离、提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑。
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。用NaOH溶液洗涤的目的是
③向分出的粗溴苯中加入少量的无水氯化钙(一种干燥剂),静置、过滤。加入无水氯化钙的目的是
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】实验室用少量的溴和足量的乙醇制备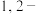 二溴乙烷的装置(加热、夹持装置已略去)如图所示:
二溴乙烷的装置(加热、夹持装置已略去)如图所示:
提示:乙醇在浓硫酸作用下140℃时反应生成乙醛,170℃时反应生成乙烯。有关数据列表如下:
回答下列问题:
(1)装置D中发生的主要反应的化学方程式为_______ 。
(2)装置B的作用是_______ ,长玻璃管E的作用是_______ 。
(3)在装置C中应加入_______ (填字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)反应过程中应用冷水冷却装置D,其主要目的是_______ ;但又不能过度冷却(如用冰水),其原因是_______ ;将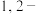 二溴乙烷粗产品置于分液漏斗中,加水,振荡后静置,产物应在
二溴乙烷粗产品置于分液漏斗中,加水,振荡后静置,产物应在_______ 层(填“上”或“下”)。
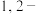 二溴乙烷的装置(加热、夹持装置已略去)如图所示:
二溴乙烷的装置(加热、夹持装置已略去)如图所示:
提示:乙醇在浓硫酸作用下140℃时反应生成乙醛,170℃时反应生成乙烯。有关数据列表如下:
| 乙醇 | 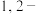 二溴乙烷 二溴乙烷 | 乙醚 | |
| 常温下状态 | 无色液体 | 无色液体 | 无色液体 |
密度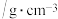 | 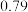 |  |  |
| 沸点/℃ | 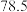 | 132 | 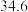 |
| 熔点/℃ | 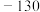 | 9 |  |
(1)装置D中发生的主要反应的化学方程式为
(2)装置B的作用是
(3)在装置C中应加入
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)反应过程中应用冷水冷却装置D,其主要目的是
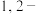 二溴乙烷粗产品置于分液漏斗中,加水,振荡后静置,产物应在
二溴乙烷粗产品置于分液漏斗中,加水,振荡后静置,产物应在
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】碘和碘的化合物在有机化学中十分重要,另外在医药和照相方面的用途也很广泛。海带提碘的相关流程如下所示,已知 ,请回答下列问题:
,请回答下列问题:
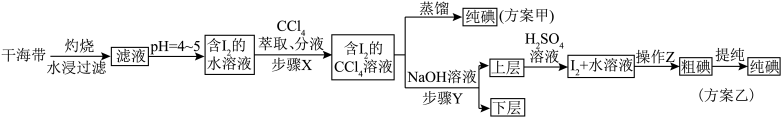
(1)海带灼烧的目的是_______ ;实验室进行此操作用到的主要仪器名称为_______ 。
(2)滤液得到含 的水溶液,除了调节
的水溶液,除了调节 ,还需要加入臭氧或过氧化氢,所加试剂在反应中作
,还需要加入臭氧或过氧化氢,所加试剂在反应中作_______ 剂(填“氧化”或“还原”),写出加入过氧化氢时发生反应的离子方程式:_______ 。
(3)步骤 是否可以用酒精代替
是否可以用酒精代替 ,并说明理由
,并说明理由_______ 。
(4)步骤 的操作为
的操作为_______ 。
(5)上层液体加入 溶液后发生反应的离子方程式为
溶液后发生反应的离子方程式为_______ 。
(6)以上流程中可以循环使用的试剂是_______ 。
(7)加碘食盐中的碘以碘酸钾 形式存在,根据以上信息,可用试纸和一些常见试剂进行检验,证明食盐中存在
形式存在,根据以上信息,可用试纸和一些常见试剂进行检验,证明食盐中存在 。可供选用的物质有:①
。可供选用的物质有:① 试纸、②蓝色石蕊试纸、③碘化钾淀粉试纸、④蒸馏水、⑤食醋、⑥醇,进行上述实验时必须使用的物质是
试纸、②蓝色石蕊试纸、③碘化钾淀粉试纸、④蒸馏水、⑤食醋、⑥醇,进行上述实验时必须使用的物质是_______ (填序号)。
 ,请回答下列问题:
,请回答下列问题:
(1)海带灼烧的目的是
(2)滤液得到含
 的水溶液,除了调节
的水溶液,除了调节 ,还需要加入臭氧或过氧化氢,所加试剂在反应中作
,还需要加入臭氧或过氧化氢,所加试剂在反应中作(3)步骤
 是否可以用酒精代替
是否可以用酒精代替 ,并说明理由
,并说明理由(4)步骤
 的操作为
的操作为(5)上层液体加入
 溶液后发生反应的离子方程式为
溶液后发生反应的离子方程式为(6)以上流程中可以循环使用的试剂是
(7)加碘食盐中的碘以碘酸钾
 形式存在,根据以上信息,可用试纸和一些常见试剂进行检验,证明食盐中存在
形式存在,根据以上信息,可用试纸和一些常见试剂进行检验,证明食盐中存在 。可供选用的物质有:①
。可供选用的物质有:① 试纸、②蓝色石蕊试纸、③碘化钾淀粉试纸、④蒸馏水、⑤食醋、⑥醇,进行上述实验时必须使用的物质是
试纸、②蓝色石蕊试纸、③碘化钾淀粉试纸、④蒸馏水、⑤食醋、⑥醇,进行上述实验时必须使用的物质是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】混合物分离的方法在生产、生活和科学实验中有着广泛的应用,请指出下列做法中分别应用了哪些分离方法。
(1)除去豆浆中的颗粒物杂质______________
(2)用海水晒盐___________________
(3)除去豆油中的水____________________
(4)从碘水中提取碘_______________
(1)除去豆浆中的颗粒物杂质
(2)用海水晒盐
(3)除去豆油中的水
(4)从碘水中提取碘
您最近一年使用:0次
【推荐3】金属矿物资源以及海水资源的综合利用有着非常重要的意义。
(1)高炉炼铁的主要反应是:3CO+Fe2O3 2Fe+3CO2,生产中所需焦炭的量远远高于按照方程式计算所需的量。焦炭的作用为
2Fe+3CO2,生产中所需焦炭的量远远高于按照方程式计算所需的量。焦炭的作用为_______ 。
(2)从海带中提取碘的实验过程如图所示:
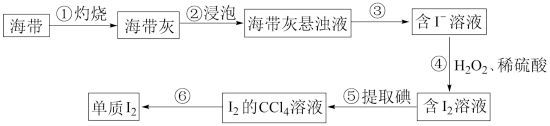
步骤①用到的仪器除酒精灯、三脚架外,还需要_______ 。步骤③的操作名称为_______ 。步骤④中发生反应的离子方程式为_______ 。
(3)冶炼得到的铁粉和海带中提取的碘可以用于生产KI,其工艺流程如图所示:
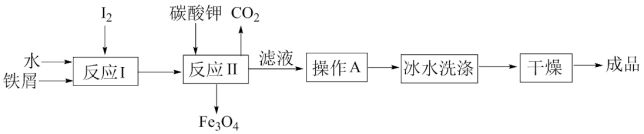
①操作A包括_______ 、_______ 、过滤。
②用冰水洗涤的目的为_______ 。
③反应I生成了铁与碘的化合物X,测得X中铁元素与碘元素的质量比为21:127,则X的化学式为____ ;反应II中1molX完全反应生成89.6L(标准状况下)CO2,写出反应II的化学方程式_____ 。
(1)高炉炼铁的主要反应是:3CO+Fe2O3
 2Fe+3CO2,生产中所需焦炭的量远远高于按照方程式计算所需的量。焦炭的作用为
2Fe+3CO2,生产中所需焦炭的量远远高于按照方程式计算所需的量。焦炭的作用为(2)从海带中提取碘的实验过程如图所示:

步骤①用到的仪器除酒精灯、三脚架外,还需要
(3)冶炼得到的铁粉和海带中提取的碘可以用于生产KI,其工艺流程如图所示:

①操作A包括
②用冰水洗涤的目的为
③反应I生成了铁与碘的化合物X,测得X中铁元素与碘元素的质量比为21:127,则X的化学式为
您最近一年使用:0次



