氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
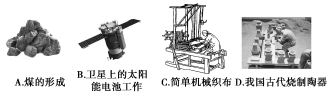
(1)下列生产、生活中的事例中没有发生氧化还原反应的是___________ (填写字母代号)
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”可用如图表达。
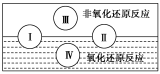
试写出由水和金属参加符合反应类型Ⅳ的一个化学方程式:___________ ,其中水为___________ 剂。
(3)在焊接铜器时常用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:______CuO+_____NH4Cl ____Cu+____CuCl2+____N2↑+____H2O
____Cu+____CuCl2+____N2↑+____H2O
①配平此氧化还原反应方程式___________ 。
②该反应中,被氧化的元素是___________ (填元素名称),氧化剂是___________ (填化学式)。
③反应中氧化剂和还原剂的物质的量之比为:___________ 。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是

(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”可用如图表达。

试写出由水和金属参加符合反应类型Ⅳ的一个化学方程式:
(3)在焊接铜器时常用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:______CuO+_____NH4Cl
 ____Cu+____CuCl2+____N2↑+____H2O
____Cu+____CuCl2+____N2↑+____H2O①配平此氧化还原反应方程式
②该反应中,被氧化的元素是
③反应中氧化剂和还原剂的物质的量之比为:
更新时间:2021-04-19 16:10:03
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】I、高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾、次氯酸等还强。工业上制取高铁酸钠的化学方程式是(未配平):Fe(NO3)3+ NaOH + Cl2→ Na2FeO4+ NaNO3+ NaCl + H2O
(1)高铁酸钠中,铁元素的化合价是_______ ;上述制取铁酸钠的反应中,铁元素被_______ (填“还原”或“氧化”)。
(2)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂原因铁元素转化为Fe(OH)3胶体。用饱和氯化铁溶液制备Fe(OH)3胶体方法_______ 。
(3)电子工业常用30%的FeCl3溶液腐蚀覆在绝缘板上的铜箔,制造印刷电路板。
①少量的铜可以完全溶解在FeCl3溶液中,所发生反应的离子方程式为_______ 。
②除去FeCl3溶液中混有的FeCl2可加入或通入_______ 。
A、硝酸 B、稀硫酸 C、氯气 D、氢氧化钠
II、次磷酸(H3PO2)是一种精细磷化工产品,是一元中强酸,具有较强还原性。回答下列问题:
(4)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①利用H3PO2进行化学镀银反应中,氧化剂(Ag+)与还原剂(H3PO2)的物质的量之比为4∶1,则氧化产物为_______ (填化学式)。
②从分类来看,NaH2PO2属于_______ 。
a.正盐 b.酸式盐 c.钠盐 d.氧化物
(5)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。配平白磷与Ba(OH)2溶液反应的化学方程式_______ 。
_______P4 +_______Ba(OH)2 + _______H2O —— _______Ba(H2PO2)2+_______PH3↑
(1)高铁酸钠中,铁元素的化合价是
(2)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂原因铁元素转化为Fe(OH)3胶体。用饱和氯化铁溶液制备Fe(OH)3胶体方法
(3)电子工业常用30%的FeCl3溶液腐蚀覆在绝缘板上的铜箔,制造印刷电路板。
①少量的铜可以完全溶解在FeCl3溶液中,所发生反应的离子方程式为
②除去FeCl3溶液中混有的FeCl2可加入或通入
A、硝酸 B、稀硫酸 C、氯气 D、氢氧化钠
II、次磷酸(H3PO2)是一种精细磷化工产品,是一元中强酸,具有较强还原性。回答下列问题:
(4)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①利用H3PO2进行化学镀银反应中,氧化剂(Ag+)与还原剂(H3PO2)的物质的量之比为4∶1,则氧化产物为
②从分类来看,NaH2PO2属于
a.正盐 b.酸式盐 c.钠盐 d.氧化物
(5)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。配平白磷与Ba(OH)2溶液反应的化学方程式
_______P4 +_______Ba(OH)2 + _______H2O —— _______Ba(H2PO2)2+_______PH3↑
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
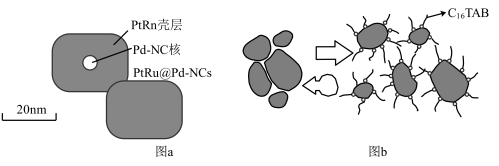
【推荐2】PtRu@Pd纳米核壳材料是氢能源燃料电池的重要催化剂。某研究团队提出一种可重复制备该催化剂的方案,步骤如下:
步骤一、在95℃下,将 溶液加入一定量十六烷基三甲基溴化铵(
溶液加入一定量十六烷基三甲基溴化铵(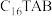 )水溶液中。
)水溶液中。
步骤二、向混合溶液中逐渐加入一定量 的碱性水溶液,持续搅拌30分钟,离心分离,多次洗涤,得到Pd纳米颗粒。
的碱性水溶液,持续搅拌30分钟,离心分离,多次洗涤,得到Pd纳米颗粒。
步骤三、将所得Pd纳米颗粒分散在超纯水中,添加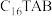 后搅拌。加入特定组成的PtRu前体,再加入
后搅拌。加入特定组成的PtRu前体,再加入 的碱性水溶液,80℃下搅拌3小时,离心洗涤后得到PtRu@Pd纳米核壳材料(如图a)。
的碱性水溶液,80℃下搅拌3小时,离心洗涤后得到PtRu@Pd纳米核壳材料(如图a)。
已知:十六烷基三甲基溴化铵(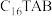 )是一种表面活性剂,其工作原理如图b所示:
)是一种表面活性剂,其工作原理如图b所示:
回答下列问题:
(1)配制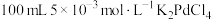 溶液所需的玻璃仪器有量筒、烧杯、玻璃棒、
溶液所需的玻璃仪器有量筒、烧杯、玻璃棒、_______ 。
(2) 的电子式为
的电子式为_______ ;配平并完成 与
与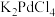 反应制备纳米Pd的离子方程式:
反应制备纳米Pd的离子方程式:_______ 。 其中
其中 可用以下
可用以下_______ 代替(填标号)。
A.亚硫酸钾 B.氯水 C.硝酸 D.维生素C
(3)步骤二中多次洗涤的目的是为了得到纯净的Pd纳米颗粒,检验其洗净的方法是_______ 。
(4)步骤三中保持温度为80℃的方法是_______ 。
(5)在整个过程中,十六烷基三甲基溴化铵(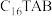 )的作用是
)的作用是_______ 。
步骤一、在95℃下,将
 溶液加入一定量十六烷基三甲基溴化铵(
溶液加入一定量十六烷基三甲基溴化铵(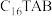 )水溶液中。
)水溶液中。步骤二、向混合溶液中逐渐加入一定量
 的碱性水溶液,持续搅拌30分钟,离心分离,多次洗涤,得到Pd纳米颗粒。
的碱性水溶液,持续搅拌30分钟,离心分离,多次洗涤,得到Pd纳米颗粒。步骤三、将所得Pd纳米颗粒分散在超纯水中,添加
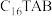 后搅拌。加入特定组成的PtRu前体,再加入
后搅拌。加入特定组成的PtRu前体,再加入 的碱性水溶液,80℃下搅拌3小时,离心洗涤后得到PtRu@Pd纳米核壳材料(如图a)。
的碱性水溶液,80℃下搅拌3小时,离心洗涤后得到PtRu@Pd纳米核壳材料(如图a)。已知:十六烷基三甲基溴化铵(
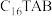 )是一种表面活性剂,其工作原理如图b所示:
)是一种表面活性剂,其工作原理如图b所示:
回答下列问题:
(1)配制
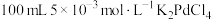 溶液所需的玻璃仪器有量筒、烧杯、玻璃棒、
溶液所需的玻璃仪器有量筒、烧杯、玻璃棒、(2)
 的电子式为
的电子式为 与
与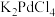 反应制备纳米Pd的离子方程式:
反应制备纳米Pd的离子方程式: 其中
其中 可用以下
可用以下A.亚硫酸钾 B.氯水 C.硝酸 D.维生素C
(3)步骤二中多次洗涤的目的是为了得到纯净的Pd纳米颗粒,检验其洗净的方法是
(4)步骤三中保持温度为80℃的方法是
(5)在整个过程中,十六烷基三甲基溴化铵(
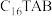 )的作用是
)的作用是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】高锰酸钾(KMnO4)是一种广泛使用的氧化剂和消毒剂。
(1)用酸性KMnO4溶液测定室内甲醛含量,产物中含有Mn2+和CO2,请推测该反应的离子方程式_______ 。
(2)将室内气体通入50 mL1×10-3 mol/L酸性KMnO4溶液中,通入5 L时,溶液颜色恰好变为无色,计算室内甲醛的浓度为_______ mg/L;
(3)上述酸性KMnO4是指用硫酸酸化的KMnO4溶液,请说明不使用盐酸酸化的理由_______ ,离子方程式为_______ 。
(4)配制KMnO4溶液,定容操作的方法为_______ 。
(5)KMnO4溶液与明矾溶液混合后,发生复分解反应,生成深紫色沉淀,写出该反应的化学方程式_______ 。
(6)KMnO4溶液与双氧水混合后,会产生气泡,这说明双氧水具有_______ 性。
(7)某种烃的相对分子质量为92,易使酸性KMnO4溶液褪色,但不能使溴水因发生化学变化而褪色,则该烃的结构简式为_______ 。
(1)用酸性KMnO4溶液测定室内甲醛含量,产物中含有Mn2+和CO2,请推测该反应的离子方程式
(2)将室内气体通入50 mL1×10-3 mol/L酸性KMnO4溶液中,通入5 L时,溶液颜色恰好变为无色,计算室内甲醛的浓度为
(3)上述酸性KMnO4是指用硫酸酸化的KMnO4溶液,请说明不使用盐酸酸化的理由
(4)配制KMnO4溶液,定容操作的方法为
(5)KMnO4溶液与明矾溶液混合后,发生复分解反应,生成深紫色沉淀,写出该反应的化学方程式
(6)KMnO4溶液与双氧水混合后,会产生气泡,这说明双氧水具有
(7)某种烃的相对分子质量为92,易使酸性KMnO4溶液褪色,但不能使溴水因发生化学变化而褪色,则该烃的结构简式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】KClO3和浓盐酸在不同温度下反应,发生以下两个反应。其变化可表示为
反应1:2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O
反应2:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
(1)已知反应1的还原产物为黄绿色的二氧化氯,该反应中被还原的是_________ (填化学式),产生0.1 mol Cl2时,转移的电子的物质的量为_____ 。
(2)反应2中氧化产物和还原产物的物质的量之比是_____ 。
(3)上述反应中浓盐酸表现的性质是(填写编号):反应1中为_________ ,反应2中为_________ 。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)将少量氯气通入NaBr溶液中,发生反应的离子方程式是Cl2+2Br-=2Cl-+Br2。将少量氯气通入FeBr2溶液中,发生反应的离子方程式是Cl2+2Fe2+=2Cl-+2Fe3+,将少量氯气通入FeI2溶液中,发生反应的离子方程式是Cl2+2I-=2Cl-+I2,这个事实说明上述反应中具有还原性粒子I-、Br-、Cl-、Fe2+的还原性由强到弱的顺序是________ ,标况下,将22.4 LCl2通入2 L 0.5 mol/L的FeBr2溶液中,发生反应的离子方程式_____________ 标况下,将22.4 LCl2通入2 L 0.5 mol/L的FeI2溶液中,发生反应的离子方程式_____________ 。
反应1:2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O
反应2:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
(1)已知反应1的还原产物为黄绿色的二氧化氯,该反应中被还原的是
(2)反应2中氧化产物和还原产物的物质的量之比是
(3)上述反应中浓盐酸表现的性质是(填写编号):反应1中为
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)将少量氯气通入NaBr溶液中,发生反应的离子方程式是Cl2+2Br-=2Cl-+Br2。将少量氯气通入FeBr2溶液中,发生反应的离子方程式是Cl2+2Fe2+=2Cl-+2Fe3+,将少量氯气通入FeI2溶液中,发生反应的离子方程式是Cl2+2I-=2Cl-+I2,这个事实说明上述反应中具有还原性粒子I-、Br-、Cl-、Fe2+的还原性由强到弱的顺序是
您最近一年使用:0次
【推荐2】一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu→Cu2++2e-,还原反应式:2Fe3++2e-→2Fe2+.在稀硫酸中,KMnO4和H2O2能发生氧化还原反应5H2O2+2MnO +6H+===5O2↑+2Mn2++8H2O。
+6H+===5O2↑+2Mn2++8H2O。
(1)将此氧化还原反应拆成半反应式,氧化式:_________ ,还原式:_________ 。
(2)反应中氧化剂是________ ;被氧化元素是__________ ;若有0.5 mol H2O2参加此反应,电子转移个数为____________ 。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为________________________ ;这时若有0.5 mol H2O2发生分解,电子转移个数为______ 。
 +6H+===5O2↑+2Mn2++8H2O。
+6H+===5O2↑+2Mn2++8H2O。(1)将此氧化还原反应拆成半反应式,氧化式:
(2)反应中氧化剂是
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】新型冠状病毒肺炎爆发以来,各类杀菌消毒剂逐渐被人们所认识和使用。下列是我们常见的几种消毒剂:①“84”消毒液;②H2O2(在水中一部分可以电离出阴、阳离子);③ClO2;④O3;⑤碘酒;⑥75%酒精;⑦过氧乙酸(CH3COOOH);⑧高铁酸钠(Na2FeO4)。回答下列问题:
(1)上述杀菌消毒剂属于电解质的是___________ (填序号),“84”消毒液中有效成分的电离方程式为___________ 。
(2)各类杀菌消毒剂使用时,必须严格按照使用说明。
①巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO___________ H2O2的(填“>”或“<”)。
②若混合使用“洁厕灵”(盐酸是成分之一)与“84”消毒液会产生氯气。原因是___________ (用离子方程式表示)。
(3)某同学参阅“84”消毒液的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。若配制一定物质的量浓度的上述消毒液480mL,需要选用下图所示的哪些仪器___________ (填序号),除这些仪器以外还需要的玻璃仪器有___________ (填仪器名称)。

(1)上述杀菌消毒剂属于电解质的是
(2)各类杀菌消毒剂使用时,必须严格按照使用说明。
①巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO
②若混合使用“洁厕灵”(盐酸是成分之一)与“84”消毒液会产生氯气。原因是
(3)某同学参阅“84”消毒液的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。若配制一定物质的量浓度的上述消毒液480mL,需要选用下图所示的哪些仪器

您最近一年使用:0次



