分别按如图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中Ⓐ为电流表。请回答下列问题:
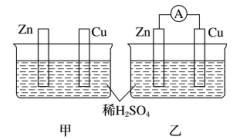
(1)以下叙述中,正确的是___________ (填字母)。
A.甲中锌片是负极,乙中铜片是正极 B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大 D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu F.乙溶液中 向铜片方向移动
向铜片方向移动
(2)变化过程中能量转化的主要形式:甲为___________ ;乙为___________ 。
(3)某同学依据氧化还原反应: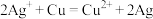 设计的原电池如图所示:
设计的原电池如图所示:
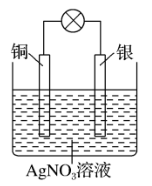
①负极的材料是___________ ,发生的电极反应为___________ ;
②外电路中的电子是从___________ 电极流向___________ 电极。(写出电极材料的名称)
③当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移的电子数目是___________ 。

(1)以下叙述中,正确的是
A.甲中锌片是负极,乙中铜片是正极 B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大 D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu F.乙溶液中
 向铜片方向移动
向铜片方向移动(2)变化过程中能量转化的主要形式:甲为
(3)某同学依据氧化还原反应:
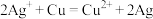 设计的原电池如图所示:
设计的原电池如图所示:
①负极的材料是
②外电路中的电子是从
③当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移的电子数目是
更新时间:2021-04-26 11:35:06
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】电化学装置可实现化学能与电能的直接转化,是助力实现“30、60”双碳目标的一种重要路径。
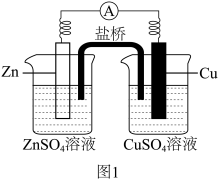
(1)图1所示的盐桥电池工作时,Zn为_______ 极(填“正”或“负”),Cu电极的电极反应式为_______ ,盐桥中的 移向
移向_______ 池(填“左”或“右”)。
(2)图2所示装置是用甲烷燃料电池电解饱和NaCl溶液的实验。
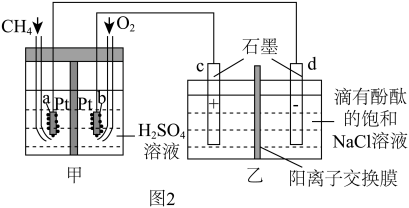
①甲烷燃料电池工作时,负极的电极反应式为_______ 。
②乙池工作时,电子由_______ (填“c”或“d”)极流出,电解总方程式为_______ ,d电极附近观察到的现象是_______ ,阳离子交换膜的作用是_______ (任写一点)。
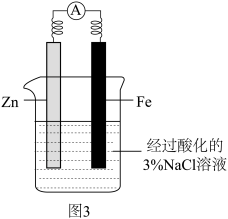
(3)图3是牺牲阳极保护法实验装置。请根据提供的试剂完成探究防止Fe腐蚀的实验方案:按图3所示连接装置,过一段时间,取Fe电极区域少量溶液于试管中,_______ ,说明铁片没有被腐蚀(即能有效防腐)。供选试剂:KSCN溶液、 溶液、新制氯水、
溶液、新制氯水、 (铁氰化钾)溶液、淀粉KI溶液
(铁氰化钾)溶液、淀粉KI溶液
(1)图1所示的盐桥电池工作时,Zn为
 移向
移向
(2)图2所示装置是用甲烷燃料电池电解饱和NaCl溶液的实验。

①甲烷燃料电池工作时,负极的电极反应式为
②乙池工作时,电子由
(3)图3是牺牲阳极保护法实验装置。请根据提供的试剂完成探究防止Fe腐蚀的实验方案:按图3所示连接装置,过一段时间,取Fe电极区域少量溶液于试管中,
 溶液、新制氯水、
溶液、新制氯水、 (铁氰化钾)溶液、淀粉KI溶液
(铁氰化钾)溶液、淀粉KI溶液
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】化学电源在生产生活中有着广泛的应用,请回答下列问颕:
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是___________(填字母,下同)。
(2)电子表和电子计算器中所用的是钮扣式的微型银锌电池,其电极分别为 和Zn,电解液为KOH溶液。工作时电池总反应为:
和Zn,电解液为KOH溶液。工作时电池总反应为: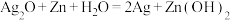 。
。
①工作时电流从___________ 极流向___________ 极(两空均选填“ ”或“Zn”);
”或“Zn”);
②负极的电极反应式为:___________ ;
③工作时电池正极区的pH___________ (选填“增大”“减小”或“不变”);
④外电路中每通过0.2mol电子,锌的质量理论上减少___________ g。
(3)理论上,任何自发的氧化还原反应都可以设计成原电池。请利用反应“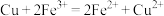 ”设计一种化学电池(正极材料用石墨棒),回答下列问题:
”设计一种化学电池(正极材料用石墨棒),回答下列问题:
①该电池的负极材料是___________ (填化学式),电解质溶液是___________ (填化学式)溶液。
②正极上发生的电极反应为___________ 。
③若导线上转移的电子为1mol,则消耗的金属铜的质量为___________ 。
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是___________(填字母,下同)。
A.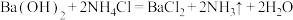 |
B. |
C. |
D. |
 和Zn,电解液为KOH溶液。工作时电池总反应为:
和Zn,电解液为KOH溶液。工作时电池总反应为: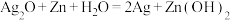 。
。①工作时电流从
 ”或“Zn”);
”或“Zn”);②负极的电极反应式为:
③工作时电池正极区的pH
④外电路中每通过0.2mol电子,锌的质量理论上减少
(3)理论上,任何自发的氧化还原反应都可以设计成原电池。请利用反应“
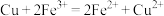 ”设计一种化学电池(正极材料用石墨棒),回答下列问题:
”设计一种化学电池(正极材料用石墨棒),回答下列问题:①该电池的负极材料是
②正极上发生的电极反应为
③若导线上转移的电子为1mol,则消耗的金属铜的质量为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】请回答下列问题:
(1)某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量的硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
①硫酸铜溶液可加快氢气生成速率的原因是_______ 。
②要加快上述实验中气体产生的速率,还可采取的措施有_______ (至少答两种)。
(2)把0.4mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) nZ(g)+6W(g),2min末已生成0.3mol W,若测知以Z的浓度变化表示的反应速率为0.05mol·L-1·min-1,请回答下列问题:
nZ(g)+6W(g),2min末已生成0.3mol W,若测知以Z的浓度变化表示的反应速率为0.05mol·L-1·min-1,请回答下列问题:
①化学反应方程式中n=_______ 。
②2min末,恢复到反应前温度,体系内压强是反应前压强的_______ 倍。
(1)某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量的硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
①硫酸铜溶液可加快氢气生成速率的原因是
②要加快上述实验中气体产生的速率,还可采取的措施有
(2)把0.4mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)
 nZ(g)+6W(g),2min末已生成0.3mol W,若测知以Z的浓度变化表示的反应速率为0.05mol·L-1·min-1,请回答下列问题:
nZ(g)+6W(g),2min末已生成0.3mol W,若测知以Z的浓度变化表示的反应速率为0.05mol·L-1·min-1,请回答下列问题:①化学反应方程式中n=
②2min末,恢复到反应前温度,体系内压强是反应前压强的
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图为某实验小组依据氧化还原反应:(用离子方程式表示)_____ 设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过_____ mol电子。

(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为_____ ,这是由于NH4Cl溶液显_____ (填“酸性”、“碱性”或“中性”)。用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量的氯水,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:“溶液中的+3价铁被氧化为更高价态。”如果+3价铁被氧化为FeO ,试写出反应的离子方程式
,试写出反应的离子方程式_____ 。
(1)如图为某实验小组依据氧化还原反应:(用离子方程式表示)

(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为
 ,试写出反应的离子方程式
,试写出反应的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】某研究性学习小组的同学对Zn.Cu、稀硫酸组成的原电池进行了探究,其中甲同学利用下图I装置进行探究,乙同学经过查阅资料后设计了图II装置进行探究( 盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。

(1)实验表明,图I中两个电极上均有气泡产生,锌电极上有气泡产生,说明反应中有一部分化学能转化为______ 能;铜电极上有气泡产生,说明反应中有一部分化学能转化为____ 能。
(2)图II中的X、Y 是ZnSO4溶液 及稀硫酸中的一种,实验过程中只有正极上产生气泡,则X 是
及稀硫酸中的一种,实验过程中只有正极上产生气泡,则X 是_________ ,正极上的电极反应式为__________ 。
(3)当图I装置的溶液质量增加63 g时,生成的氢气共有______ L( 标准状况);当图II 中锌电极质量减少65g时,电路中转移的电子数为______ NA。

(1)实验表明,图I中两个电极上均有气泡产生,锌电极上有气泡产生,说明反应中有一部分化学能转化为
(2)图II中的X、Y 是ZnSO4溶液
 及稀硫酸中的一种,实验过程中只有正极上产生气泡,则X 是
及稀硫酸中的一种,实验过程中只有正极上产生气泡,则X 是(3)当图I装置的溶液质量增加63 g时,生成的氢气共有
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】微生物电池可用来处理废水中的对氯苯酚,原理如图所示。
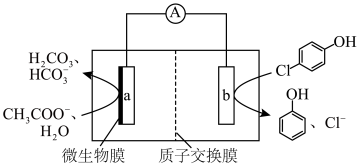
(1)该电池放电时,电子从______ (填“b→a”或“a→b”)。
(2)a极上生成H2CO3的电极反应为______ 。
(3)已知b极的电极反应为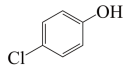 +2H++2e-=
+2H++2e-= +Cl-,经处理后的水样中要求对氯苯酚的含量小于mmol/L。若废水中对氯苯酚的含量是nmol/L,则处理1m3废水,至少添加CH3COO-的物质的量为
+Cl-,经处理后的水样中要求对氯苯酚的含量小于mmol/L。若废水中对氯苯酚的含量是nmol/L,则处理1m3废水,至少添加CH3COO-的物质的量为______ mol(溶液体积变化忽略不计)。

(1)该电池放电时,电子从
(2)a极上生成H2CO3的电极反应为
(3)已知b极的电极反应为
 +2H++2e-=
+2H++2e-= +Cl-,经处理后的水样中要求对氯苯酚的含量小于mmol/L。若废水中对氯苯酚的含量是nmol/L,则处理1m3废水,至少添加CH3COO-的物质的量为
+Cl-,经处理后的水样中要求对氯苯酚的含量小于mmol/L。若废水中对氯苯酚的含量是nmol/L,则处理1m3废水,至少添加CH3COO-的物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】在银锌原电池中,以硫酸铜溶液为电解质溶液。
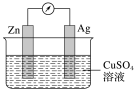
(1)锌为____ 极,电极上发生的是____ (填“氧化”或“还原”)反应。电极反应式为____ ,锌片上观察到的现象为________ 。
(2)银为________ 极,电极上发生的是_____ (填“氧化”或“还原”)反应,电极反应式是________ ,银片上观察到的现象是________ 。
(3)该电池中,每有2mol电子流过导线,负极___ (填“减少”或“增加”)___ g,正极____ (填“减少”或“增加”)________ g。

(1)锌为
(2)银为
(3)该电池中,每有2mol电子流过导线,负极
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】
(1)下图原电池装置中,Zn是______ 极(填电极的名称),Cu表面上有___________________ (现象),外电路电子由________ (填电极的名称)通过导线流向_______ (填电极的名称); 溶液中_______ 离子向Cu极移动,________ 离子向Zn极移动。
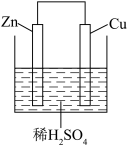
(2)写出电极反应式和总反应方程式:
Zn极:___________________________________________
Cu极:_________________________________________
总反应方程式:___________________________________
(1)下图原电池装置中,Zn是

(2)写出电极反应式和总反应方程式:
Zn极:
Cu极:
总反应方程式:
您最近一年使用:0次




