(1)写出下列反应的热化学方程式:8g甲烷在空气中燃烧,恢复常温,测得放出热量445kJ。_____________________________________________________ 。
(2)实验测得1mol H2与1mol Cl2完全反应放出184.6kJ的热量,又知1mol H2分子中化学键断裂时需要吸收436kJ的能量,1mol Cl2分子中化学键断裂需要吸收243kJ的能量。则1mol HCl分子中化学键断裂时需要吸收___________________ 的能量。
(3)CO2可转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
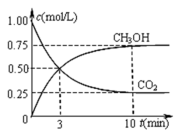
①在一恒温恒容密闭容器中充入1mol CO2和3mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图所示。回答:0~10min内,氢气的平均反应速率为________________ 。
②若反应在容积可变的容器中进行。缩小容器体积使压强增大,该反应的速率_________ (填“增大”、“减小”或“不变”)。
(2)实验测得1mol H2与1mol Cl2完全反应放出184.6kJ的热量,又知1mol H2分子中化学键断裂时需要吸收436kJ的能量,1mol Cl2分子中化学键断裂需要吸收243kJ的能量。则1mol HCl分子中化学键断裂时需要吸收
(3)CO2可转化为甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①在一恒温恒容密闭容器中充入1mol CO2和3mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图所示。回答:0~10min内,氢气的平均反应速率为
②若反应在容积可变的容器中进行。缩小容器体积使压强增大,该反应的速率
20-21高一下·福建福州·阶段练习 查看更多[2]
更新时间:2021-04-22 18:52:06
|
相似题推荐
【推荐1】试从化学键的角度理解化学反应中的能量变化。(以2H2+O2===2H2O为例说明),已知:E反表示反应物(2H2+O2)所具有的总能量,E生表示生成物(2H2O)所具有的总能量。又知:拆开1moL H2中的化学键需要吸收436kJ能量,拆开1moL O2中的化学键需要吸收496kJ能量,形成水分子中的1moLH—O键能够释放463KJ能量。
⑴从宏观角度看:反应物所具有的总能量高于生成物所具有的总能量,所以该反应要______ (填“吸收”或“放出”)能量,能量变化值的大小△E=_________ (用E反和E生表示)
⑵从微观角度看:断裂反应物中的化学键吸收的总能量为E吸=______ KJ;形成生成物中的化学键放出的总能量为=______ KJ。E吸______ E放(填“>”或“<”),所以该反应要_____ (填“吸收”或“放出”)能量,能量变化值的大小△E=____ KJ(填数值)
⑶由图可知,化学反应的本质是________________________________ 化学反应中能量变化的主要原因是________________ (从总能量说明)
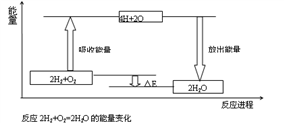
⑴从宏观角度看:反应物所具有的总能量高于生成物所具有的总能量,所以该反应要
⑵从微观角度看:断裂反应物中的化学键吸收的总能量为E吸=
⑶由图可知,化学反应的本质是

您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】(1)运动会中的火炬一般采用丙烷为燃料。丙烷燃烧放出的热量大,污染较小,是一种优良的燃料。试回答下列问题:

一定量的丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的焓的变化曲线如图所示,请在图中的括号内填____ “+”或“-”。
②写出表示丙烷燃烧热的热化学方程式:__________________________________________________ 。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和H2O(l)时放出1 455 kJ热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和H2O(l)时共放出1 645 kJ热量,则混合气体中丙烷和二甲醚的物质的量之比为______________________ 。
(2)运用盖斯定律回答下列问题:
碳(s)在氧气供应不充足时,生成CO的同时还部分生成CO2,因此无法通过实验直接测得反应C(s)+ O2(g)===CO(g)的ΔH。但可设计实验,并利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有
O2(g)===CO(g)的ΔH。但可设计实验,并利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有___________ 。

一定量的丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的焓的变化曲线如图所示,请在图中的括号内填
②写出表示丙烷燃烧热的热化学方程式:
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和H2O(l)时放出1 455 kJ热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和H2O(l)时共放出1 645 kJ热量,则混合气体中丙烷和二甲醚的物质的量之比为
(2)运用盖斯定律回答下列问题:
碳(s)在氧气供应不充足时,生成CO的同时还部分生成CO2,因此无法通过实验直接测得反应C(s)+
 O2(g)===CO(g)的ΔH。但可设计实验,并利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有
O2(g)===CO(g)的ΔH。但可设计实验,并利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐1】请根据化学反应与热能的有关知识,填写下列空白:
I. (1)下列ΔH表示物质燃烧热的是________ ;表示反应中和热ΔH=-57.3 kJ·mol-1的是________ (填“ΔH1”“ΔH2”和“ΔH3”等)。
A.C(s)+ O2(g)===CO(g) ΔH1
O2(g)===CO(g) ΔH1
B.2H2(g)+O2(g)===2H2O(l) ΔH2
C.C(s)+O2(g)===CO2(g) ΔH3
D. Ba(OH)2(aq)+
Ba(OH)2(aq)+ H2SO4(aq)===
H2SO4(aq)=== BaSO4(s)+H2O(l) ΔH4
BaSO4(s)+H2O(l) ΔH4
E.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH5
F.2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l) ΔH6
(2)化学反应的能量变化(ΔH)与反应物和生成物的键能有关(键能可以简单理解为断开1 mol化学键时所需吸收的能量),下表是部分化学键的键能数据:

已知白磷(P4)的燃烧热为2 378 kJ·mol-1,白磷完全燃烧的产物(P4O10)的结构如上图所示,则上表中a=________ (保留到整数)。
II.已知2mol氢气燃烧生成液态水时放出572KJ热量,反应的热化学方程式是2H2(g)+O2(g)=2H2O(l) △H=-572KJ·mol-1。
(3)该反应生成物的能量总和______ (填“大于”“小于”或“等于”)反应物的能量总和。
(4)若2mol氢气完全燃烧生成水蒸气,则放出的热量_______ (填“>”“<”或“=”)572KJ。
III.(5)已知16g固体硫完全燃烧时放出148.4KJ的热量,写出表示硫的燃烧热的热化学方程式:____________________________________ 。
(6)如图所示是1 mol NO2和CO反应生成CO2和NO过程中能量变化示意图,

请写出NO2和CO反应的热化学方程式:_______________________________ 。
I. (1)下列ΔH表示物质燃烧热的是
A.C(s)+
 O2(g)===CO(g) ΔH1
O2(g)===CO(g) ΔH1B.2H2(g)+O2(g)===2H2O(l) ΔH2
C.C(s)+O2(g)===CO2(g) ΔH3
D.
 Ba(OH)2(aq)+
Ba(OH)2(aq)+ H2SO4(aq)===
H2SO4(aq)=== BaSO4(s)+H2O(l) ΔH4
BaSO4(s)+H2O(l) ΔH4E.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH5
F.2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l) ΔH6
(2)化学反应的能量变化(ΔH)与反应物和生成物的键能有关(键能可以简单理解为断开1 mol化学键时所需吸收的能量),下表是部分化学键的键能数据:
| 化学键 | P—P | P—O | O=O | P=O |
| 键能(kJ·mol-1) | a | 360 | 500 | 434 |

已知白磷(P4)的燃烧热为2 378 kJ·mol-1,白磷完全燃烧的产物(P4O10)的结构如上图所示,则上表中a=
II.已知2mol氢气燃烧生成液态水时放出572KJ热量,反应的热化学方程式是2H2(g)+O2(g)=2H2O(l) △H=-572KJ·mol-1。
(3)该反应生成物的能量总和
(4)若2mol氢气完全燃烧生成水蒸气,则放出的热量
III.(5)已知16g固体硫完全燃烧时放出148.4KJ的热量,写出表示硫的燃烧热的热化学方程式:
(6)如图所示是1 mol NO2和CO反应生成CO2和NO过程中能量变化示意图,

请写出NO2和CO反应的热化学方程式:
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】化学反应与能量变化是化学研究的重要问题,根据相关材料分析回答:
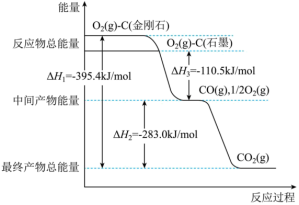
(1)在一定相同条件下,金刚石和石墨燃烧反应中的能量变化如图所示。
_______ 。金刚石的稳定性_______ 石墨(填“>”、“=”或“<”)
(2)已知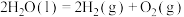
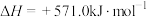 ,工业生产利用两步热循环制
,工业生产利用两步热循环制 ,
,
第一步以太阳能为热源分解 ,第二步:FeO与水反应获得
,第二步:FeO与水反应获得 。
。
第一步: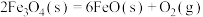
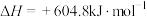 。
。
请写出第二步反应的热化学方程式_______ 。
(3)甲烷是常见的燃料, 加氢可制备甲烷,其反应为
加氢可制备甲烷,其反应为
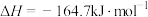 。对于
。对于 加氢制备甲烷的反应,有关说法正确的是_______。
加氢制备甲烷的反应,有关说法正确的是_______。
(1)在一定相同条件下,金刚石和石墨燃烧反应中的能量变化如图所示。

(2)已知
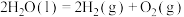
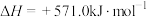 ,工业生产利用两步热循环制
,工业生产利用两步热循环制 ,
,第一步以太阳能为热源分解
 ,第二步:FeO与水反应获得
,第二步:FeO与水反应获得 。
。第一步:
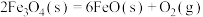
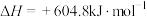 。
。请写出第二步反应的热化学方程式
(3)甲烷是常见的燃料,
 加氢可制备甲烷,其反应为
加氢可制备甲烷,其反应为
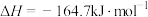 。对于
。对于 加氢制备甲烷的反应,有关说法正确的是_______。
加氢制备甲烷的反应,有关说法正确的是_______。| A.该反应理论上可以设计成原电池 |
| B.该反应过程中既有极性共价键的断裂,又有非极性共价键的生成 |
C.干冰变为 时破坏了内部的化学键 时破坏了内部的化学键 |
| D.反应结束,体系中物质的总能量降低 |
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】请按要求书写化学用语
(1)实验室制取氯气离子方程式:___________ 。
(2)工业制漂白粉的化学方程式:___________ 。
(3)碳酸氢钠溶液中滴加少量澄清石灰水的离子方程式:___________ 。
(4)2.3克钠放在100克水中放出aKJ热量的热化学方程式:___________ 。
(5)用NaClO和Fe2(SO4)3在碱性条件下制备高铁酸钠(Na2FeO4)的离子方程式___________ 。
(1)实验室制取氯气离子方程式:
(2)工业制漂白粉的化学方程式:
(3)碳酸氢钠溶液中滴加少量澄清石灰水的离子方程式:
(4)2.3克钠放在100克水中放出aKJ热量的热化学方程式:
(5)用NaClO和Fe2(SO4)3在碱性条件下制备高铁酸钠(Na2FeO4)的离子方程式
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】T ℃时,在0.5 L的密闭容器中,反应过程中A、B、C的浓度变化如图所示:

(1)10s内v(B)=_______ 。
(2)该反应的化学方程式为_______ 。

(1)10s内v(B)=
(2)该反应的化学方程式为
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】将一定质量的H2和N2混合物通入2L密闭容器中发生反应N2+3H2 2NH3,5min后N2的减少了1mol。回答下列问题:
2NH3,5min后N2的减少了1mol。回答下列问题:
(1)N2的物质的量浓度变化是___________ mol/L。
(2)H2的物质的量变化是___________ mol。
(3)从开始到5min时NH3的平均反应速率是___________ mol/(L▪min)。
(4)下列措施能加快该化学反应速率的是___________
(5)下列叙述说明反应已经达到化学平衡状态的是___________
A.混合气体的总物质的量不再变化 B.容器内原子总数不再变化 C.NH3的浓度不再变化
D.混合气体的密度不再变化 E.混合气体中各组分的体积分数不再变化
 2NH3,5min后N2的减少了1mol。回答下列问题:
2NH3,5min后N2的减少了1mol。回答下列问题:(1)N2的物质的量浓度变化是
(2)H2的物质的量变化是
(3)从开始到5min时NH3的平均反应速率是
(4)下列措施能加快该化学反应速率的是___________
| A.升高温度 | B.降低温度 | C.通入N2 | D.增大容器体积 |
A.混合气体的总物质的量不再变化 B.容器内原子总数不再变化 C.NH3的浓度不再变化
D.混合气体的密度不再变化 E.混合气体中各组分的体积分数不再变化
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】Ⅰ.一定温度下,在容积为V L的密闭容器中进行反应:aN(g) bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
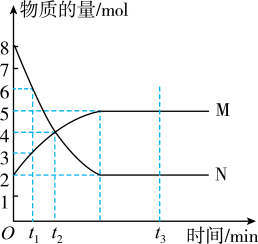
(1)此反应的化学方程式中a/b=___________ ;
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为_________________ ;
(3) N的平衡转化率为_______________ ;
(4)下列叙述中能说明上述反应达到平衡状态的是___________ (填字母)。
a.反应中M与N的物质的量之比为1︰1
b.混合气体的总质量不随时间的变化而变化
c.混合气体的总物质的量不随时间的变化而变化
d.单位时间内每消耗a mol N,同时生成b mol M
e.混合气体的压强不随时间的变化而变化
f.N的质量分数在混合气体中保持不变
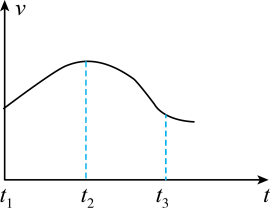
Ⅱ.研究性学习小组为探究铁与稀盐酸反应,取同质量、体积的铁片、同浓度的盐酸做了下列平行实验:
实验①:把纯铁片投入到盛有稀盐酸的试管中,发现放出氢气的速率变化如图所示:
实验②:把铁片投入到含FeCl3的同浓度稀盐酸中,发现放出氢气的量减少。
实验③:在稀盐酸中滴入几滴CuCl2溶液,用铁片做实验,发现生成氢气的速率加快。
试回答下列问题:
(1)分析实验①中t1~t2速率变化的主要原因是_______ ,t2~t3速率变化的主要原因是______ 。
(2)实验②放出氢气的量减少的原因是___________________ (用离子方程式表示)。
(3)某同学认为实验③反应速率加快的主要原因是形成了原电池,你认为是否正确?请选择下列相应的a或b作答。a.若不正确,请说明原因_____________________________________ 。b.若正确,则写出实验③中原电池的正极电极反应式_______________________ 。
 bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中a/b=
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为
(3) N的平衡转化率为
(4)下列叙述中能说明上述反应达到平衡状态的是
a.反应中M与N的物质的量之比为1︰1
b.混合气体的总质量不随时间的变化而变化
c.混合气体的总物质的量不随时间的变化而变化
d.单位时间内每消耗a mol N,同时生成b mol M
e.混合气体的压强不随时间的变化而变化
f.N的质量分数在混合气体中保持不变
Ⅱ.研究性学习小组为探究铁与稀盐酸反应,取同质量、体积的铁片、同浓度的盐酸做了下列平行实验:
实验①:把纯铁片投入到盛有稀盐酸的试管中,发现放出氢气的速率变化如图所示:

实验②:把铁片投入到含FeCl3的同浓度稀盐酸中,发现放出氢气的量减少。
实验③:在稀盐酸中滴入几滴CuCl2溶液,用铁片做实验,发现生成氢气的速率加快。
试回答下列问题:
(1)分析实验①中t1~t2速率变化的主要原因是
(2)实验②放出氢气的量减少的原因是
(3)某同学认为实验③反应速率加快的主要原因是形成了原电池,你认为是否正确?请选择下列相应的a或b作答。a.若不正确,请说明原因
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
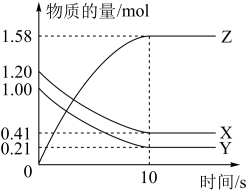
(1)反应的化学方程式为:___________ 。
(2)反应开始到10s,用Z表示的反应速率为___________ 。
(3)反应开始到10s,X的转化率为___________ 。
(4)下列条件的改变能减缓上述反应的反应速率的是___________
A.降低温度
B.补加一定量的X
C.保持压强不变,充入He使容器的体积增大
D.保持体积不变,充入He使容器的压强增大

(1)反应的化学方程式为:
(2)反应开始到10s,用Z表示的反应速率为
(3)反应开始到10s,X的转化率为
(4)下列条件的改变能减缓上述反应的反应速率的是
A.降低温度
B.补加一定量的X
C.保持压强不变,充入He使容器的体积增大
D.保持体积不变,充入He使容器的压强增大
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】化学反应速率和限度与生产、生活密切相关。
某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
(1)哪一时间段反应速率最大__ min(填0~1、1~2、2~3、3~4、4~5)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入少量的下列溶液以减慢反应速率,你认为可行的是__ 。
A.NaNO3溶液 B.CuSO4溶液 C.蒸馏水 D.KCl溶液
某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
(1)哪一时间段反应速率最大
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入少量的下列溶液以减慢反应速率,你认为可行的是
A.NaNO3溶液 B.CuSO4溶液 C.蒸馏水 D.KCl溶液
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】外因
(1)在分析影响H2O2分解反应速率的因素的实验中,影响反应速率(因变量)的因素有______ 、______ 、______ 等。
(2)探究催化剂对H2O2分解反应速率的影响,自变量是______ ;探究温度对H2O2分解反应速率的影响,自变量是______ ;探究浓度对H2O2分解反应速率的影响,自变量是______ 。根据物质的组成和性质,通过______ 可实现物质之间的转化,在化学变化过程中,元素是______ ,这是考虑如何物质之间的转化时最基本的依据。
(1)在分析影响H2O2分解反应速率的因素的实验中,影响反应速率(因变量)的因素有
(2)探究催化剂对H2O2分解反应速率的影响,自变量是
您最近一年使用:0次

 在高温下分解产生的
在高温下分解产生的 可作为硫酸工业中
可作为硫酸工业中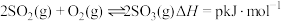 的催化剂,其催化原理如图所示。
的催化剂,其催化原理如图所示。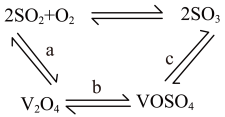
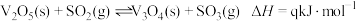 、
、 。请写出过程c的热化学方程式:
。请写出过程c的热化学方程式:

