(1)燃料电池是一种高效、环境友好的发电装置。氢氧燃料电池已用于航天飞机。以氢氧化钾溶液为电解质溶液的这种电池的负极反应式为____ ,这种电池在放电使用一段时间后,电解质溶液中的c(OH-)将___ (填“增大”“减小”或“不变”)。
(2)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液。回答下列问题:
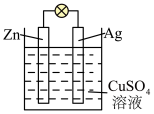
锌为____ 极,电极反应式为___ ,若反应前两电极质量相等,工作一段时间后两电极质量相差12.9g,则外电路通过的电子数为____ 。
(3)氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
①砷在元素周期表中的位置___ 。
②已知:P(s,白磷)=P(s,黑磷)∆H=-39.3kJ·mol-1;P(s,白磷)=P(s,红磷) ∆H=-17.6kJ·mol-1;由此推知,其中最稳定的磷单质是___ 。(填物质名称)沸点:N2H4___ P2H4(填“>”“<”)。
(2)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液。回答下列问题:

锌为
(3)氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
①砷在元素周期表中的位置
②已知:P(s,白磷)=P(s,黑磷)∆H=-39.3kJ·mol-1;P(s,白磷)=P(s,红磷) ∆H=-17.6kJ·mol-1;由此推知,其中最稳定的磷单质是
更新时间:2021-05-08 10:01:25
|
相似题推荐
【推荐1】回答下列问题:
(1)已知两种同素异形体A、B的燃烧热的热化学方程式为:
A(s)+O2(g) =CO2(g) △H= - 393.51 kJ/mol
B(s)+O2(g)=CO2(g) △H= - 395.41 kJ/mol
则两种同素异形体中较稳定的是(填"A"或"B")___________________ 。
(2)工业上用H2和Cl2反应制HCl,各键能数据为:H – H:436 kJ/mol;Cl-Cl:243 kJ/mol;H-Cl:431 kJ/mol,该反应的热化学方程式是_____________________ 。
(3)合成气(CO和H2为主的混合气体)不但是重要的燃料也是重要的化工原料,制备合成气的方法有多种,已知l gCH4气体与O2气体反应生成CO气体和H2气体放2.25 kJ热量。
①写出相应热化学方程式______________ 。
②用甲烷制备合成气还可以发生反应:CH4(g)+H2O(g)=CO(g)+3H2(g);△H2= +216kJ/mol。现有1 mol由H2O(g)与O2组成的混合气,且O2的体积分数为x,将此混合气与足量CH4充分反应。若x=0.2时,反应①放出的能量为____ kJ;若x=____ 时, 反应①与②放出(或吸收)的总能量为0。
(4)一定温度下,将3 mol A气体和l mol B气体通入一容积固定为2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g), 反应1 min时测得剩余1.8 mol A,C的浓度为0.4 mol/L,则1 min内,B的平均反应速率为
xC(g), 反应1 min时测得剩余1.8 mol A,C的浓度为0.4 mol/L,则1 min内,B的平均反应速率为_________ ; x为___________ 。可以作为达到平衡状态的标志是______________ 。
A.单位时间内生成n mol B的同时生成3n molA
B.混合气体的压强不变
C.混合气体的颜色不再改变(C为有色气体)
D.混合气体的密度不变
(1)已知两种同素异形体A、B的燃烧热的热化学方程式为:
A(s)+O2(g) =CO2(g) △H= - 393.51 kJ/mol
B(s)+O2(g)=CO2(g) △H= - 395.41 kJ/mol
则两种同素异形体中较稳定的是(填"A"或"B")
(2)工业上用H2和Cl2反应制HCl,各键能数据为:H – H:436 kJ/mol;Cl-Cl:243 kJ/mol;H-Cl:431 kJ/mol,该反应的热化学方程式是
(3)合成气(CO和H2为主的混合气体)不但是重要的燃料也是重要的化工原料,制备合成气的方法有多种,已知l gCH4气体与O2气体反应生成CO气体和H2气体放2.25 kJ热量。
①写出相应热化学方程式
②用甲烷制备合成气还可以发生反应:CH4(g)+H2O(g)=CO(g)+3H2(g);△H2= +216kJ/mol。现有1 mol由H2O(g)与O2组成的混合气,且O2的体积分数为x,将此混合气与足量CH4充分反应。若x=0.2时,反应①放出的能量为
(4)一定温度下,将3 mol A气体和l mol B气体通入一容积固定为2 L的密闭容器中,发生如下反应:3A(g)+B(g)
 xC(g), 反应1 min时测得剩余1.8 mol A,C的浓度为0.4 mol/L,则1 min内,B的平均反应速率为
xC(g), 反应1 min时测得剩余1.8 mol A,C的浓度为0.4 mol/L,则1 min内,B的平均反应速率为A.单位时间内生成n mol B的同时生成3n molA
B.混合气体的压强不变
C.混合气体的颜色不再改变(C为有色气体)
D.混合气体的密度不变
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】(1) 已知 31g 白磷变为 31g 红磷释放能量。上述变化属于____ (填“物理”或“化学”)变化。常温常压下,白磷与红磷更稳定的是____ 。
(2)甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.8 kJ/mol;
②CH3OH(l)+ O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
Ⅰ.表示甲醇燃烧热的热化学方程式为____ ;
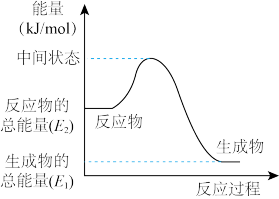
Ⅱ.反应②中的能量变化如图所示,则 ΔH2=____ 。(用 E1、E2的相关式子表示);
(3)捕碳技术(主要指捕获 CO2在降低温室气体排放中具有重要的作用。目前 NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与 CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) ⇌ (NH4)2CO3(aq) △H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) ⇌ NH4HCO3(aq) △H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) ⇌ 2NH4HCO3(aq) △H3
则 ΔH3与 ΔH1、ΔH2与之间的关系为 ΔH3 =____ ;
(4) 已知反应 N2(g)+3H2(g) ⇌ 2NH3(g) ΔH=akJ/mol,试根据表中所列键能数据估算 a 的值____ 。(注明“+”或“﹣”)。
(5)1mol H2和 1molCH4完全燃烧放出的热量分别为:286kJ、890kJ,等质量的 H2和 CH4完全燃烧放出的热量,____ (填化学式)放出的热量多。
(2)甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.8 kJ/mol;
②CH3OH(l)+
 O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/molⅠ.表示甲醇燃烧热的热化学方程式为
Ⅱ.反应②中的能量变化如图所示,则 ΔH2=

(3)捕碳技术(主要指捕获 CO2在降低温室气体排放中具有重要的作用。目前 NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与 CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) ⇌ (NH4)2CO3(aq) △H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) ⇌ NH4HCO3(aq) △H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) ⇌ 2NH4HCO3(aq) △H3
则 ΔH3与 ΔH1、ΔH2与之间的关系为 ΔH3 =
(4) 已知反应 N2(g)+3H2(g) ⇌ 2NH3(g) ΔH=akJ/mol,试根据表中所列键能数据估算 a 的值
| 化学键 | H﹣H | N﹣H | N≡N |
| 键能/kJ/mol | 436 | 391 | 945 |
(5)1mol H2和 1molCH4完全燃烧放出的热量分别为:286kJ、890kJ,等质量的 H2和 CH4完全燃烧放出的热量,
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)S8分子可形成单斜硫和斜方硫,转化过程如下:
S(s,单斜)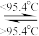 S(s,斜方) ΔH=-0.398 kJ·mol-1则S(单斜)、S(斜方)相比,较稳定的是
S(s,斜方) ΔH=-0.398 kJ·mol-1则S(单斜)、S(斜方)相比,较稳定的是____________ (填“S(单斜)”或“S(斜方)”)。
(2)表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
热化学方程式:H2(g) + Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1,则Cl2的键能为______ kJ·mol-1。
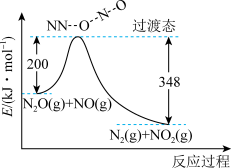
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2 mol N2理论上放出的热量为___________ 。
S(s,单斜)
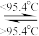 S(s,斜方) ΔH=-0.398 kJ·mol-1则S(单斜)、S(斜方)相比,较稳定的是
S(s,斜方) ΔH=-0.398 kJ·mol-1则S(单斜)、S(斜方)相比,较稳定的是(2)表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
化学键 | H—H | H—Cl |
键能 | 436 | 431 |
热化学方程式:H2(g) + Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1,则Cl2的键能为
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2 mol N2理论上放出的热量为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题:
(1)焦炭可以用来制备水煤气,实验测得6 g的碳与水蒸气反应生成水煤气时,吸收了65.8 kJ的热量,则该反应可以在_______ 条件下自发进行。(选填“高温”、“低温”或“任意温度”)
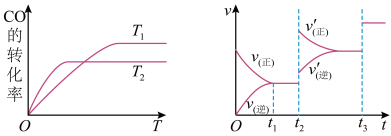
(2)水煤气可以在工业上用来合成甲醇,反应为CO(g)+2H2(g) CH3OH(g)。下图是不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。下图是不同温度下CO的转化率随时间变化的曲线。
①T1和T2的大小关系为T1_______ T2,上述合成甲醇反应的焓变△H_______ 0(填“<”、“>”或“=”上同)
②若上述反应是在容积不变的容器中进行,下列措施能增大反应的平衡常数的是_______ 。
A.降低温度 B.增大CO和H2的浓度
C.使用高效的催化剂 D.升高温度
③反应速率(v)与时间(t)之间的关系下图所示,则t2时刻速率改变的原因可能是_______ ,用v(X)t表示t时刻物质X的总反应速率,则v(CO)t1、v(CO)t3的大小关系为_______ 。
(3)甲醇燃料电池用Pt作电极材料,用KOH溶液作电解质溶液,则该电池的负极的电极反应方程式为_______ 。
(1)焦炭可以用来制备水煤气,实验测得6 g的碳与水蒸气反应生成水煤气时,吸收了65.8 kJ的热量,则该反应可以在
(2)水煤气可以在工业上用来合成甲醇,反应为CO(g)+2H2(g)
 CH3OH(g)。下图是不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。下图是不同温度下CO的转化率随时间变化的曲线。①T1和T2的大小关系为T1
②若上述反应是在容积不变的容器中进行,下列措施能增大反应的平衡常数的是
A.降低温度 B.增大CO和H2的浓度
C.使用高效的催化剂 D.升高温度
③反应速率(v)与时间(t)之间的关系下图所示,则t2时刻速率改变的原因可能是

(3)甲醇燃料电池用Pt作电极材料,用KOH溶液作电解质溶液,则该电池的负极的电极反应方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】碳及其化合物种类繁多,用途广泛。根据要求,回答下列问题:
(1)碳在氧气或臭氧中燃烧的能量变化如图所示:
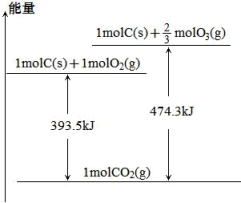
试判断:16gO3(g)全部转化为O2(g)需_______ (填“吸收”或“放出”)热量_______ kJ。
(2)用二氧化碳和丙烷(C3H8)为原料可制备丙烯(C3H6)。一定温度下,向2L恒容密闭容器中通入4molCO2(g)和3molC3H8(g),发生反应:CO2(g)+C3H8(g)⇌C3H6(g)+CO(g)+H2O(g),测得C3H8的物质的量随时间的变化如表所示。
①0~5min内C3H6的平均生成速率为_______ 。
②达平衡时CO2的转化率为_______ 。
③平衡时与初始时容器内压强的比值为_______ (保留两位小数)。
(3)新型高效的甲烷燃料电池采用铂为电极材料,两电极分别通入甲烷和氧气。碱性甲烷燃料电池结构示意图如图所示。
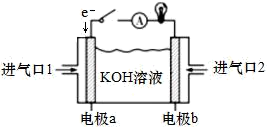
①电极a为_______ (填“正极”或“负极”),电极反应式为___ 。
②当消耗标准状况下5.6L甲烷时,若电池的能量转化效率为90%,则导线中转移电子的个数为___ 。
(1)碳在氧气或臭氧中燃烧的能量变化如图所示:

试判断:16gO3(g)全部转化为O2(g)需
(2)用二氧化碳和丙烷(C3H8)为原料可制备丙烯(C3H6)。一定温度下,向2L恒容密闭容器中通入4molCO2(g)和3molC3H8(g),发生反应:CO2(g)+C3H8(g)⇌C3H6(g)+CO(g)+H2O(g),测得C3H8的物质的量随时间的变化如表所示。
| t/min | 0 | 5 | 10 | 15 | 20 |
| n(C3H8)/mol | 3 | 2.1 | 1.5 | 1.2 | 1.2 |
①0~5min内C3H6的平均生成速率为
②达平衡时CO2的转化率为
③平衡时与初始时容器内压强的比值为
(3)新型高效的甲烷燃料电池采用铂为电极材料,两电极分别通入甲烷和氧气。碱性甲烷燃料电池结构示意图如图所示。

①电极a为
②当消耗标准状况下5.6L甲烷时,若电池的能量转化效率为90%,则导线中转移电子的个数为
您最近一年使用:0次
【推荐3】能源、材料、环境和健康等领域与化学息息相关。
(1)甲醇(CH3OH)和 O2 在下列装置中反应可以形成为原电池,其结构示意图如下:
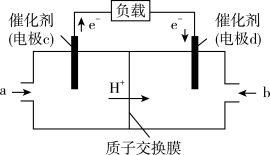
电池总反应为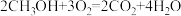 ,则电极 d 是
,则电极 d 是___________ (填“正极”或“负极"),电极 c 的反应式为___________ ,若线路中转移 1mol 电子,则上述 CH3OH 燃料电池消耗的 O2 在标准状况下的体积为___________ 。
(2)A、B、C、D 四种物质之间有如图所示的转化关系。
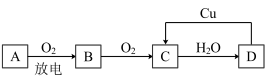
已知:A 是空气中的主要成分之一,B、C、D 均为化合物,且 C 为一种红棕色气体。写出 D→C 的化学方程式:___________ ;其中 D 表现出___________ 性。
(3)一种在恒温、恒定气流流速下,催化氧化 HCl 生产 Cl2 工艺的主要反应机理如图所示。
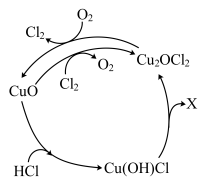
①X 为___________ 。
②总反应化学方程式式为___________ 。
(1)甲醇(CH3OH)和 O2 在下列装置中反应可以形成为原电池,其结构示意图如下:

电池总反应为
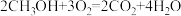 ,则电极 d 是
,则电极 d 是(2)A、B、C、D 四种物质之间有如图所示的转化关系。

已知:A 是空气中的主要成分之一,B、C、D 均为化合物,且 C 为一种红棕色气体。写出 D→C 的化学方程式:
(3)一种在恒温、恒定气流流速下,催化氧化 HCl 生产 Cl2 工艺的主要反应机理如图所示。

①X 为
②总反应化学方程式式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】合成是转化的一种应用,甲醇作为一种可再生能源,工业上一般采用下列两种反应合成甲醇:
反应一:CO(g)+2H2(g) CH3OH(g)ΔH1
CH3OH(g)ΔH1
反应二:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
(1)相同条件下,反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH3,则ΔH3=
CO(g)+H2O(g) ΔH3,则ΔH3=___________ (用ΔH1和ΔH2表示)。
(2)下表所列数据是反应CO(g)+2H2(g) CH3OH(g) ΔH1在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH1在不同温度下的化学平衡常数(K)。
①此反应的ΔH1___________ 0,ΔS___________ 0.(填“>”“=”或“<”)
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率是___________ ,此时的温度是___________ 。
③要提高CO的转化率,可以采取的措施是___________ 。
A.升温 B.恒容充入CO C.恒容充入H2 D.恒压充入惰性气体 E.分离出甲醇
(3)在水溶液中电解CO2生成甲醇的原理如图所示。___________ 。
②A极生成1mol甲醇时,B极生成气体在标准状况下的体积是___________ 。
反应一:CO(g)+2H2(g)
 CH3OH(g)ΔH1
CH3OH(g)ΔH1反应二:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2(1)相同条件下,反应CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH3,则ΔH3=
CO(g)+H2O(g) ΔH3,则ΔH3=(2)下表所列数据是反应CO(g)+2H2(g)
 CH3OH(g) ΔH1在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH1在不同温度下的化学平衡常数(K)。| 温度/℃ | 250 | 300 | 350 |
| 平衡常数(K) | 2.04 | 0.27 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率是
③要提高CO的转化率,可以采取的措施是
A.升温 B.恒容充入CO C.恒容充入H2 D.恒压充入惰性气体 E.分离出甲醇
(3)在水溶液中电解CO2生成甲醇的原理如图所示。

②A极生成1mol甲醇时,B极生成气体在标准状况下的体积是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】东莞市松山湖打造我市首个“氢谷”产业基地;氢气是一种清洁能源,也是重要的化工原料。
(1)纳米级的Cu2O可作为太阳光分解水的催化剂。一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:2H2O(g)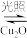 2H2(g)+O2(g) △H=+484kJ·mol-1,不同时段产生O2的量见下表:
2H2(g)+O2(g) △H=+484kJ·mol-1,不同时段产生O2的量见下表:
上述反应过程中能量转化形式为光能转化为____ 能,达平衡过程中至少需要吸收光能为_____ kJ(保留三位小数)。
(2)氢气是合成氨工业的原料,合成塔中每产生2molNH3,放出92.2kJ热量。已知:

则1molN-H键断裂吸收的能量约等于_______ kJ。
(3)已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
则H2还原NO2生成水蒸气和氮气反应的热化学方程式是_______ 。
(4)氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是H2+2NiO(OH) 2Ni(OH)2。请由总反应式回答:
2Ni(OH)2。请由总反应式回答:
①电解质溶液应该是_______ (选填酸溶液、碱溶液);
②电池放电时,负极反应式为_______ ;
③外电路中每通过0.2NA个电子时,H2的质量理论上减小_______ g。
(1)纳米级的Cu2O可作为太阳光分解水的催化剂。一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:2H2O(g)
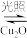 2H2(g)+O2(g) △H=+484kJ·mol-1,不同时段产生O2的量见下表:
2H2(g)+O2(g) △H=+484kJ·mol-1,不同时段产生O2的量见下表:| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
(2)氢气是合成氨工业的原料,合成塔中每产生2molNH3,放出92.2kJ热量。已知:

则1molN-H键断裂吸收的能量约等于
(3)已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
则H2还原NO2生成水蒸气和氮气反应的热化学方程式是
(4)氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是H2+2NiO(OH)
 2Ni(OH)2。请由总反应式回答:
2Ni(OH)2。请由总反应式回答:①电解质溶液应该是
②电池放电时,负极反应式为
③外电路中每通过0.2NA个电子时,H2的质量理论上减小
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】纳米级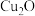 因具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的
因具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的 制备纳米
制备纳米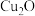 ,装置如图甲、乙。
,装置如图甲、乙。
(1)上述装置中 电极应连接肼燃料电池的
电极应连接肼燃料电池的___________ 极(填“A”或“B”),该电解池中离子交换膜为___________ 离子交换膜 填“阴”或“阳”
填“阴”或“阳” 。
。
(2)该电解池阴极的电极反应式为___________ ,肼燃料电池中A极发生的电极反应为___________ 。
(3)当反应生成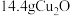 时,至少需要肼
时,至少需要肼___________ 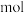 。
。
(4)某化学兴趣小组设计了如图所示装置,用肼(N2H4)燃料电池为电源,用电解法把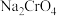 转化为
转化为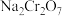 。
。

①电解过程中,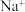 的移动方向为:左
的移动方向为:左 ___________ 右(填“→”或“←”)。
②在溶液中生成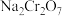 的原理为
的原理为 ___________ (用离子方程式表示)。
③当电路中通过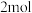 电子时,产生
电子时,产生 ___________ 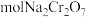 。
。
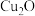 因具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的
因具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的 制备纳米
制备纳米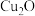 ,装置如图甲、乙。
,装置如图甲、乙。
(1)上述装置中
 电极应连接肼燃料电池的
电极应连接肼燃料电池的 填“阴”或“阳”
填“阴”或“阳” 。
。(2)该电解池阴极的电极反应式为
(3)当反应生成
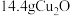 时,至少需要肼
时,至少需要肼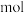 。
。(4)某化学兴趣小组设计了如图所示装置,用肼(N2H4)燃料电池为电源,用电解法把
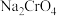 转化为
转化为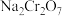 。
。
①电解过程中,
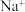 的移动方向为:左
的移动方向为:左 ②在溶液中生成
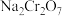 的原理为
的原理为 ③当电路中通过
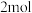 电子时,产生
电子时,产生 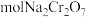 。
。
您最近一年使用:0次



