粗盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。根据教材中“粗盐的提纯”实验回答下列问题:
(1)实验室蒸发食盐水时,操作过程如下:①放置酒精灯,②固定铁圈位置,③放上蒸发皿(蒸发皿中盛有食盐水),④加热搅拌,⑤停止加热。其正确的操作顺序为______________ 。
(2)检验溶液中有无硫酸根离子最简单的方法是______ ,如果含有硫酸根离子,除去硫酸根离子的方法是______ 。
(3)在粗盐经过溶解、过滤后的溶液中滴加饱和碳酸钠溶液,直至不再产生沉淀为止。请问这步操作的目的是___________ 。
(4)将经过操作(3)后的溶液过滤。请问这一操作能除去的杂质是______________________ 。
(5)实验室将粗盐制成精盐的过程中,下列三个实验操作步骤中都要使用玻璃棒,分别说明各自使用玻璃棒的作用:溶解时_____ ,过滤时______ ,蒸发时______ 。
(1)实验室蒸发食盐水时,操作过程如下:①放置酒精灯,②固定铁圈位置,③放上蒸发皿(蒸发皿中盛有食盐水),④加热搅拌,⑤停止加热。其正确的操作顺序为
(2)检验溶液中有无硫酸根离子最简单的方法是
(3)在粗盐经过溶解、过滤后的溶液中滴加饱和碳酸钠溶液,直至不再产生沉淀为止。请问这步操作的目的是
(4)将经过操作(3)后的溶液过滤。请问这一操作能除去的杂质是
(5)实验室将粗盐制成精盐的过程中,下列三个实验操作步骤中都要使用玻璃棒,分别说明各自使用玻璃棒的作用:溶解时
12-13高一上·陕西西安·期中 查看更多[13]
2020年春季苏教版高中化学必修1专题一《化学家眼中的物质世界》测试卷人教版高中化学必修1第一章《从实验学化学》测试卷3四川省泸州市泸县第二中学2019-2020学年高一上学期期中考试化学试题步步为赢 高一化学寒假作业:作业十七 综合评估(一)云南省新平一中2018-2019学年高一下学期5月份考试化学试题云南省通海县第二中学2018-2019学年高一下学期3月份考试化学试题贵州省正安县一中2018-2019学年高一上学期期中考试化学试题贵州省普定县一中2018-2019学年高一上学期期中考试化学试题贵州省盘县二中2018-2019学年高一上学期期中考试化学试题云南省澄江二中2018-2019学年高一上学期期中考试化学试题2016-2017学年山西省怀仁一中高一上月考一化学试卷(已下线)2012-2013学年福建省永定县湖雷中学高一入学教育考试化学试卷(已下线)2011-2012学年陕西省西安市第一中学高一上学期期中考试化学试卷
更新时间:2016-12-09 03:39:39
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】三氯化铁溶液可腐蚀印刷电路板上的铜膜,某小组为了从腐蚀废液(含有大量CuCl2、FeCl2和FeCl3)中回收铜,并将铁的化合物全部转化为溶液作为腐蚀液原料循环使用,设计了如下实验步骤:
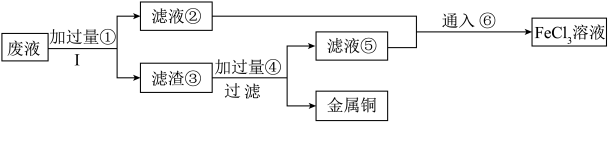
(1)写出下列物质的化学式①__ 、③___ 、⑥__ 。
(2)步骤Ⅰ的操作名称:___ 。
(3)写出FeCl3溶液与铜发生反应的离子方程式:__ 。
(4)向②中加入NaOH溶液并长时间暴露在空气中,先产生白色沉淀,后迅速变为灰绿色,接着又转化为___ 色沉淀,此过程所涉及反应的化学方程式为:___ 、___ 。
(5)通入⑥发生反应的离子方程式:___ 。
(6)若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是__ (填字母代号)。
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无

(1)写出下列物质的化学式①
(2)步骤Ⅰ的操作名称:
(3)写出FeCl3溶液与铜发生反应的离子方程式:
(4)向②中加入NaOH溶液并长时间暴露在空气中,先产生白色沉淀,后迅速变为灰绿色,接着又转化为
(5)通入⑥发生反应的离子方程式:
(6)若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】铟被广泛应用于电子工业、航空航天、太阳能电池新材料等高科技领域。从铜烟灰氧压酸浸渣(主要含 )中提取铟的工艺如图所示。
)中提取铟的工艺如图所示。
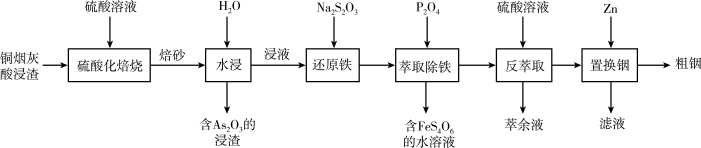
已知:①焙烧后金属元素均以硫酸盐的形式存在。 ② 微溶于水
微溶于水
③ 性质与
性质与 类似 ④
类似 ④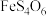 为强电解质
为强电解质
回答下列问题:
(1)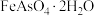 中铁元素化合价为
中铁元素化合价为 价,
价, 的化合价为
的化合价为_______ 。
(2)“硫酸化焙烧”时,其他条件一定,焙烧温度对“水浸”时铟、铁浸出率的影响如图所示。
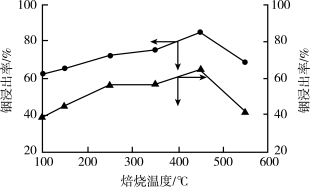
适宜的焙烧温度是_______ ℃,温度过高铟、铁浸出率降低的原因是_______ 。
(3)“水浸”工艺中的浸渣除了 外,还含有
外,还含有_______ 。
(4)“还原铁”工艺反应的离子方程式为_______ 。
(5)“萃取除铁”工艺中,用30%的 作萃取剂时,发现当溶液
作萃取剂时,发现当溶液 后,铟萃取率随
后,铟萃取率随 值的升高而下降,原因是
值的升高而下降,原因是_______ 。
(6)“置换铟”时,发现会有少量的气体 生成,
生成, 的电子式为
的电子式为_______ ,生成 的离子方程式为
的离子方程式为_______ 。
(7)整个工艺流程中,可循环利用的溶液是_______ 。
 )中提取铟的工艺如图所示。
)中提取铟的工艺如图所示。
已知:①焙烧后金属元素均以硫酸盐的形式存在。 ②
 微溶于水
微溶于水③
 性质与
性质与 类似 ④
类似 ④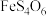 为强电解质
为强电解质回答下列问题:
(1)
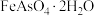 中铁元素化合价为
中铁元素化合价为 价,
价, 的化合价为
的化合价为(2)“硫酸化焙烧”时,其他条件一定,焙烧温度对“水浸”时铟、铁浸出率的影响如图所示。

适宜的焙烧温度是
(3)“水浸”工艺中的浸渣除了
 外,还含有
外,还含有(4)“还原铁”工艺反应的离子方程式为
(5)“萃取除铁”工艺中,用30%的
 作萃取剂时,发现当溶液
作萃取剂时,发现当溶液 后,铟萃取率随
后,铟萃取率随 值的升高而下降,原因是
值的升高而下降,原因是(6)“置换铟”时,发现会有少量的气体
 生成,
生成, 的电子式为
的电子式为 的离子方程式为
的离子方程式为(7)整个工艺流程中,可循环利用的溶液是
您最近半年使用:0次
【推荐3】某试剂瓶中FeSO4溶液中含有少量 NaCl、Na2SO4、CuSO4和NaNO3,请选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体和FeSO4·7H2O晶体,相应的实验流程如图所示。
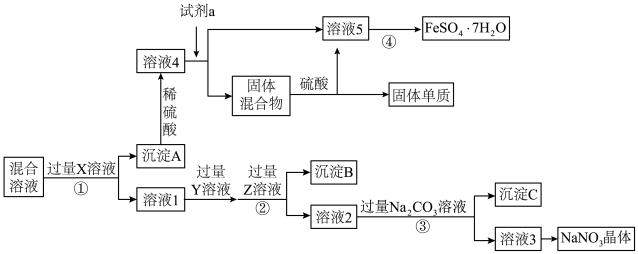
实验室只提供如下试剂:Ca(OH)2溶液,NaOH溶液,AgNO3溶液,BaCl2溶液,稀HNO3,稀H2SO4,铁粉,铜粉,锌粒。
请回答下列问题:
(1)若该混合溶液中,测得Fe2+浓度为2 mol/L,Cu2+、Na+、 、Cl浓度均为1 mol/L,则c(
、Cl浓度均为1 mol/L,则c( )=
)=_________ mol/L。
(2)若沉淀A是Cu(OH)2、Fe(OH)2的混合物,写出实验流程中下列加入试剂的化学式:X_____________ 。
(3)向溶液4加入试剂a,发生反应的化学方程式为_____________ ,通过过滤、洗涤的到溶液5,如何证明固体混合物已洗净__________________ 。
(4)步骤④中涉及的操作是:_____________ 、____________ 、过滤、洗涤、干燥。
(5)上述实验步骤③中加入过量Na2CO3溶液的目的是_____________ 。
(6)向溶液3中加入适量的____________ (填化学式),再结晶,从而获得NaNO3晶体。

实验室只提供如下试剂:Ca(OH)2溶液,NaOH溶液,AgNO3溶液,BaCl2溶液,稀HNO3,稀H2SO4,铁粉,铜粉,锌粒。
请回答下列问题:
(1)若该混合溶液中,测得Fe2+浓度为2 mol/L,Cu2+、Na+、
 、Cl浓度均为1 mol/L,则c(
、Cl浓度均为1 mol/L,则c( )=
)=(2)若沉淀A是Cu(OH)2、Fe(OH)2的混合物,写出实验流程中下列加入试剂的化学式:X
(3)向溶液4加入试剂a,发生反应的化学方程式为
(4)步骤④中涉及的操作是:
(5)上述实验步骤③中加入过量Na2CO3溶液的目的是
(6)向溶液3中加入适量的
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐中常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为________ (只填化学式)。
②分离操作①中所用到的玻璃仪器有____________ 。
③洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________ 。
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除药匙、烧杯、玻璃棒外还有________ (填仪器名称)。
(3)在实验中多次用到玻璃棒,其作用有三个,分别是______________ 、______________ 、______________ 。
(1)粗食盐中常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为
②分离操作①中所用到的玻璃仪器有
③洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除药匙、烧杯、玻璃棒外还有
(3)在实验中多次用到玻璃棒,其作用有三个,分别是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
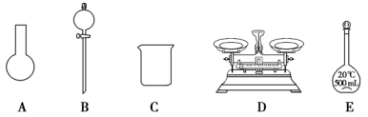
【推荐2】I.如图所示为常见玻璃仪器的部分结构:
(1)请写出所列仪器的名称: A______ ,B_______ ,C_______ ;
(2)仪器 B 使用前必须__________________ 。
(3)仪器 B 上标记有______ (填序号);①质量 ②温度 ③刻度线 ④浓度 ⑤容积
(1)该“84 消毒液”的物质的量浓度约为_______ mol·L-1。(保留两位有效数字)
(2)某同学取100 mL该“84 消毒液”,稀释后用于消毒,稀释后的溶液中 c (Na+)=_____ 。
(3)该同学参阅该“84 消毒液”的配方,欲用 NaClO 固体配制 250 mL含 NaClO 质量分数为 25%的消毒液。下列说法不正确 的是________ (填序号)。
a.如图所示的仪器中,有三种是不需要的,还需要其它玻璃仪器
b.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
c.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
(4) “84 消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用 98%(密度为1.84g·cm-3)的浓硫酸配制2 L 2.3 mol·L-1 的稀硫酸用于增强“84 消毒液”的消毒能力。需用浓硫酸的体积为______ mL。
(1)请写出所列仪器的名称: A
(2)仪器 B 使用前必须
(3)仪器 B 上标记有
II.已知某“84 消毒液”瓶体部分标签如图所示,该“84 消毒液”通常稀释 100 倍(体积之比)后使用。请回答下列问题:
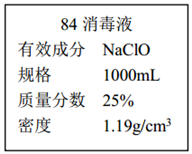
(1)该“84 消毒液”的物质的量浓度约为
(2)某同学取100 mL该“84 消毒液”,稀释后用于消毒,稀释后的溶液中 c (Na+)=
(3)该同学参阅该“84 消毒液”的配方,欲用 NaClO 固体配制 250 mL含 NaClO 质量分数为 25%的消毒液。下列说法
a.如图所示的仪器中,有三种是不需要的,还需要其它玻璃仪器
b.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
c.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低

(4) “84 消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用 98%(密度为1.84g·cm-3)的浓硫酸配制2 L 2.3 mol·L-1 的稀硫酸用于增强“84 消毒液”的消毒能力。需用浓硫酸的体积为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】硫酰氯(SO2Cl2)是重要的化学试剂,其熔点为−54.1℃,沸点为69.1℃,遇冷水逐渐分解,其制备原理为SO2(g)+Cl2(g)=SO2Cl2(l) ΔH=−97.3kJ⋅mol−1现用如图所示装置(夹持仪器已略去)进行制备实验。
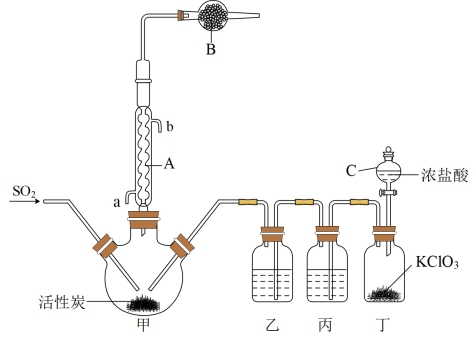
回答下列问题:
(1)写出下列仪器名称:活性炭装在____ 中,A _____ 、B_______ 、C_______ 。
(2)A的作用是________ ,进水口为________ (a或b)。
(3)B中装碱石灰,其作用除吸收多余的SO2和Cl2外,还具有的作用是___________ 。
(4)丁中生成氯气的方程式为___________ ,丙中药品名称为___________ 。
(5)打开分液漏斗后,浓盐酸没有滴下,可能的原因是___________ 。

回答下列问题:
(1)写出下列仪器名称:活性炭装在
(2)A的作用是
(3)B中装碱石灰,其作用除吸收多余的SO2和Cl2外,还具有的作用是
(4)丁中生成氯气的方程式为
(5)打开分液漏斗后,浓盐酸没有滴下,可能的原因是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】实验室进行硫酸铜晶体结晶水含量的测定时,下列操作会引起测定结果“偏高”、“偏低”还是“无影响”?
(1)白色粉末在空气中冷却至室温_____ 。
(2)晶体加热温度过高而变黑色_____ 。
(3)晶体中含受热不分解或不挥发的杂质_____ 。
(1)白色粉末在空气中冷却至室温
(2)晶体加热温度过高而变黑色
(3)晶体中含受热不分解或不挥发的杂质
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】四氯化锡 可用作媒染剂和有机合成的氯化催化剂。实验室可按下图装置(部分夹持装置略去)制备
可用作媒染剂和有机合成的氯化催化剂。实验室可按下图装置(部分夹持装置略去)制备 。
。

已知:① 和
和 的部分物理性质:
的部分物理性质:
② 能与
能与 反应生成
反应生成 ,无水
,无水 遇水易水解生成
遇水易水解生成
③ 与
与 加热条件下生成
加热条件下生成 和
和
回答下列问题:
(1)A装置中带有玻璃管a的装置的名称是_______ ;a的作用是_______ ;B中的试剂:_______ 。E中球形冷凝管的进水口是_______ (填“c”或“d”)。A中发生反应的离子方程式 是_______ 。
(2)当D中充满黄绿色气体时再点燃酒精灯,原因是_______ 。
(3)若无C装置,可观察到E中试管内有白雾产生,试解释产生该现象原因:_______ 。
(4)E中收集的产品因混有氯气而呈黄绿色。欲得到较纯的 ,可再加入几片锡薄片,加热蒸馏,收集温度范围为
,可再加入几片锡薄片,加热蒸馏,收集温度范围为_______ (填标号)的馏分,得到无水 成品。
成品。
A. B.
B.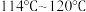 C.
C.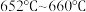
 可用作媒染剂和有机合成的氯化催化剂。实验室可按下图装置(部分夹持装置略去)制备
可用作媒染剂和有机合成的氯化催化剂。实验室可按下图装置(部分夹持装置略去)制备 。
。
已知:①
 和
和 的部分物理性质:
的部分物理性质:| 物质 |  |  |
| 颜色、状态 | 无色晶体 | 无色液体 |
熔点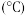 | 246 |  |
沸点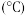 | 652 | 114 |
 能与
能与 反应生成
反应生成 ,无水
,无水 遇水易水解生成
遇水易水解生成
③
 与
与 加热条件下生成
加热条件下生成 和
和
回答下列问题:
(1)A装置中带有玻璃管a的装置的名称是
(2)当D中充满黄绿色气体时再点燃酒精灯,原因是
(3)若无C装置,可观察到E中试管内有白雾产生,试解释产生该现象原因:
(4)E中收集的产品因混有氯气而呈黄绿色。欲得到较纯的
 ,可再加入几片锡薄片,加热蒸馏,收集温度范围为
,可再加入几片锡薄片,加热蒸馏,收集温度范围为 成品。
成品。A.
 B.
B.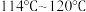 C.
C.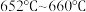
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O)晶体,设计了如下流程:
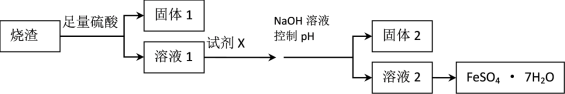
已知:(1)常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
(2)七水合硫酸亚铁(FeSO4·7H2O)的溶解度
(1)溶解烧渣选用足量硫酸,写出Fe2O3与硫酸反应的离子方程式_______________ ;检验溶液1中含有Fe3+的实验方法是___________________ ;
(2)固体1是制作单晶硅的主要原料,写出该反应的化学方程式___________________ ;
(3)试剂X是__________________ ;固体2是___________________ ;
(4)加入NaOH溶液控制pH应不超过_________________ ;
(5)从溶液2中获得晶体的的方法为______________ , _____________ 过滤、洗涤、干燥。
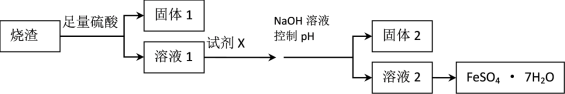
已知:(1)常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
| 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Al3+ | 3.3 | 5.0 |
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| FeSO4·7H2O溶解度(g) | 15.5 | 26.5 | 32.9 | 40.2 | 48.9 |
(2)固体1是制作单晶硅的主要原料,写出该反应的化学方程式
(3)试剂X是
(4)加入NaOH溶液控制pH应不超过
(5)从溶液2中获得晶体的的方法为
您最近半年使用:0次



