亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,沸点为-5.5℃,遇水和潮气分解。请回答下列问题:
(1)NO与Cl2在通常条件下可反应得到NOCl。某实验小组用浓盐酸与MnO2反应制Cl2,Zn和稀HNO3制NO。
①制取NO的离子方程式为___________ 。
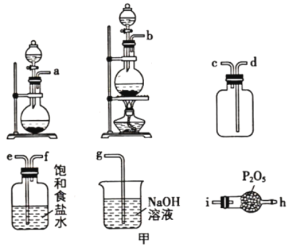
②选用如图甲所示的部分装置预制备一瓶干燥、纯净的氯气,各玻璃导管接口连接顺序为___________ (气流方向从左至右)。
(2)文献中记录的一种利用浓盐酸和NaNO2浓溶液反应制取NOCl的原理及装置如图乙所示:反应原理:NaNO2+2HCl=NOCl+NaCl+H2O。
制取装置图:
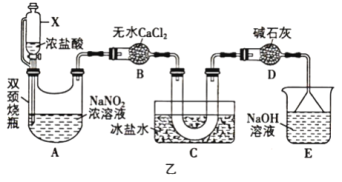
①仪器X为恒压分液漏斗,用它代替分液漏斗优点是___________ 。
②装置C的U形管中观察到的现象是___________ ,装置D的作用是___________ 。
(3)取少量产品NOCl滴入盛有水的试管中,液面方有白雾且产生无色气体,该气体在试管口变为红棕色,NOCl与水反应的化学方程式为___________ 。
(1)NO与Cl2在通常条件下可反应得到NOCl。某实验小组用浓盐酸与MnO2反应制Cl2,Zn和稀HNO3制NO。
①制取NO的离子方程式为
②选用如图甲所示的部分装置预制备一瓶干燥、纯净的氯气,各玻璃导管接口连接顺序为

(2)文献中记录的一种利用浓盐酸和NaNO2浓溶液反应制取NOCl的原理及装置如图乙所示:反应原理:NaNO2+2HCl=NOCl+NaCl+H2O。
制取装置图:

①仪器X为恒压分液漏斗,用它代替分液漏斗优点是
②装置C的U形管中观察到的现象是
(3)取少量产品NOCl滴入盛有水的试管中,液面方有白雾且产生无色气体,该气体在试管口变为红棕色,NOCl与水反应的化学方程式为
更新时间:2021-05-23 11:00:43
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】铁黑(Fe3O4)是常见的铁系颜料。工业上可以利用钛白工业的副产品硫酸亚铁,以及氨水、空气等,经过如图所示的一系列生产步骤来制取铁黑。

从合成到干燥阶段发生反应的原理如下:4Fe(OH)2+2H2O+O2=4Fe(OH)3,Fe(OH)2+2Fe(OH)3 Fe(OH)2·2Fe(OH)3
Fe(OH)2·2Fe(OH)3 Fe3O4。
Fe3O4。
(1)加入氨水调pH至7~9时,发生反应的离子方程式为___ 。
(2)“控制反应条件”是物质制备流程中的重要环节,为了保证铁黑样品的质量,“合成”过程中需要控制的因素有___ (填两个)。
(3)操作①的名称为___ 。溶液A经___ 后洗涤可得到副产品硫酸铵,该物质可用作化肥。
(4)铁黑产品中Fe3O4的含量是判断产品等级的依据之一。某铁黑样品中混有的杂质为FeO、Fe2O3中的一种。根据国标方法,进行的测定实验如下:
①步骤1:称取1.908g样品置于锥形瓶中,加入足量盐酸,加热使之完全溶解。
四氧化三铁可看成是由FeO和Fe2O3组成的化合物,依据物质类别的知识,你能写出Fe3O4与盐酸反应的化学方程式吗___ ?
②步骤2:向锥形瓶中先加入足量的SnCl2溶液,将Fe3+全部转化为Fe2+,除去过量的Sn2+,再加入一定量的硫酸和磷酸,并滴加指示剂。
在此步骤中,___ 元素被氧化,___ 作氧化剂。
③步骤3:再向锥形瓶中滴加0.08200mol·L-1K2Cr2O7溶液,发生反应:Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O。恰好完全反应时,共消耗50.00mLK2Cr2O7溶液。在方程式中标出电子转移的方向和数目
+6Fe2++14H+=2Cr3++6Fe3++7H2O。恰好完全反应时,共消耗50.00mLK2Cr2O7溶液。在方程式中标出电子转移的方向和数目___ 。依据题目数据计算样品中Fe元素的质量分数___ (写出计算过程)。

从合成到干燥阶段发生反应的原理如下:4Fe(OH)2+2H2O+O2=4Fe(OH)3,Fe(OH)2+2Fe(OH)3
 Fe(OH)2·2Fe(OH)3
Fe(OH)2·2Fe(OH)3 Fe3O4。
Fe3O4。(1)加入氨水调pH至7~9时,发生反应的离子方程式为
(2)“控制反应条件”是物质制备流程中的重要环节,为了保证铁黑样品的质量,“合成”过程中需要控制的因素有
(3)操作①的名称为
(4)铁黑产品中Fe3O4的含量是判断产品等级的依据之一。某铁黑样品中混有的杂质为FeO、Fe2O3中的一种。根据国标方法,进行的测定实验如下:
①步骤1:称取1.908g样品置于锥形瓶中,加入足量盐酸,加热使之完全溶解。
四氧化三铁可看成是由FeO和Fe2O3组成的化合物,依据物质类别的知识,你能写出Fe3O4与盐酸反应的化学方程式吗
②步骤2:向锥形瓶中先加入足量的SnCl2溶液,将Fe3+全部转化为Fe2+,除去过量的Sn2+,再加入一定量的硫酸和磷酸,并滴加指示剂。
在此步骤中,
③步骤3:再向锥形瓶中滴加0.08200mol·L-1K2Cr2O7溶液,发生反应:Cr2O
 +6Fe2++14H+=2Cr3++6Fe3++7H2O。恰好完全反应时,共消耗50.00mLK2Cr2O7溶液。在方程式中标出电子转移的方向和数目
+6Fe2++14H+=2Cr3++6Fe3++7H2O。恰好完全反应时,共消耗50.00mLK2Cr2O7溶液。在方程式中标出电子转移的方向和数目
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】举重运动员常常会抓一把“镁粉”在手里搓,以起到防滑效果,某种“镁粉”中只含有 、
、 、
、 中的一种或几种固体。某兴趣小组对其成分展开了探究:分别取4.2克
中的一种或几种固体。某兴趣小组对其成分展开了探究:分别取4.2克 、
、 、
、 和“镁粉”置于烧杯中,逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失,四种固体消耗稀盐酸的质量如表所示,且烧杯③和烧杯④中产生了大量气泡,请结合实验现象和数据回答问题。
和“镁粉”置于烧杯中,逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失,四种固体消耗稀盐酸的质量如表所示,且烧杯③和烧杯④中产生了大量气泡,请结合实验现象和数据回答问题。

(1)烧杯③中产生的气体是___________ 。
(2)“镁粉”中不只含有 一种物质,理由是
一种物质,理由是___________ 。
(3)请书写烧杯②中发生的离子方程式___________ 。
(4)表格中 的值为
的值为___________ 。
(5)为确定“镁粉”的具体成分,兴趣小组补充了如下实验:取“镁粉”和 各4.2g,加入足量稀盐酸,生成相同条件下的气体体积分别为952mL和1120mL,由此可知该种“镁粉”的成分是___________
各4.2g,加入足量稀盐酸,生成相同条件下的气体体积分别为952mL和1120mL,由此可知该种“镁粉”的成分是___________
 、
、 、
、 中的一种或几种固体。某兴趣小组对其成分展开了探究:分别取4.2克
中的一种或几种固体。某兴趣小组对其成分展开了探究:分别取4.2克 、
、 、
、 和“镁粉”置于烧杯中,逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失,四种固体消耗稀盐酸的质量如表所示,且烧杯③和烧杯④中产生了大量气泡,请结合实验现象和数据回答问题。
和“镁粉”置于烧杯中,逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失,四种固体消耗稀盐酸的质量如表所示,且烧杯③和烧杯④中产生了大量气泡,请结合实验现象和数据回答问题。
| 物质 |  |  |  | “镁粉” |
消耗盐酸的质量 | 121.8 |  | 58.0 | 61.9 |
(1)烧杯③中产生的气体是
(2)“镁粉”中不只含有
 一种物质,理由是
一种物质,理由是(3)请书写烧杯②中发生的离子方程式
(4)表格中
 的值为
的值为(5)为确定“镁粉”的具体成分,兴趣小组补充了如下实验:取“镁粉”和
 各4.2g,加入足量稀盐酸,生成相同条件下的气体体积分别为952mL和1120mL,由此可知该种“镁粉”的成分是___________
各4.2g,加入足量稀盐酸,生成相同条件下的气体体积分别为952mL和1120mL,由此可知该种“镁粉”的成分是___________A. 和 和 | B. 和 和 |
C. 和 和 | D. |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】铋(Bi)的化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为 ,含FeS、CuO、
,含FeS、CuO、 等杂质)制备
等杂质)制备 的工艺流程如下:
的工艺流程如下:
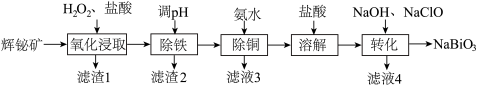
已知:
ⅰ. 难溶于冷水;滤渣1含S;
难溶于冷水;滤渣1含S;
ⅱ.“氧化浸取”时,铋元素转化为 ,硫元素转化为硫单质;
,硫元素转化为硫单质;
iii.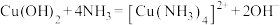 。
。
回答下列问题。
(1)“氧化浸取”步骤中温度升高可以增大速率,但高于50 ℃时浸取速率会下降,其可能的原因是_______ 。
(2)“氧化浸取”时,FeS发生反应的离子方程式为_______ 。
(3)“除铁”步骤中调节pH最好选用的试剂为_______(填字母)。
(4)“转化”时,生成 的反应中氧化剂与氧化产物的物质的量之比为
的反应中氧化剂与氧化产物的物质的量之比为_______ 。
(5) 产品纯度的测定。取
产品纯度的测定。取 产品
产品 ,加入足量稀硫酸和
,加入足量稀硫酸和 稀溶液10 mL使其完全反应(Bi被还原为+3价),再用
稀溶液10 mL使其完全反应(Bi被还原为+3价),再用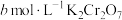 标准溶液滴定溶液中剩余的
标准溶液滴定溶液中剩余的 ,恰好消耗
,恰好消耗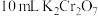 标准溶液。该产品的纯度为
标准溶液。该产品的纯度为_______ (用含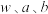 的代数式表示)。
的代数式表示)。
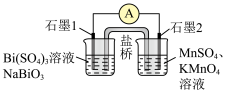
(6)组装为下图装置后发现导线中电流方向为石墨1→石墨2,则该装置的负极为_______ ,石墨2电极上的电极反应式为_______ 。
 ,含FeS、CuO、
,含FeS、CuO、 等杂质)制备
等杂质)制备 的工艺流程如下:
的工艺流程如下:
已知:
ⅰ.
 难溶于冷水;滤渣1含S;
难溶于冷水;滤渣1含S;ⅱ.“氧化浸取”时,铋元素转化为
 ,硫元素转化为硫单质;
,硫元素转化为硫单质;iii.
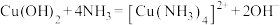 。
。回答下列问题。
(1)“氧化浸取”步骤中温度升高可以增大速率,但高于50 ℃时浸取速率会下降,其可能的原因是
(2)“氧化浸取”时,FeS发生反应的离子方程式为
(3)“除铁”步骤中调节pH最好选用的试剂为_______(填字母)。
| A.稀硫酸 | B.碳酸钠 | C.三氧化二铋 | D.氨水 |
(4)“转化”时,生成
 的反应中氧化剂与氧化产物的物质的量之比为
的反应中氧化剂与氧化产物的物质的量之比为(5)
 产品纯度的测定。取
产品纯度的测定。取 产品
产品 ,加入足量稀硫酸和
,加入足量稀硫酸和 稀溶液10 mL使其完全反应(Bi被还原为+3价),再用
稀溶液10 mL使其完全反应(Bi被还原为+3价),再用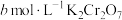 标准溶液滴定溶液中剩余的
标准溶液滴定溶液中剩余的 ,恰好消耗
,恰好消耗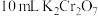 标准溶液。该产品的纯度为
标准溶液。该产品的纯度为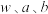 的代数式表示)。
的代数式表示)。(6)组装为下图装置后发现导线中电流方向为石墨1→石墨2,则该装置的负极为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】日常生活、工农业生产和科学研究都离不开物质的制备。
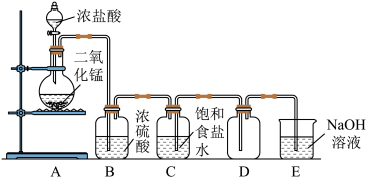
(1)上图为制取氯气的实验装置图,指出上图装置中三处错误_______ ,_______ ,_______ 。
(2)写出该实验中浓盐酸与二氧化锰制备氯气的化学方程式:_______ 。
(3)盛NaOH溶液的烧杯的作用是_______ ,反应的离子方程式是_______ 。
(4)实验室有时用高锰酸钾代替二氧化锰与浓盐酸反应制取氯气,2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。写出该反应的离子方程式_______ ,该反应的氧化剂是_______ ,氧化产物是_______ ,表现酸性的HCl和表现还原性的HCl质量之比_______ 。

(1)上图为制取氯气的实验装置图,指出上图装置中三处错误
(2)写出该实验中浓盐酸与二氧化锰制备氯气的化学方程式:
(3)盛NaOH溶液的烧杯的作用是
(4)实验室有时用高锰酸钾代替二氧化锰与浓盐酸反应制取氯气,2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。写出该反应的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】氯气在工业上有着重要的用途,某兴趣小组在实验室中模拟工业上用氯气制备无水氯化铝(无水AlCl3遇潮湿空气即产生大量白雾),可用下列装置制备。
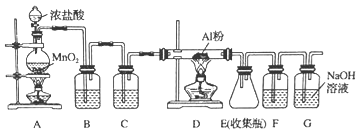
(1) 装置B中盛放__________ 溶液,其作用是_________ ;F中的是______ 溶液,其作用是_____________ 。
(2)装置A实验开始前,应先_________ ,接下来的操作依次是_____________ (填序号)。
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
(3)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为﹣59℃,液体为红色;Cl2沸点为﹣34℃,液态为黄绿色。
①设计最简单的实验验证Cl2中含有ClO2:收集一试管气体,盖上胶塞,放入冰水混合物中,若____________ ,则说明Cl2中含有ClO2 。
②将过硫酸钠(Na2S2O8)液加入亚氯酸钠(NaClO2)中可制备ClO2,NaClO2中Cl元素的化合价是___________ ,该反应中氧化剂和还原剂的物质的量之比为________ 。
③将ClO2通入MnSO4溶液,溶液中可检测到Cl-,同时有黑色MnO2沉淀生成。该反应的离子方程式为:___________ 。

(1) 装置B中盛放
(2)装置A实验开始前,应先
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
(3)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为﹣59℃,液体为红色;Cl2沸点为﹣34℃,液态为黄绿色。
①设计最简单的实验验证Cl2中含有ClO2:收集一试管气体,盖上胶塞,放入冰水混合物中,若
②将过硫酸钠(Na2S2O8)液加入亚氯酸钠(NaClO2)中可制备ClO2,NaClO2中Cl元素的化合价是
③将ClO2通入MnSO4溶液,溶液中可检测到Cl-,同时有黑色MnO2沉淀生成。该反应的离子方程式为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】肉桂酸(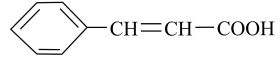 )主要用于香精香料、食品添加剂、医药工业、美容、农药有机合成等方面。实验室可通过如下反应合成:
)主要用于香精香料、食品添加剂、医药工业、美容、农药有机合成等方面。实验室可通过如下反应合成:
主反应: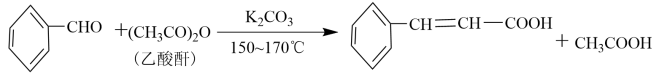
副反应: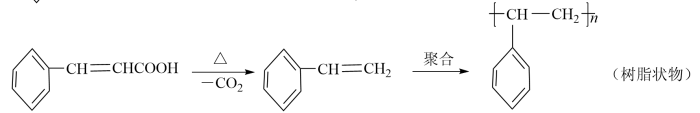
实验所用药品信息如下表所示:
实验步骤:
Ⅰ.将7.00g无水 、14.5mL乙酸酐和5.0mL苯甲醛依次加入150mL仪器a中,加热至微沸后保持温度150~170℃加热回流30~45min。
、14.5mL乙酸酐和5.0mL苯甲醛依次加入150mL仪器a中,加热至微沸后保持温度150~170℃加热回流30~45min。
Ⅱ.将反应后的混合物冷却,边搅拌边分次加入40mL水浸泡。
Ⅲ.连接水蒸气蒸馏装置将苯甲醛用水蒸气蒸馏除去。
Ⅳ.将仪器a冷却,加入40mL 10% NaOH溶液,使所有的肉桂酸形成钠盐而溶解。加入90mL蒸馏水,将混合物加热,活性炭脱色,趁热过滤除去树脂状物,将滤液冷却至室温以下。
Ⅴ.边搅拌边将20mL浓盐酸和20mL水的混合物加到肉桂酸盐溶液中至呈酸性。用冷水冷却,待结晶完全后抽滤得到粗产品,粗产品经进一步提纯后,得到3.56g产品。

回答下列问题:
(1)仪器a的名称为_______ ,仪器b的作用为_______ 。
(2)冷却水的入口为_______ (填“m”或“n”)。
(3)水蒸气蒸馏进行完全的标志是_______ 。
(4)步骤Ⅳ趁热过滤的目的是_______ 。
(5)加入浓盐酸与水的混合物后发生反应的化学方程式为_______ 。
(6)将粗产品提纯的操作名称为_______ ;本实验中肉桂酸的产率为_______ %(保留三位有效数字)。
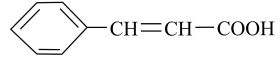 )主要用于香精香料、食品添加剂、医药工业、美容、农药有机合成等方面。实验室可通过如下反应合成:
)主要用于香精香料、食品添加剂、医药工业、美容、农药有机合成等方面。实验室可通过如下反应合成:主反应:

副反应:

实验所用药品信息如下表所示:
| 名称 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/ | 溶解性 |
| 苯甲醛 | 106 | -26 | 179 | 1.06 | 微溶于水,与苯,乙醇、乙醚混溶 |
| 乙酸酐 | 102 | -73.1 | 138.6 | 1.082 | 能溶于水 |
| 肉桂酸 | 148 | 133 | 300 | 1.248 | 不溶于冷水,易溶于苯、乙醚,在热水中溶于乙醇 |
Ⅰ.将7.00g无水
 、14.5mL乙酸酐和5.0mL苯甲醛依次加入150mL仪器a中,加热至微沸后保持温度150~170℃加热回流30~45min。
、14.5mL乙酸酐和5.0mL苯甲醛依次加入150mL仪器a中,加热至微沸后保持温度150~170℃加热回流30~45min。Ⅱ.将反应后的混合物冷却,边搅拌边分次加入40mL水浸泡。
Ⅲ.连接水蒸气蒸馏装置将苯甲醛用水蒸气蒸馏除去。
Ⅳ.将仪器a冷却,加入40mL 10% NaOH溶液,使所有的肉桂酸形成钠盐而溶解。加入90mL蒸馏水,将混合物加热,活性炭脱色,趁热过滤除去树脂状物,将滤液冷却至室温以下。
Ⅴ.边搅拌边将20mL浓盐酸和20mL水的混合物加到肉桂酸盐溶液中至呈酸性。用冷水冷却,待结晶完全后抽滤得到粗产品,粗产品经进一步提纯后,得到3.56g产品。

回答下列问题:
(1)仪器a的名称为
(2)冷却水的入口为
(3)水蒸气蒸馏进行完全的标志是
(4)步骤Ⅳ趁热过滤的目的是
(5)加入浓盐酸与水的混合物后发生反应的化学方程式为
(6)将粗产品提纯的操作名称为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验。

(1)此装置中,怎样检查除启普发生器之外的装置的气密性?_______ 。
(2)实验开始时,先打开a、b产生氢气,一段时间后,再点燃酒精灯加热,目的是_______ 。
(3)该装置中,碱石灰的作用是_______ 。
(4)实际实验过程中观察到Na2O2熔化后,很快变成白色粉末。但干燥管内硫酸铜并未变成蓝色。则Na2O2与H2反应的化学方式为_______ 。
(5)出于实验安全考虑,实验结束时_______ 。
A.应先关闭活塞b,然后移去酒精灯
B.应先移去酒精灯,然后关闭活塞b
C.A和B都可以
(6)制取Na2O时由于设备密封性不好而进入了少量空气,导致制得的Na2O产品中含有Na2O2杂质。某学生设计了以下实验方案来测定该样品中Na2O的质量分数,其操作流程和实验数据如图:
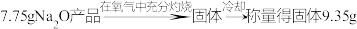
该氧化钠样品中Na2O的质量分数为_______ 。

(1)此装置中,怎样检查除启普发生器之外的装置的气密性?
(2)实验开始时,先打开a、b产生氢气,一段时间后,再点燃酒精灯加热,目的是
(3)该装置中,碱石灰的作用是
(4)实际实验过程中观察到Na2O2熔化后,很快变成白色粉末。但干燥管内硫酸铜并未变成蓝色。则Na2O2与H2反应的化学方式为
(5)出于实验安全考虑,实验结束时
A.应先关闭活塞b,然后移去酒精灯
B.应先移去酒精灯,然后关闭活塞b
C.A和B都可以
(6)制取Na2O时由于设备密封性不好而进入了少量空气,导致制得的Na2O产品中含有Na2O2杂质。某学生设计了以下实验方案来测定该样品中Na2O的质量分数,其操作流程和实验数据如图:
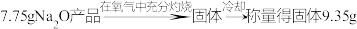
该氧化钠样品中Na2O的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某化学兴趣小组拟采用如下图所示装置(部分夹持装置略去)制取氨基钾(KNH2)。已知氨基钾很容易与空气中的水和二氧化碳反应。
(1)A装置装药品前应检验气密性,操作是_______ 。浓氨水与生石灰混合能迅速产生氨气,主要原因是_______ 。
(2)整套装置的连接顺序为a-_______ (装置不重复使用)。
(3)实验开始时应先打开分液漏斗的活塞,再点燃酒精灯,目的是_______ 。药品M为_______ (填字母标号)。
A.无水氯化钙 B.碱石灰 C.五氧化二磷 D.浓硫酸
(4)D中硬质玻璃管内发生反应化学方程式为_______ 。
(5)B装置的作用是_______ 。
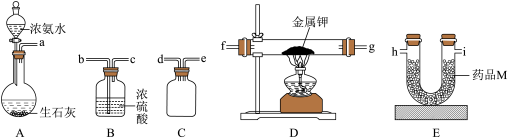
(1)A装置装药品前应检验气密性,操作是
(2)整套装置的连接顺序为a-
(3)实验开始时应先打开分液漏斗的活塞,再点燃酒精灯,目的是
A.无水氯化钙 B.碱石灰 C.五氧化二磷 D.浓硫酸
(4)D中硬质玻璃管内发生反应化学方程式为
(5)B装置的作用是
您最近一年使用:0次




