运用化学反应原理研究氮的单质及其化合物的反应对缓解环境污染有重要意义。
(1)一定温度和压强下,由最稳定的单质生成1mol纯物质的热效应,称为该物质的生成焓(∆H)。
则2NO2(g)+2C(s)⇌N2(g)+2CO2(g) ∆H=_______ kJ·mol-1
(2)一定温度下,在起始体积为1L的恒压(20MPa)密闭容器中,1molNO2和足量C发生以上反应。(不考虑2NO2⇌N2O4)
①下列选项能够判断该反应已达到平衡状态的是_______ (填字母)。
A.混合气体的密度保持不变
B.2v(N2)=v(CO2)
C.混合气体的压强保持不变
D.CO2的体积分数保持不变
②实验测得NO2转化率与时间的关系如图所示:
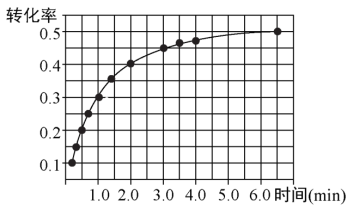
反应达到平衡时CO2的体积分数为_______ ,平衡常数Kp=_______ MPa(以分压表示,分压=总压×物质的量分数)。待反应达到平衡后,缩小容器体积,平衡将_______ (填“正向移动”、“逆向移动”或“不移动”),混合气体的平均摩尔质量将_______ (填“变大”、“变小”、“不变”或“无法判断”)。
(3)电化学制备方法:已知反应2H2O2=2H2O+O2↑能自发进行,反向不能自发进行,通过电解可以实现由H2O和O2为原料制备H2O2,如图为制备装置示意图。
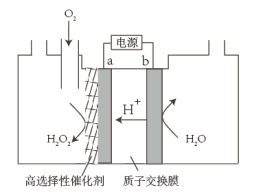
①a极的电极反应式是_______ 。
②下列说法正确的是_______ 。
A.该装置可以实现电能转化为化学能
B.电极b连接电源负极
C.该方法相较于早期剂备方法具有原料廉价,对环境友好等优点
(1)一定温度和压强下,由最稳定的单质生成1mol纯物质的热效应,称为该物质的生成焓(∆H)。
| 物质 | NO2(g) | CO2(g) |
| 生成焓(∆H)/kJ·mol-1 | +33.2 | -393.5 |
则2NO2(g)+2C(s)⇌N2(g)+2CO2(g) ∆H=
(2)一定温度下,在起始体积为1L的恒压(20MPa)密闭容器中,1molNO2和足量C发生以上反应。(不考虑2NO2⇌N2O4)
①下列选项能够判断该反应已达到平衡状态的是
A.混合气体的密度保持不变
B.2v(N2)=v(CO2)
C.混合气体的压强保持不变
D.CO2的体积分数保持不变
②实验测得NO2转化率与时间的关系如图所示:

反应达到平衡时CO2的体积分数为
(3)电化学制备方法:已知反应2H2O2=2H2O+O2↑能自发进行,反向不能自发进行,通过电解可以实现由H2O和O2为原料制备H2O2,如图为制备装置示意图。

①a极的电极反应式是
②下列说法正确的是
A.该装置可以实现电能转化为化学能
B.电极b连接电源负极
C.该方法相较于早期剂备方法具有原料廉价,对环境友好等优点
更新时间:2021-06-24 18:16:04
|
【知识点】 化学反应原理综合考查解读
相似题推荐
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】测定平衡常数对定量认识化学反应具有重要意义。已知:I2能与I-反应成I3-,并在溶液中建立如下平衡:I2+I-  I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I、某同学为测定上述平衡体系中c (I2),采用如下方法:取V1mL平衡混合溶液,用c mol/L的Na2S203溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗V2mL的Na2S2O3溶液。根据V1、V2和c可求得c(I2)。
(1)上述滴定时,可采用____ 做指示剂,滴定终点的现象是____ 。
(2)下列对该同学设计方案的分析,正确的是______ 填字母)。
A.方案可行。能准确测定溶液中的c (I2)
B.不可行。因为I-能与Na2S2O3发生反应
C.不可行。只能测得溶液中c(I2)与c(I3-)之和
Ⅱ、化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):
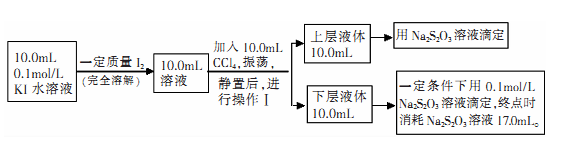
已知:①I-和I3-不溶于CC14;②一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
(3)操作I使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是____ (填名称)。试指出该操作中应注意的事项为____ 。(任写一条)
(4)下层液体中碘单质的物质的量浓度是________ 。
(5)实验测得上层溶液中c(I3-)=0.049 mol/L,结合上述有关数据,计算室温条件下反应I2+I- I3-的平衡常数K=
I3-的平衡常数K= ___ (用具体数据列出计算式即可)。
 I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。I、某同学为测定上述平衡体系中c (I2),采用如下方法:取V1mL平衡混合溶液,用c mol/L的Na2S203溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗V2mL的Na2S2O3溶液。根据V1、V2和c可求得c(I2)。
(1)上述滴定时,可采用
(2)下列对该同学设计方案的分析,正确的是
A.方案可行。能准确测定溶液中的c (I2)
B.不可行。因为I-能与Na2S2O3发生反应
C.不可行。只能测得溶液中c(I2)与c(I3-)之和
Ⅱ、化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):

已知:①I-和I3-不溶于CC14;②一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
(3)操作I使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是
(4)下层液体中碘单质的物质的量浓度是
(5)实验测得上层溶液中c(I3-)=0.049 mol/L,结合上述有关数据,计算室温条件下反应I2+I-
 I3-的平衡常数K=
I3-的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】聚合氯化铝是一种新型净水剂,其中铝的总浓度(用c表示)包括三类:主要为Al3+中的单体形态铝(用Ala表示)总浓度,主要为 [AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝(用Alc表示)总浓度。
(1)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) ΔH1=akJ·mol-1
②6AlCl(g)=4Al(s)+2AlCl3(g) ΔH2=bkJ·mol-1
则反应Al2O3(s) +3C(s)=2Al (s)+3CO(g) 说明ΔH=_______ kJ·mol-1(用含a、b的代数式表示)。
_0( 填“>”或“<”)。
反应①在常压、1900℃的高温下才能进行,说明ΔH_______ 0(填“>”、“<”或“=”)
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝溶液中铝形态分布(百分数)如右表:
①在一定温度下,AlT越大,Al(OH)3胶体的百分含量________ (填“越大”“越小”或“不变”)。
②若将c=2.520mol/L的聚合氧化铝溶液加水稀释,则稀释过程中发生的主要反应的离子方程式为_________________________________ 。
(3)一定条件下,向1.0mol/L的AlCl溶液中加入0.6mol/L的NaOH溶液,可制得Alb含量约为86% 的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:_________________________ 。
(4)已知Al3++4X 2
2 ,X表示显色剂,
,X表示显色剂,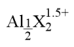 表示有色物质,通过比色分析得
表示有色物质,通过比色分析得
到25 ℃时Al3+浓度随时间的变化关系如图所示(初始时X的浓度为0.194 mol·L-1)。

①1min时,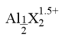 的浓度为
的浓度为___________ 。
②0~3min内该反应的速率vx=________ 。
③第9min时,反应达到平衡,K=__________ (用代数式表示)。
(1)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) ΔH1=akJ·mol-1
②6AlCl(g)=4Al(s)+2AlCl3(g) ΔH2=bkJ·mol-1
则反应Al2O3(s) +3C(s)=2Al (s)+3CO(g) 说明ΔH=
_0( 填“>”或“<”)。
反应①在常压、1900℃的高温下才能进行,说明ΔH
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝溶液中铝形态分布(百分数)如右表:
| AlT/(mol·L-1) | Ala/% | Alb/% | A1c/% |
| 0.208 | 1.4 | 86.6 | 12.0 |
| 0.489 | 2.3 | 86.2 | 11.5 |
| 0.884 | 2.3 | 88.1 | 9.6 |
| 1.613 | 3.1 | 87.0 | 9.9 |
| 2.520 | 4.5 | 88.2 | 7.3 |
①在一定温度下,AlT越大,Al(OH)3胶体的百分含量
②若将c=2.520mol/L的聚合氧化铝溶液加水稀释,则稀释过程中发生的主要反应的离子方程式为
(3)一定条件下,向1.0mol/L的AlCl溶液中加入0.6mol/L的NaOH溶液,可制得Alb含量约为86% 的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:
(4)已知Al3++4X
 2
2 ,X表示显色剂,
,X表示显色剂,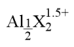 表示有色物质,通过比色分析得
表示有色物质,通过比色分析得到25 ℃时Al3+浓度随时间的变化关系如图所示(初始时X的浓度为0.194 mol·L-1)。

①1min时,
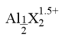 的浓度为
的浓度为②0~3min内该反应的速率vx=
③第9min时,反应达到平衡,K=
您最近一年使用:0次
【推荐3】2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。回答下列问题:
(1)在一定温度下,向容积固定的密闭容器中加入足量的 和
和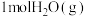 ,起始压强为
,起始压强为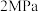 时,发生下列反应生成水煤气:
时,发生下列反应生成水煤气:
I.
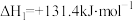
II.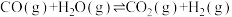
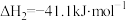
①列说法正确的是___________ 。
A.平衡时向容器中充入惰性气体,反应I的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时 的体积分数可能大于
的体积分数可能大于
D.将炭块粉碎,可加快反应速率
②反应平衡时, 的转化率为70%,
的转化率为70%, 的物质的量为
的物质的量为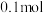 。此时,整个体系
。此时,整个体系___________ (填“吸收”或“放出”)热量___________ kJ,反应I的平衡常数
___________ (以分压表示,分压=总压×物质的量分数,保留两位有效数字)。
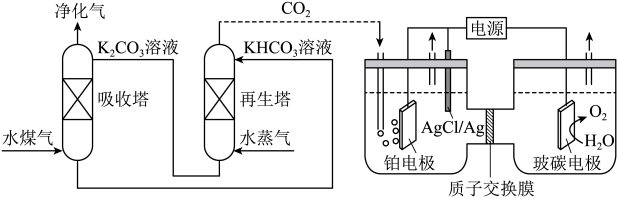
(2)一种脱除和利用水煤气中 方法的示意图如下。
方法的示意图如下。
①某温度下,吸收塔中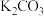 溶液吸收一定量的
溶液吸收一定量的 后,
后,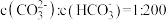 ,则该溶液的
,则该溶液的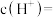
___________ (该温度下 的
的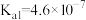 ,
,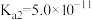 )。
)。
②吸收塔中 被吸收的离子方程式为
被吸收的离子方程式为___________ 。
③利用电化学原理,将 电催化还原为
电催化还原为 ,同时阳极得到氧气,阳极反应式为
,同时阳极得到氧气,阳极反应式为___________ 。
(1)在一定温度下,向容积固定的密闭容器中加入足量的
 和
和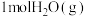 ,起始压强为
,起始压强为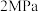 时,发生下列反应生成水煤气:
时,发生下列反应生成水煤气:I.

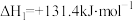
II.
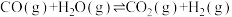
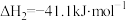
①列说法正确的是
A.平衡时向容器中充入惰性气体,反应I的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时
 的体积分数可能大于
的体积分数可能大于
D.将炭块粉碎,可加快反应速率
②反应平衡时,
 的转化率为70%,
的转化率为70%, 的物质的量为
的物质的量为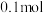 。此时,整个体系
。此时,整个体系
(2)一种脱除和利用水煤气中
 方法的示意图如下。
方法的示意图如下。
①某温度下,吸收塔中
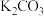 溶液吸收一定量的
溶液吸收一定量的 后,
后,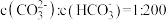 ,则该溶液的
,则该溶液的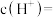
 的
的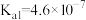 ,
,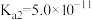 )。
)。②吸收塔中
 被吸收的离子方程式为
被吸收的离子方程式为③利用电化学原理,将
 电催化还原为
电催化还原为 ,同时阳极得到氧气,阳极反应式为
,同时阳极得到氧气,阳极反应式为
您最近一年使用:0次



