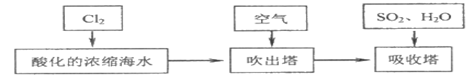
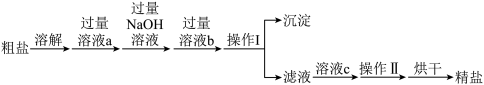
海水是巨大的资源宝库,甲工厂从海水中提取食盐和溴的工艺流程如图:
已知:Br2的沸点为59℃,微溶于水,有毒。
(1)海水淡化得到淡水的方法主要有___________ 。(写出两种即可)
(2)为了将粗盐(含杂质Mg2+、 、
、 )提纯,加入的试剂顺序可行的是
)提纯,加入的试剂顺序可行的是___________
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(3)制备钠单质的方法之一是电解熔融NaCl,写出电解的化学方程式___________ 。
(4)步骤Ⅱ在此流程中作用是___________ 。
(5)乙工厂在甲工厂的流程设计基础上进行了改进,步骤Ⅱ中用Na2CO3溶液吸收空气中Br2.充分反应后,得到含NaBr、NaBrO3等物质的混合溶液。步骤Ⅲ向所得溶液中滴加稀硫酸,蒸馏即得到液溴。请写出步骤Ⅲ滴加稀硫酸的离子方程式______________________ 。
(6)与甲工厂相比,乙工厂设计流程的优点为___________ 。

已知:Br2的沸点为59℃,微溶于水,有毒。
(1)海水淡化得到淡水的方法主要有
(2)为了将粗盐(含杂质Mg2+、
 、
、 )提纯,加入的试剂顺序可行的是
)提纯,加入的试剂顺序可行的是A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(3)制备钠单质的方法之一是电解熔融NaCl,写出电解的化学方程式
(4)步骤Ⅱ在此流程中作用是
(5)乙工厂在甲工厂的流程设计基础上进行了改进,步骤Ⅱ中用Na2CO3溶液吸收空气中Br2.充分反应后,得到含NaBr、NaBrO3等物质的混合溶液。步骤Ⅲ向所得溶液中滴加稀硫酸,蒸馏即得到液溴。请写出步骤Ⅲ滴加稀硫酸的离子方程式
(6)与甲工厂相比,乙工厂设计流程的优点为
更新时间:2021-07-14 16:58:39
|
相似题推荐
【推荐1】现有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 九种物质,其中
九种物质,其中 为淡黄色粉末,
为淡黄色粉末, 为黄绿色气体单质,
为黄绿色气体单质, 为无色气体单质,
为无色气体单质, 的水溶液与石灰水混合可得
的水溶液与石灰水混合可得 的溶液,它们之间的相互转化关系如图所示,其他与题无关的生成物均已略去。
的溶液,它们之间的相互转化关系如图所示,其他与题无关的生成物均已略去。

请回答下列问题:
(1)写出 、
、 的化学式:
的化学式:
___________ ,
___________ 。 的俗名是
的俗名是___________ , 的重要用途:
的重要用途:___________ 。
(2)写出反应①②的离子方程式:①___________ ;②___________ 。
(3)已知 (氰根离子)和
(氰根离子)和 有相似之处;氰分子
有相似之处;氰分子 的性质与
的性质与 的性质有相似之处,且常温常压下是气体。试写出
的性质有相似之处,且常温常压下是气体。试写出 和
和 溶液加热反应的化学方程式:
溶液加热反应的化学方程式:___________ 。
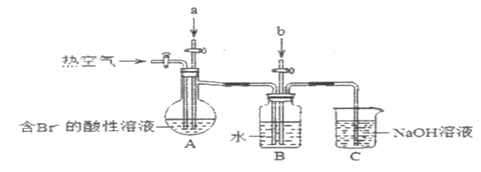
(4)利用如图装置进行实验,证明氧化性强弱: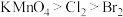 。限选试剂:
。限选试剂: 溶液、
溶液、 、浓盐酸、浓硫酸。
、浓盐酸、浓硫酸。

已知: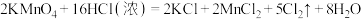 。
。
请回答下列问题:
①装置 、
、 中盛放的试剂分别是
中盛放的试剂分别是___________ 、___________ 。
②此实验装置的不足之处是___________ 。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 九种物质,其中
九种物质,其中 为淡黄色粉末,
为淡黄色粉末, 为黄绿色气体单质,
为黄绿色气体单质, 为无色气体单质,
为无色气体单质, 的水溶液与石灰水混合可得
的水溶液与石灰水混合可得 的溶液,它们之间的相互转化关系如图所示,其他与题无关的生成物均已略去。
的溶液,它们之间的相互转化关系如图所示,其他与题无关的生成物均已略去。
请回答下列问题:
(1)写出
 、
、 的化学式:
的化学式:

 的俗名是
的俗名是 的重要用途:
的重要用途:(2)写出反应①②的离子方程式:①
(3)已知
 (氰根离子)和
(氰根离子)和 有相似之处;氰分子
有相似之处;氰分子 的性质与
的性质与 的性质有相似之处,且常温常压下是气体。试写出
的性质有相似之处,且常温常压下是气体。试写出 和
和 溶液加热反应的化学方程式:
溶液加热反应的化学方程式:(4)利用如图装置进行实验,证明氧化性强弱:
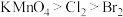 。限选试剂:
。限选试剂: 溶液、
溶液、 、浓盐酸、浓硫酸。
、浓盐酸、浓硫酸。
已知:
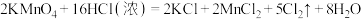 。
。请回答下列问题:
①装置
 、
、 中盛放的试剂分别是
中盛放的试剂分别是②此实验装置的不足之处是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】下图所涉及的物质均为中学化学中的常见物质,A为常见的金属单质,E为红棕色沉淀。它们存在如下转化关系,反应中生成的水及次要产物均已略去。

请回答下列问题:
(1)写出有关物质的化学式:B_______ 、D_______ 、E_______ 。
(2)请写出A→B的化学方程式:_______ ,若反应消耗2.24LCl2(标准状况下),转移的电子数为_______ 。
(3)请写出C →D的离子方程式:_______ , 实验室中由C制备D时,试管上面会滴一层植物油,这样做的目的是_______ 。
(4)请写出D →E的化学方程式:_______ ,该反应属于_______ (填四大基本反应类型)。

请回答下列问题:
(1)写出有关物质的化学式:B
(2)请写出A→B的化学方程式:
(3)请写出C →D的离子方程式:
(4)请写出D →E的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
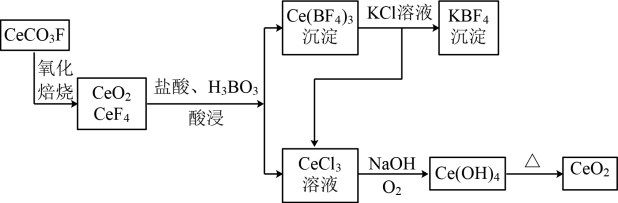
【推荐3】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeCO3F)为原料制备CeO2的一种工艺流程如图所示。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是___________ 。
(2)“酸浸”过程中用稀硫酸和H2O2替换盐酸不会造成环境污染。写出稀硫酸、H2O2与CeO2反应的离子方程式___________ 。
(3)向Ce(BF4)3中加KCl溶液的目的是提高___________ 的产率。
(4)取上述流程中得到的CeO2产品0.4500g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗25.00mL标准溶液。
①实验室配制FeSO4溶液时需添加的试剂是___________ 。
②该产品中CeO2的质量分数为___________ (结果保留两位小数)。
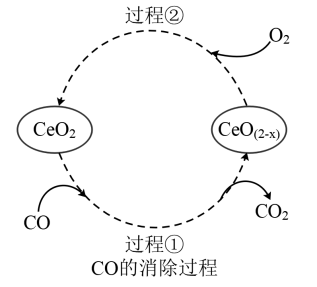
(5)CeO2是汽车尾气净化催化剂中最重要的助剂,工作原理如下图所示。写出过程①发生反应的化学方程式___________ 。

回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是
(2)“酸浸”过程中用稀硫酸和H2O2替换盐酸不会造成环境污染。写出稀硫酸、H2O2与CeO2反应的离子方程式
(3)向Ce(BF4)3中加KCl溶液的目的是提高
(4)取上述流程中得到的CeO2产品0.4500g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗25.00mL标准溶液。
①实验室配制FeSO4溶液时需添加的试剂是
②该产品中CeO2的质量分数为
(5)CeO2是汽车尾气净化催化剂中最重要的助剂,工作原理如下图所示。写出过程①发生反应的化学方程式

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足的盐矿资源。盐体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含 、
、 、
、 、
、 、
、 等)来制取较纯净的氯化钾晶体及液溴(
等)来制取较纯净的氯化钾晶体及液溴( ),他们设计了如下流程:
),他们设计了如下流程:
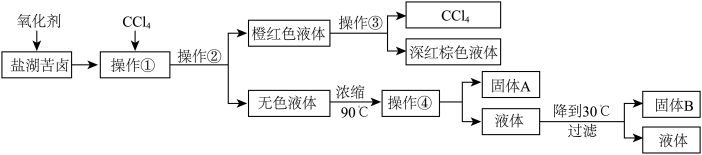
请根据以上流程,回答相关问题:
(1)操作①是_____________ ;操作②是_____________ ;操作③是_____________ ;操作④所需要的玻璃仪器有__________________________ 。
(2)参照如图所示溶解度曲线,欲得到较纯净的氯化钾晶体需用少量的____________ (填“热水”或“冷水”)洗涤固体____________ (填“A”或“B”)。
 、
、 、
、 、
、 、
、 等)来制取较纯净的氯化钾晶体及液溴(
等)来制取较纯净的氯化钾晶体及液溴( ),他们设计了如下流程:
),他们设计了如下流程:
请根据以上流程,回答相关问题:
(1)操作①是
(2)参照如图所示溶解度曲线,欲得到较纯净的氯化钾晶体需用少量的
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】以钒矿石为原料制备化工产品 的一种工艺流程如下;
的一种工艺流程如下;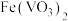 、
、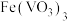 、
、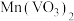 、
、 ;“酸浸”后,钒以
;“酸浸”后,钒以 形式存在。
形式存在。
ii.P204对四价钒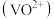 具有高选择性,萃取
具有高选择性,萃取 而不萃取
而不萃取 。
。
iii.多钒酸铵微溶于冷水,易溶于热水。
iv.该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)基态Fe的价电子排布式为________ 。
(2)“还原中和”时,还原步骤中 参与反应的离子方程式为
参与反应的离子方程式为________ 。
(3)钒的漫出率与焙烧温度、硫酸加入量的关系如图1、图2所示。指出适宜的工艺条件为________ 。使用冰水洗涤多钒酸铵的目的是________ 。________ 。
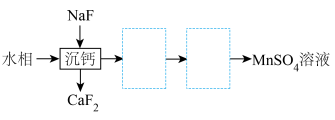
(5)萃取后的“水相”中含有丰富的金属资源,经三道工序可回收 溶液。请根据题给信息,参照上述工艺流程,选用括号中所给试剂,将下列工艺流程剩余两步工序补充完整
溶液。请根据题给信息,参照上述工艺流程,选用括号中所给试剂,将下列工艺流程剩余两步工序补充完整____ ( 、稀
、稀 、MnO、
、MnO、 、
、 )。
)。 、
、 的
的 分别为
分别为 、
、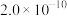 ,若上述水相“沉钙”后
,若上述水相“沉钙”后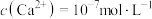 ,理论上
,理论上 不超过
不超过________  。
。
 的一种工艺流程如下;
的一种工艺流程如下;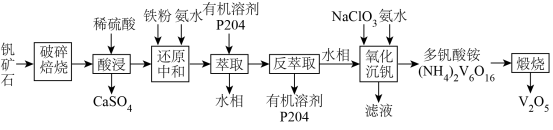
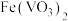 、
、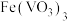 、
、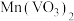 、
、 ;“酸浸”后,钒以
;“酸浸”后,钒以 形式存在。
形式存在。ii.P204对四价钒
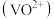 具有高选择性,萃取
具有高选择性,萃取 而不萃取
而不萃取 。
。iii.多钒酸铵微溶于冷水,易溶于热水。
iv.该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 |
|
|
|
|
开始沉淀pH | 1.9 | 7.0 | 11.9 | 8.1 |
完全沉淀pH | 3.2 | 9.0 | 13.9 | 10.1 |
(1)基态Fe的价电子排布式为
(2)“还原中和”时,还原步骤中
 参与反应的离子方程式为
参与反应的离子方程式为(3)钒的漫出率与焙烧温度、硫酸加入量的关系如图1、图2所示。指出适宜的工艺条件为

(5)萃取后的“水相”中含有丰富的金属资源,经三道工序可回收
 溶液。请根据题给信息,参照上述工艺流程,选用括号中所给试剂,将下列工艺流程剩余两步工序补充完整
溶液。请根据题给信息,参照上述工艺流程,选用括号中所给试剂,将下列工艺流程剩余两步工序补充完整 、稀
、稀 、MnO、
、MnO、 、
、 )。
)。
 、
、 的
的 分别为
分别为 、
、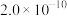 ,若上述水相“沉钙”后
,若上述水相“沉钙”后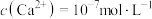 ,理论上
,理论上 不超过
不超过 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】五氧化二钒(V2O5)在冶金、化工等领域有重要应用。实验室以含钒废料(含V2O3、FeO、CuO、MnO、SiO2、Al2O3、有机物)为原料制备V2O5的一种流程如图:
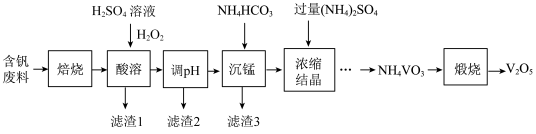
已知:25℃时,难溶电解质的溶度积常数如表所示:
(1)“焙烧”的目的是______ 。
(2)酸溶时加入H2O2的目的是_______ 。
(3)常温下,若“调pH”为7,Cu2+是否能沉淀完全:______ (填“是”或“否”)(溶液中离子浓度小于10-5mol•L-1时,认为该离子沉淀完全)。
(4)“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为______ 。
(5)结晶所得的NH4VO3需进行水洗、干燥。证明NH4VO3已洗涤干净的实验操作及现象_____ 。
(6)为测定该产品的纯度,兴趣小组同学准确称取V2O5产品2.000g,加入过量稀硫酸使其完全反应,生成(VO2)2SO4,并配成100mL溶液。取10.00mL溶液用0.1000mol•L-1的H2C2O4标准溶液滴定,滴定到终点时消耗标准液10.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO 黄色(被还原为VO2+蓝色),该反应的离子方程式:
黄色(被还原为VO2+蓝色),该反应的离子方程式:______ ;该产品的纯度为______ 。

已知:25℃时,难溶电解质的溶度积常数如表所示:
| 难溶电解质 | Cu(OH)2 | Mn(OH)2 | Al(OH)3 |
| Ksp | 2.2×10-20 | 4×10-14 | 1.9×10-33 |
(2)酸溶时加入H2O2的目的是
(3)常温下,若“调pH”为7,Cu2+是否能沉淀完全:
(4)“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为
(5)结晶所得的NH4VO3需进行水洗、干燥。证明NH4VO3已洗涤干净的实验操作及现象
(6)为测定该产品的纯度,兴趣小组同学准确称取V2O5产品2.000g,加入过量稀硫酸使其完全反应,生成(VO2)2SO4,并配成100mL溶液。取10.00mL溶液用0.1000mol•L-1的H2C2O4标准溶液滴定,滴定到终点时消耗标准液10.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO
 黄色(被还原为VO2+蓝色),该反应的离子方程式:
黄色(被还原为VO2+蓝色),该反应的离子方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】含钠化合物在工业生产和日常生活中应用广泛,请回答下列有关问题:
(1)钠元素的碱性氧化物的化学式为___________ ,钠另一种氧化物是一种淡黄色固体,写出其用于呼吸面具供氧剂的一个化学方程式:___________ 。
(2)NaOH是一种强碱,若实验室用NaOH浓溶液配制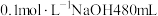 ,需量取密度为
,需量取密度为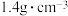 质量分数为40%的NaOH溶液
质量分数为40%的NaOH溶液___________ mL,该实验所需的玻璃仪器除玻璃棒、量筒、烧杯之外,还有___________ ,若量取浓NaOH溶液时俯视,则最终配制溶液浓度___________ (填“偏大”、“偏小”或“无影响”)。当450mL所配溶液与标准状况下672mLCO2恰好反应时,发生反应的离子方程式为___________ 。
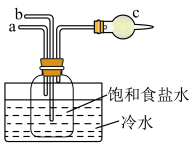
(3)如图是实验室模拟“侯氏制碱法”制取NaHCO3的部分装置。下列说正确的是___________(填序号)
(4)粗盐常含有少量 以及泥沙等杂质,实验室中可用如下流程提纯NaCl,下列说法中正确的是___________(填序号)
以及泥沙等杂质,实验室中可用如下流程提纯NaCl,下列说法中正确的是___________(填序号)
(1)钠元素的碱性氧化物的化学式为
(2)NaOH是一种强碱,若实验室用NaOH浓溶液配制
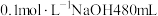 ,需量取密度为
,需量取密度为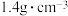 质量分数为40%的NaOH溶液
质量分数为40%的NaOH溶液(3)如图是实验室模拟“侯氏制碱法”制取NaHCO3的部分装置。下列说正确的是___________(填序号)

| A.a先通入CO2,然后b通入NH3,c中放碱石灰 |
| B.b先通入NH3,然后a通入CO2,c中放碱石灰 |
| C.a先通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉 |
| D.b先通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉 |
(4)粗盐常含有少量
 以及泥沙等杂质,实验室中可用如下流程提纯NaCl,下列说法中正确的是___________(填序号)
以及泥沙等杂质,实验室中可用如下流程提纯NaCl,下列说法中正确的是___________(填序号)
| A.溶液a和NaOH可用一种试剂来代替 |
| B.溶液a和溶液b的添加顺序可以互换 |
| C.操作Ⅱ为蒸发结晶,蒸发过程中当蒸发皿中有大量晶体析出时停止加热 |
| D.粗盐提纯的整个操作过程中共有两处需要使用玻璃棒 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。回答下列问题。
(1)如何除掉粗盐中的可溶性杂质CaCl2、MgCl2、硫酸盐呢?请按要求填空:
(2)除杂时,为了将杂质尽可能除尽,加入的除杂试剂一般要过量,且应在后续步骤中除去。则在(1)中,加入试剂②的主要目的是___________ ;(1)中所加入的3种试剂的先后顺序为___________ →___________ →___________ (选填序号);经上述3种试剂除杂后的溶液中,还应加入适量的___________ (填试剂名称),再经过蒸发后可得到纯净的NaCl。
(3)实验室进行NaCl溶液蒸发时,一般有以下操作过程:①加热搅拌;②固定铁圈位置;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④放置酒精灯;⑤停止加热。其正确的操作顺序为___________ 。
(1)如何除掉粗盐中的可溶性杂质CaCl2、MgCl2、硫酸盐呢?请按要求填空:
| 杂质 | 加入试剂 (填化学式) | 化学反应方程式 |
| 硫酸盐 | ① | 反应① |
| CaCl2 | ② | 反应② |
| MgCl2 | ③NaOH | 反应③MgCl2+2NaOH=Mg(OH)2↓+2NaCl |
(3)实验室进行NaCl溶液蒸发时,一般有以下操作过程:①加热搅拌;②固定铁圈位置;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④放置酒精灯;⑤停止加热。其正确的操作顺序为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】海水是大自然赐给人类的宝藏,海水的综合利用是全世界研究的重点。回答下列问题:
(1)粗盐中除了含有泥沙之外,还含有Ca2+、Mg2+、SO 等杂质,由粗盐获得精盐的一般流程如图所示:
等杂质,由粗盐获得精盐的一般流程如图所示:
粗盐 滤液
滤液 滤液
滤液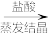 精盐
精盐
流程中加入氯化钡、纯碱和烧碱的目的依次是___ 、___ 、___ 。
(2)从海水中提取金属镁的流程如图:
浓缩的海水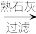 沉淀
沉淀 MgCl2→Mg
MgCl2→Mg
流程中加入熟石灰的目的是___ ,写出沉淀与盐酸反应的离子方程式:___ 。
(3)某学生在实验室模拟河水提取溴的步骤如下:海水→浓缩→氧化→提取→溴
①氧化步骤中适合作氧化剂的是___ (填字母)。
A.Br2 B.Cl2 C.I2 D.HCl
②提取步骤:……溴水中加入CCl4振荡、静置……得溴的四氯化碳溶液。该分离提纯溴的方法叫___ ;用到的主要玻璃仪器为___ 。
(1)粗盐中除了含有泥沙之外,还含有Ca2+、Mg2+、SO
 等杂质,由粗盐获得精盐的一般流程如图所示:
等杂质,由粗盐获得精盐的一般流程如图所示:粗盐
 滤液
滤液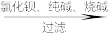 滤液
滤液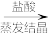 精盐
精盐流程中加入氯化钡、纯碱和烧碱的目的依次是
(2)从海水中提取金属镁的流程如图:
浓缩的海水
 沉淀
沉淀 MgCl2→Mg
MgCl2→Mg流程中加入熟石灰的目的是
(3)某学生在实验室模拟河水提取溴的步骤如下:海水→浓缩→氧化→提取→溴
①氧化步骤中适合作氧化剂的是
A.Br2 B.Cl2 C.I2 D.HCl
②提取步骤:……溴水中加入CCl4振荡、静置……得溴的四氯化碳溶液。该分离提纯溴的方法叫
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
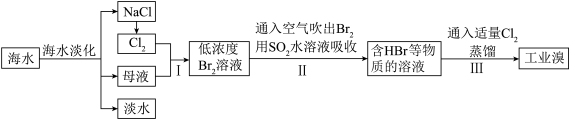
【推荐1】海洋是一座资源的宝库,化学工业中的许多基础原料都来自海洋,以下是利用海洋资源生产卤素单质 Cl2、Br2、I2的工艺流程。回答下列问题:

注:i.同温同浓度下的氧化性:Cl2 > IO > I2
> I2
ii.25℃时,I2在水中与CCl4中的溶解度如下表:
(1)物质A在常温常压下为气体,其化学式为_______ 。
(2)步骤Ⅰ不需要用到下列仪器中的_______ (填标号),步骤Ⅱ的操作名称为_______ 。
a.酒精灯 b.玻璃棒 c.坩埚 d.泥三角
(3)步骤Ⅲ中氧化I-为I2时,需要严格控制Cl2的用量,目的是_______ 。
(4)在步骤Ⅳ能利用CCl4从水溶液中提取I2的原因是_______ 。
(5)通过步骤Ⅴ已获得Br2,步骤Ⅵ中又利用SO2将Br2还原为Br-的目的是_______ ,有关反应的化学方程式为_______ 。

注:i.同温同浓度下的氧化性:Cl2 > IO
 > I2
> I2ii.25℃时,I2在水中与CCl4中的溶解度如下表:
| 溶剂 | 溶解度 |
| H2O | 0.034g/100g |
| CCl4 | 2.9g/100g |
(2)步骤Ⅰ不需要用到下列仪器中的
a.酒精灯 b.玻璃棒 c.坩埚 d.泥三角
(3)步骤Ⅲ中氧化I-为I2时,需要严格控制Cl2的用量,目的是
(4)在步骤Ⅳ能利用CCl4从水溶液中提取I2的原因是
(5)通过步骤Ⅴ已获得Br2,步骤Ⅵ中又利用SO2将Br2还原为Br-的目的是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】海洋资源的利用具有非常广阔的前景。回答下列问题:
Ⅰ.海水制盐
(1)粗盐中可溶性杂质离子包含 、
、 、
、 。要除去这些杂质离子得到精盐水,加入试剂的顺序可为
。要除去这些杂质离子得到精盐水,加入试剂的顺序可为___________ (填字母)。
a.NaOH溶液、 溶液、
溶液、 溶液、盐酸
溶液、盐酸
b.NaOH溶液、 溶液、
溶液、 溶液、盐酸
溶液、盐酸
c. 溶液、
溶液、 溶液、NaOH溶液、盐酸
溶液、NaOH溶液、盐酸
(2)精盐水用于氯碱工业,请写出氯碱工业总反应的离子方程式___________ 。
Ⅱ.海水提溴
(3)含 的海水经“空气吹出、
的海水经“空气吹出、 吸收、通入氯气”后再蒸馏的目的是
吸收、通入氯气”后再蒸馏的目的是___________ 。
(4)工业上常用“吹出法”提溴,请写出用 吸收
吸收 的化学反应方程式
的化学反应方程式___________ 。
Ⅲ.从海带中提取碘的实验过程如下图所示:
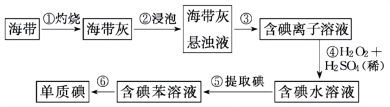
(5)步骤①中燃烧海带时,应将海带放入___________ (填仪器名称)中燃烧。
(6)请写出步骤④反应的离子方程式___________ 。
Ⅱ.实验:探究硫酸浓度对化学反应速度的影响
常温下,酸性KI溶液在空气中会被氧化为碘单质,现取三支试管,先向其中各加入1mL相同浓度的KI溶液(含指示剂),再分别加入 的硫酸和一定量蒸馏水,其显色时间如下表所示:
的硫酸和一定量蒸馏水,其显色时间如下表所示:
(7)
___________ mL。通过实验ⅰ、ⅱ,本小组得出的实验结论为___________ 。
Ⅰ.海水制盐
(1)粗盐中可溶性杂质离子包含
 、
、 、
、 。要除去这些杂质离子得到精盐水,加入试剂的顺序可为
。要除去这些杂质离子得到精盐水,加入试剂的顺序可为a.NaOH溶液、
 溶液、
溶液、 溶液、盐酸
溶液、盐酸b.NaOH溶液、
 溶液、
溶液、 溶液、盐酸
溶液、盐酸c.
 溶液、
溶液、 溶液、NaOH溶液、盐酸
溶液、NaOH溶液、盐酸(2)精盐水用于氯碱工业,请写出氯碱工业总反应的离子方程式
Ⅱ.海水提溴
(3)含
 的海水经“空气吹出、
的海水经“空气吹出、 吸收、通入氯气”后再蒸馏的目的是
吸收、通入氯气”后再蒸馏的目的是(4)工业上常用“吹出法”提溴,请写出用
 吸收
吸收 的化学反应方程式
的化学反应方程式Ⅲ.从海带中提取碘的实验过程如下图所示:

(5)步骤①中燃烧海带时,应将海带放入
(6)请写出步骤④反应的离子方程式
Ⅱ.实验:探究硫酸浓度对化学反应速度的影响
常温下,酸性KI溶液在空气中会被氧化为碘单质,现取三支试管,先向其中各加入1mL相同浓度的KI溶液(含指示剂),再分别加入
 的硫酸和一定量蒸馏水,其显色时间如下表所示:
的硫酸和一定量蒸馏水,其显色时间如下表所示:| 组别 | 硫酸/mL | 蒸馏水/mL | 显色时间/s |
| i | 3 | 0 | 120 |
| ii | 2 |  | 140 |
| iii | 1 |  | 200 |

您最近一年使用:0次