自然界中的物质绝大多数以混合物的形式存在,为了便于研究和利用,常需对混合物进行分离和提纯。下列A、B、C、D是中学常见的混合物分离或提纯的装置。

请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D序号填入适当的空格中。
(1)碳酸钙悬浊液中分离出碳酸钙___ ;
(2)分离酒精和水___ ;
(3)分离植物油和水___ ;
(4)氯化钠溶液中分离出氯化钠___ ;
(5)氯化钠溶液中分离出水___ 。

请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D序号填入适当的空格中。
(1)碳酸钙悬浊液中分离出碳酸钙
(2)分离酒精和水
(3)分离植物油和水
(4)氯化钠溶液中分离出氯化钠
(5)氯化钠溶液中分离出水
更新时间:2021-09-24 13:21:48
|
【知识点】 物质的分离、提纯
相似题推荐
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐1】苯甲酸乙酯(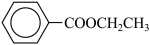 )是重要的精细化工试剂,常用于配制水果型食用香精。某化学兴趣小如通过酯化反应,以苯甲酸和乙醇为原料合成苯甲酸乙酯。
)是重要的精细化工试剂,常用于配制水果型食用香精。某化学兴趣小如通过酯化反应,以苯甲酸和乙醇为原料合成苯甲酸乙酯。
I.试剂相关性质如表:
II.实验装置如图(部分夹持装置以及加热装置已省去)
①加料:于100mL三颈烧瓶中加入:9.8g苯甲酸、 (约0.25mol)95%的乙醇和2mL浓硫酸,摇匀,加沸石。
(约0.25mol)95%的乙醇和2mL浓硫酸,摇匀,加沸石。
②加热:小心缓慢加热回流约2h后,改为蒸馏装置。
③除杂:将瓶中残液倒入盛有20mL冷水的烧杯中,在搅拌下分批加进Na2CO3粉末,用pH试纸检验呈中性。
④分离萃取、干燥:分液,水层用10mL乙醚萃取。合并有机层,用无水氯化钙干燥。
⑤精馏:回收乙醚,加热蒸馏,收集211~213℃馏分,称量产物的质量为9.5g。
回答下列问题:
(1)为提高原料苯甲酸晶体的纯度,可采用的纯化方法为____ 。
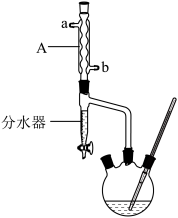
(2)步骤①的装置如图所示(加热和夹持装置已略去),仪器A的名称为____ ;冷却水从____ (填“a”或“b”)口进入。
(3)写出该法制备苯甲酸乙酯的化学方程式:____ 。
(4)该反应装置中使用到了分水器,通过分水器不断分离除去反应生成的水,这样做的目的是____ 。
(5)步骤③中,加入Na2CO3粉末,除了可以除去苯甲酸、乙醇和硫酸外,还有的作用是:____ 。
(6)实验得到的苯甲酸乙酯的质量低于理论产量,可能的原因是____ (填序号)。
a.开始加热时,加热温度过高,导致原料乙醇挥发
b.苯甲酸实际用量多了
c.步骤③中除杂过程中苯甲酸乙酯有溶解损失
(7)通过计算,本实验的产率是____ (保留三位有效数字)。
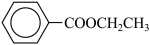 )是重要的精细化工试剂,常用于配制水果型食用香精。某化学兴趣小如通过酯化反应,以苯甲酸和乙醇为原料合成苯甲酸乙酯。
)是重要的精细化工试剂,常用于配制水果型食用香精。某化学兴趣小如通过酯化反应,以苯甲酸和乙醇为原料合成苯甲酸乙酯。I.试剂相关性质如表:
| 苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
| 常温性状 | 白色叶状晶体 | 无色液体 | 无色透明液体 |
| 沸点/℃ | 249.0 | 78.0 | 212.6 |
| 相对分子量 | 122 | 46 | 150 |
| 溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
①加料:于100mL三颈烧瓶中加入:9.8g苯甲酸、
 (约0.25mol)95%的乙醇和2mL浓硫酸,摇匀,加沸石。
(约0.25mol)95%的乙醇和2mL浓硫酸,摇匀,加沸石。②加热:小心缓慢加热回流约2h后,改为蒸馏装置。
③除杂:将瓶中残液倒入盛有20mL冷水的烧杯中,在搅拌下分批加进Na2CO3粉末,用pH试纸检验呈中性。
④分离萃取、干燥:分液,水层用10mL乙醚萃取。合并有机层,用无水氯化钙干燥。
⑤精馏:回收乙醚,加热蒸馏,收集211~213℃馏分,称量产物的质量为9.5g。
回答下列问题:
(1)为提高原料苯甲酸晶体的纯度,可采用的纯化方法为
(2)步骤①的装置如图所示(加热和夹持装置已略去),仪器A的名称为
(3)写出该法制备苯甲酸乙酯的化学方程式:
(4)该反应装置中使用到了分水器,通过分水器不断分离除去反应生成的水,这样做的目的是
(5)步骤③中,加入Na2CO3粉末,除了可以除去苯甲酸、乙醇和硫酸外,还有的作用是:
(6)实验得到的苯甲酸乙酯的质量低于理论产量,可能的原因是
a.开始加热时,加热温度过高,导致原料乙醇挥发
b.苯甲酸实际用量多了
c.步骤③中除杂过程中苯甲酸乙酯有溶解损失
(7)通过计算,本实验的产率是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐2】常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料,某探究小组利用下列反应和装置制备一硝基甲苯。
实验步骤:
①按体积比1:3配制浓硫酸与浓硝酸混合物40mL;
②在三颈瓶中加入15mL(13g)甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯的总质量13.60g。
请回答下列问题:
(1)反应中的加热方式是______________ 。
(2)使用仪器A前必须进行的操作是________________ ,仪器B的作用是_____________ 。
(3)若实验后在三颈瓶中收集到的产物较少,可能的原因是______________________ 。
(4)分离反应后产物的方案如下:______________ 。
(5)一硝基甲苯的产率为___________ (保留两位有效数字)。产率=(实际产量/理论产量)×100%


密度/ | 沸点/℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
①按体积比1:3配制浓硫酸与浓硝酸混合物40mL;
②在三颈瓶中加入15mL(13g)甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯的总质量13.60g。
请回答下列问题:
(1)反应中的加热方式是
(2)使用仪器A前必须进行的操作是
(3)若实验后在三颈瓶中收集到的产物较少,可能的原因是
(4)分离反应后产物的方案如下:

(5)一硝基甲苯的产率为
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐3】根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2FeO4)。
据此回答问题:

据此回答问题
(1)试剂a为_____________ 试剂b为______________ 填写所选试剂代号)
(2)加入过量试剂c,发生反应的离子方程式为_________________________ ;溶液Z中金属离子可能有Cu2+、Fe2+、Fe3+,检验Fe3+的试剂为______________ (填化学式);欲测定溶液Z中Fe2+的浓度,需要用(填仪器名称)___________________ 配制一定浓度的KMnO4标准溶液。在滴定时KMnO4标准溶液应加入到______ (填“酸式”或“碱式”)滴定管中。
(3)K2FeO4是强氧化剂,与水发生反应:4FeO +10H2O= 4Fe(OH)3(胶体)+3O2↑+8OH-,产生11.2L(标况)O2时,转移电子的物质的量为
+10H2O= 4Fe(OH)3(胶体)+3O2↑+8OH-,产生11.2L(标况)O2时,转移电子的物质的量为____ 。K2Fe04与FeCl3相比,净水效果更好的是______ ,理由是______________________________________ 。
(4)高铁电池是一种新型可充电电池,总反应为:3Zn +2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是:
3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是:________ 。
据此回答问题:

据此回答问题
(1)试剂a为
| A.浓硫酸 | B.硫酸铁溶液 | C.氯水 | D.H2O2和稀硫酸 E. Fe |
(2)加入过量试剂c,发生反应的离子方程式为
(3)K2FeO4是强氧化剂,与水发生反应:4FeO
 +10H2O= 4Fe(OH)3(胶体)+3O2↑+8OH-,产生11.2L(标况)O2时,转移电子的物质的量为
+10H2O= 4Fe(OH)3(胶体)+3O2↑+8OH-,产生11.2L(标况)O2时,转移电子的物质的量为(4)高铁电池是一种新型可充电电池,总反应为:3Zn +2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是:
3Zn(OH)2+2Fe(OH)3+4KOH,电池工作时在正极放电的物质是:
您最近一年使用:0次




