可以判定某酸(HA)是强电解质的事实是( )
| A.该酸加热至沸腾不分解 |
| B.0.01 mol·L-1该酸的pH=2 |
| C.该酸可以溶解Cu(OH) 2 |
| D.该酸与CaCO3反应放出CO2 |
11-12高二下·安徽六安·课时练习 查看更多[2]
更新时间:2016-12-09 03:55:44
|
【知识点】 弱电解质的电离
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】25℃时,向20. 00 mL 0.1 mol/L H2X溶液中滴入0.1 mol/L NaOH溶液,溶液中由水电离出的c水(OH-)的负对数[一lgc水(OH-)]即pOH水-与所加NaOH溶液体积的关系如图所示。下列说法中正确的是
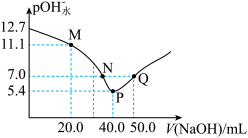

| A.水的电离程度:M>P | B.图中P点至Q点对应溶液中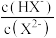 逐渐增大 逐渐增大 |
| C.N点和Q点溶液的pH相同 | D.P点溶液中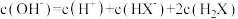 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列图像正确的是()
A.向Ca(OH)2和NaOH混合溶液中通入CO2 |
B.用NaOH溶液滴定等浓度的盐酸和醋酸溶液 |
C.向NaOH溶液中通入CO2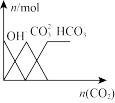 |
D.HCl与Cl2的混合气体通入NaOH溶液中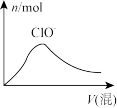 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】已知25℃时,下列酸的电离常数:醋酸(CH3COOH):1.75╳10-5、氢氰酸(HCN):4.93╳10-10、氢氟酸(HF):7.2╳10-4、甲酸(HCOOH):1.77╳10-4。下列说法不正确的是
| A.物质的量浓度均为0.1mol·L-1的上述溶液酸性最强的是:氢氟酸 |
| B.物质的量浓度均为0.1mol·L-1的CH3COONa和NaF溶液中,CH3COOH的浓度大于HF的浓度,NaF溶液的pH比CH3COONa溶液大。 |
| C.0.1mol·L-1的HCN和NaCN溶液等体积混合的溶液显碱性,则溶液中的c(CN-)<c(Na+) |
| D.0.1mol·L-1的HCOOH和HCOONa溶液等体积混合的溶液显酸性,则溶液中的c(OH-)<c(H+) |
您最近一年使用:0次



