回答下列问题:
(1)已知充分燃烧a g乙炔(C2H2)气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,表示乙炔燃烧热的热化学方程式为______ 。
(2)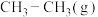 →
→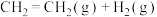
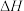 ,有关化学键的键能如下表:
,有关化学键的键能如下表:
则该反应的反应热
_____ 。
(3)碳(s)在氧气供应不充足时,生成CO同时还部分生成 。因此无法通过实验直接测得反应:
。因此无法通过实验直接测得反应: 的
的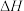 。但可设计实验利用盖斯定律计算出该反应的
。但可设计实验利用盖斯定律计算出该反应的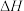 ,计算时需要测得的实验数据有
,计算时需要测得的实验数据有______ 。
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为
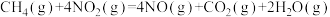
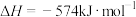
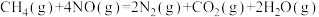
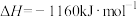
则甲烷直接将NO2还原为N2的热化学方程式为_____ 。
(5)CO、H2可用于合成甲醇和甲醚其反应为(m、n均大于0):
反应①:
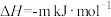
反应②:
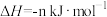
反应③: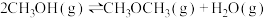
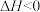
则m与n的关系为______ 。
(1)已知充分燃烧a g乙炔(C2H2)气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,表示乙炔燃烧热的热化学方程式为
(2)
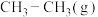 →
→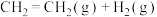
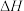 ,有关化学键的键能如下表:
,有关化学键的键能如下表:| 化学键 |  |  |  |  |
键能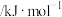 | 414 | 615 | 347 | 435 |
则该反应的反应热

(3)碳(s)在氧气供应不充足时,生成CO同时还部分生成
 。因此无法通过实验直接测得反应:
。因此无法通过实验直接测得反应: 的
的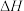 。但可设计实验利用盖斯定律计算出该反应的
。但可设计实验利用盖斯定律计算出该反应的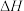 ,计算时需要测得的实验数据有
,计算时需要测得的实验数据有(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为
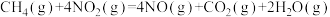
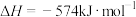
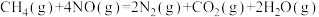
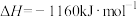
则甲烷直接将NO2还原为N2的热化学方程式为
(5)CO、H2可用于合成甲醇和甲醚其反应为(m、n均大于0):
反应①:

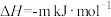
反应②:

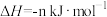
反应③:
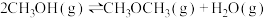
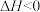
则m与n的关系为
更新时间:2021-11-08 21:09:19
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】(1)依据事实,写出下列反应的热化学方程式。
①在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为:___________________________________________ 。
②若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ热量__________________ 。
③已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为:________________________________ 。
(2)氢气是一种清洁能源。用甲烷制取氢气的两步反应的能量变化如下图所示:
①甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是____________ 。
②第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为____ ,CO的平衡转化率为_____ 。
①在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为:
②若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ热量
③已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为:
(2)氢气是一种清洁能源。用甲烷制取氢气的两步反应的能量变化如下图所示:

①甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是
②第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(1)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g) 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g) H2O(l) ΔH2=-44 kJ·mol-1;
H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g) 2H2SO4(l) ΔH3=-545 kJ·mol-1。
2H2SO4(l) ΔH3=-545 kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式为__________________ 。
(2)已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g) 2C3H5(ONO2)3(l) ΔH1;
2C3H5(ONO2)3(l) ΔH1;
2H2(g)+O2(g) 2H2O(g) ΔH2;
2H2O(g) ΔH2;
C(s)+O2(g) CO2(g) ΔH3。
CO2(g) ΔH3。
则反应4C3H5(ONO2)3(l) 12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为
12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为____ 。
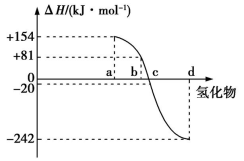
(3)已知:在热力学标准状态(298 K、1.01×105 Pa)下,由稳定的单质发生反应生成1 mol化合物的反应热叫该化合物的生成热(ΔH),下图为氧族元素氢化物a、b、c、d的生成热数据示意图。①请你归纳氧族元素氢化物的稳定性与氢化物的生成热(ΔH)之间的关系:_________________ 。②写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式:______________ 。
2SO2(g)+O2(g)
 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;H2O(g)
 H2O(l) ΔH2=-44 kJ·mol-1;
H2O(l) ΔH2=-44 kJ·mol-1;2SO2(g)+O2(g)+2H2O(g)
 2H2SO4(l) ΔH3=-545 kJ·mol-1。
2H2SO4(l) ΔH3=-545 kJ·mol-1。则SO3(g)与H2O(l)反应的热化学方程式为
(2)已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)
 2C3H5(ONO2)3(l) ΔH1;
2C3H5(ONO2)3(l) ΔH1;2H2(g)+O2(g)
 2H2O(g) ΔH2;
2H2O(g) ΔH2;C(s)+O2(g)
 CO2(g) ΔH3。
CO2(g) ΔH3。则反应4C3H5(ONO2)3(l)
 12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为
12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为(3)已知:在热力学标准状态(298 K、1.01×105 Pa)下,由稳定的单质发生反应生成1 mol化合物的反应热叫该化合物的生成热(ΔH),下图为氧族元素氢化物a、b、c、d的生成热数据示意图。①请你归纳氧族元素氢化物的稳定性与氢化物的生成热(ΔH)之间的关系:

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】铜冶金技术以火法冶炼为主。
(1)火法炼铜的工艺流程如下:
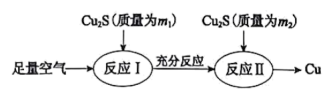
反应I:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ·mol-1
反应Ⅱ:2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0 kJ·mol-1
①在反应Ⅱ中,每生成1molSO2转移电子___________ mol。
②反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=___________ kJ·mol-1 。
③理论上m1:m2=___________ 。
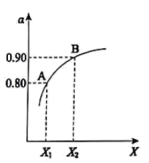
(2)炼铜的副产品SO2多用于制硫酸和石膏等化学产品。制硫酸中重要的一步反应是:2SO2(g)+O2(g) 2SO3(g) △H=-196kJ·mol-1。如图表示将2.0molSO2和1.0molO2置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度。X代表的物理量是
2SO3(g) △H=-196kJ·mol-1。如图表示将2.0molSO2和1.0molO2置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度。X代表的物理量是___________ 。A对应条件下平衡常数K=___________ 。
(3)工业硫酸中往往含有一定量SO2,测定过程如下:取mg工业硫酸配成100mL溶液,取出20.00mL溶液,加入1mL指示剂,用cmol·L-1I2标准溶液滴定,消耗的I2标准溶液VmL,工业硫酸中含有SO2的质量分数的计算式是___________ 。
(1)火法炼铜的工艺流程如下:

反应I:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ·mol-1
反应Ⅱ:2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0 kJ·mol-1
①在反应Ⅱ中,每生成1molSO2转移电子
②反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=
③理论上m1:m2=
(2)炼铜的副产品SO2多用于制硫酸和石膏等化学产品。制硫酸中重要的一步反应是:2SO2(g)+O2(g)
 2SO3(g) △H=-196kJ·mol-1。如图表示将2.0molSO2和1.0molO2置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度。X代表的物理量是
2SO3(g) △H=-196kJ·mol-1。如图表示将2.0molSO2和1.0molO2置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度。X代表的物理量是
(3)工业硫酸中往往含有一定量SO2,测定过程如下:取mg工业硫酸配成100mL溶液,取出20.00mL溶液,加入1mL指示剂,用cmol·L-1I2标准溶液滴定,消耗的I2标准溶液VmL,工业硫酸中含有SO2的质量分数的计算式是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】I.分别取40mL的0.50mol·L-1盐酸与40mL的0.55mol·L-1NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
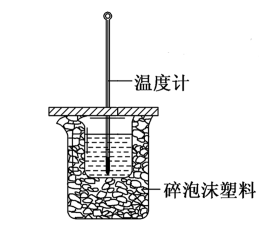
(1)反应过程中,NaOH稍过量的原因是___________ 。
(2)图中装置缺少的仪器是___________ 。
(3)假设盐酸和NaOH溶液的密度都是1g·cm-3,又知中和后生成溶液的比热容c=4.18J·g-1·℃-1,为了计算中和热,实验时还需测量的数据有(填字母)___________ 。
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前NaOH溶液的温度
D.反应前NaOH溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
Ⅱ.已知:①4g氢气在氧气中完全燃烧生成液态水时放出572 kJ的热量。
①CH4的燃烧热为ΔH=-890 kJ·mol-1。
请回答下列问题:
(4)写出H2燃烧热的热化学方程式___________ 。
(5)11.2 L H2和CH4的混合气体(标准状况下)完全燃烧生成CO2和液态水时放出369.5 kJ的热量,则混合气体中H2和CH4的物质的量之比是___________ 。

(1)反应过程中,NaOH稍过量的原因是
(2)图中装置缺少的仪器是
(3)假设盐酸和NaOH溶液的密度都是1g·cm-3,又知中和后生成溶液的比热容c=4.18J·g-1·℃-1,为了计算中和热,实验时还需测量的数据有(填字母)
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前NaOH溶液的温度
D.反应前NaOH溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
Ⅱ.已知:①4g氢气在氧气中完全燃烧生成液态水时放出572 kJ的热量。
①CH4的燃烧热为ΔH=-890 kJ·mol-1。
请回答下列问题:
(4)写出H2燃烧热的热化学方程式
(5)11.2 L H2和CH4的混合气体(标准状况下)完全燃烧生成CO2和液态水时放出369.5 kJ的热量,则混合气体中H2和CH4的物质的量之比是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】Ⅰ.实验室测定中和热的步骤如下(如图)

第一步:量取40.0mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
第二步:量取40.0mL 0.55mol/L NaOH溶液,测量温度;
第三步:将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)图中仪器A的名称是_______ 。
(2)NaOH溶液稍过量的原因_______ 。
(3)加入NaOH溶液的正确操作是_______(填字母)。
(4)若实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量_______ (填“相等”“不相等”),若实验操作均正确,则所求中和热_______ (填“相等”“不相等”)。
Ⅱ.
(5)已知拆开1 mol H-H、1 mol N-H、1 mol N≡N分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_______ 。
(6)用NA表示阿伏加德罗常数的值,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。则C2H2燃烧热的热化学方程式为_______ 。
(7)已知两个氢气燃烧生成水的热化学方程式:
H2(g)+ O2(g)=H2O(g) ΔH=a kJ·mol-1
O2(g)=H2O(g) ΔH=a kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH=b kJ·mol-1
请回答下列问题(|b|表示b的绝对值):
①若2 mol H2(g)完全燃烧生成水蒸气,则放出的热量_______ (填“>”“<”或“=”)|b| kJ。
②反应热的关系:2a_______ (填“>”“<”或“=”)b。
③若已知H2(g)+ O2(g)=H2O(g) ΔH=-242 kJ·mol-1,且氧气中1 mol O=O完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O形成时放出热量463 kJ,则氢气中1 mol H-H断裂时吸收的热量为
O2(g)=H2O(g) ΔH=-242 kJ·mol-1,且氧气中1 mol O=O完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O形成时放出热量463 kJ,则氢气中1 mol H-H断裂时吸收的热量为_______ 。
(8)肼(N2H4)是一种用于火箭或燃料电池的原料,已知:
①2H2O(g)+O2(g)=2H2O2(l) ΔH1= +108.0 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2= -534.0 kJ·mol-1
则③N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH3=_______ kJ·mol-1。

第一步:量取40.0mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
第二步:量取40.0mL 0.55mol/L NaOH溶液,测量温度;
第三步:将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)图中仪器A的名称是
(2)NaOH溶液稍过量的原因
(3)加入NaOH溶液的正确操作是_______(填字母)。
| A.沿玻璃棒缓慢加入 | B.分三次均匀加入 | C.一次迅速加入 | D.用滴定管小心滴加 |
Ⅱ.
(5)已知拆开1 mol H-H、1 mol N-H、1 mol N≡N分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为
(6)用NA表示阿伏加德罗常数的值,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。则C2H2燃烧热的热化学方程式为
(7)已知两个氢气燃烧生成水的热化学方程式:
H2(g)+
 O2(g)=H2O(g) ΔH=a kJ·mol-1
O2(g)=H2O(g) ΔH=a kJ·mol-12H2(g)+O2(g)=2H2O(l) ΔH=b kJ·mol-1
请回答下列问题(|b|表示b的绝对值):
①若2 mol H2(g)完全燃烧生成水蒸气,则放出的热量
②反应热的关系:2a
③若已知H2(g)+
 O2(g)=H2O(g) ΔH=-242 kJ·mol-1,且氧气中1 mol O=O完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O形成时放出热量463 kJ,则氢气中1 mol H-H断裂时吸收的热量为
O2(g)=H2O(g) ΔH=-242 kJ·mol-1,且氧气中1 mol O=O完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O形成时放出热量463 kJ,则氢气中1 mol H-H断裂时吸收的热量为(8)肼(N2H4)是一种用于火箭或燃料电池的原料,已知:
①2H2O(g)+O2(g)=2H2O2(l) ΔH1= +108.0 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2= -534.0 kJ·mol-1
则③N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH3=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】回答下列问题:
(1)在25℃、101 kPa下,1 g液态甲醇(CH3OH)燃烧生成CO2和液态水时放热22.7 kJ,则该反应的热化学方程式应为_______ 。
(2)由氢气和氧气反应生成1 mol液态水时放热285.8 kJ,写出该反应的热化学方程式_______ ;若1g水蒸气转化成液态水放热2.4 kJ,则反应2H2(g) + O2(g) = 2H2O(g)的△H=_______ 。
(3)已知:① Cs+O2g=CO2g; H=-393.5 kJ·mol1
② 2COg+O2g=2CO2g; H=-566 kJ·mol1
③ TiO2s+2Cl2g=TiCl4s+O2g; H=+141 kJ·mol1
则TiO2s+2Cl2g+2Cs=TiCl4s+2COg的H=_______ 。
(4)把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g)=CO2(g);ΔH1<0 ①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g)=CO(g)+H2(g);ΔH2>0 ②
再燃烧水煤气:
2CO(g)+O2(g)=2CO2(g);ΔH3<0 ③
2H2(g)+O2(g)=2H2O(g); ΔH4<0 ④
请回答下列问题:
①途径Ⅰ放出的热量理论上_______ (填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
②ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是_______ 。
(1)在25℃、101 kPa下,1 g液态甲醇(CH3OH)燃烧生成CO2和液态水时放热22.7 kJ,则该反应的热化学方程式应为
(2)由氢气和氧气反应生成1 mol液态水时放热285.8 kJ,写出该反应的热化学方程式
(3)已知:① Cs+O2g=CO2g; H=-393.5 kJ·mol1
② 2COg+O2g=2CO2g; H=-566 kJ·mol1
③ TiO2s+2Cl2g=TiCl4s+O2g; H=+141 kJ·mol1
则TiO2s+2Cl2g+2Cs=TiCl4s+2COg的H=
(4)把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g)=CO2(g);ΔH1<0 ①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g)=CO(g)+H2(g);ΔH2>0 ②
再燃烧水煤气:
2CO(g)+O2(g)=2CO2(g);ΔH3<0 ③
2H2(g)+O2(g)=2H2O(g); ΔH4<0 ④
请回答下列问题:
①途径Ⅰ放出的热量理论上
②ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】甲醇 作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
Ⅰ.甲醇可以替代汽油和柴油作为内燃机燃料
(1)汽油的主要成分之一是辛烷 。已知:25℃、101kPa时,0.2mol辛烷完全燃烧生成气态二氧化碳和液态水,放出1103.6kJ热量。该反应的热化学方程式为
。已知:25℃、101kPa时,0.2mol辛烷完全燃烧生成气态二氧化碳和液态水,放出1103.6kJ热量。该反应的热化学方程式为___________ 。
25℃、101kPa,
 ,相同质量的甲醇和辛烷分别燃烧释放热量多的是
,相同质量的甲醇和辛烷分别燃烧释放热量多的是___________ (填“甲醇”或“辛烷”)。
(2) 的结构式为
的结构式为

 ,该反应相关化学键键能数据如下表
,该反应相关化学键键能数据如下表
则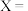
___________ 。
Ⅱ.甲醇的合成
(3)以 和
和 为原料合成甲醇,反应的能量变化如图。
为原料合成甲醇,反应的能量变化如图。___________ 。
②该反应需要加入铜锌基催化剂。
加入催化剂后,该反应的
___________ (填“变大”“变小”或“不变”)。
③已知:CO的燃烧热为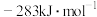


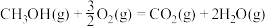
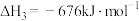
以 和
和 为原料合成甲醇的热化学方程式为
为原料合成甲醇的热化学方程式为___________ 。
 作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。Ⅰ.甲醇可以替代汽油和柴油作为内燃机燃料
(1)汽油的主要成分之一是辛烷
 。已知:25℃、101kPa时,0.2mol辛烷完全燃烧生成气态二氧化碳和液态水,放出1103.6kJ热量。该反应的热化学方程式为
。已知:25℃、101kPa时,0.2mol辛烷完全燃烧生成气态二氧化碳和液态水,放出1103.6kJ热量。该反应的热化学方程式为25℃、101kPa,

 ,相同质量的甲醇和辛烷分别燃烧释放热量多的是
,相同质量的甲醇和辛烷分别燃烧释放热量多的是(2)
 的结构式为
的结构式为

 ,该反应相关化学键键能数据如下表
,该反应相关化学键键能数据如下表| 化学键 | O=O | C—O | C≡O | H—O | C—H |
 | 496 | 343 | 1076 | X | 413 |
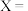
Ⅱ.甲醇的合成
(3)以
 和
和 为原料合成甲醇,反应的能量变化如图。
为原料合成甲醇,反应的能量变化如图。
②该反应需要加入铜锌基催化剂。
加入催化剂后,该反应的

③已知:CO的燃烧热为
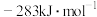


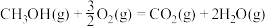
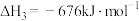
以
 和
和 为原料合成甲醇的热化学方程式为
为原料合成甲醇的热化学方程式为
您最近一年使用:0次
【推荐2】宇宙中所有的一切都是能量的变化,研究化学反应中的能量变化意义重大。
(1)奥运会火炬常用的燃料为丙烷、丁烷等。已知:丙烷的燃烧热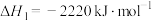 ,正丁烷的燃烧热
,正丁烷的燃烧热 ;异丁烷的燃烧热
;异丁烷的燃烧热 。下列有关说法正确的是
。下列有关说法正确的是_______ (填字母)。
A.奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B.燃烧等质量的正丁烷、异丁烷放热更多的是异丁烷
C.正丁烷比异丁烷稳定
(2)根据丙烷的燃烧热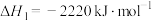 ,
,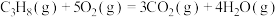

 ,则a
,则a___________ 2220(填“<”或“>”或“=”)。
(3)用 催化还原氮氧化物可以消除氮氧化物的污染。已知:
催化还原氮氧化物可以消除氮氧化物的污染。已知:
①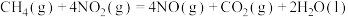
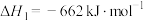
②
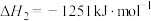
则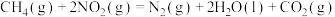

___________ 。
(4)已知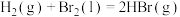
 ,其他相关数据如下表:
,其他相关数据如下表:
则表中a=___________ ;根据键能大小可判断,上述三种物质中最稳定的是___________ 。
(5)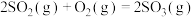 反应过程的能量变化如图所示。
反应过程的能量变化如图所示。

已知:1mol (g)氧化为1mol
(g)氧化为1mol  (g)的
(g)的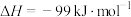 。请回答下列问题:
。请回答下列问题:
①图中
___________ 。
②根据上述计算的焓变值,阐述热化学方程式: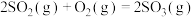
 代表的含义
代表的含义___________ 。
(1)奥运会火炬常用的燃料为丙烷、丁烷等。已知:丙烷的燃烧热
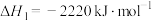 ,正丁烷的燃烧热
,正丁烷的燃烧热 ;异丁烷的燃烧热
;异丁烷的燃烧热 。下列有关说法正确的是
。下列有关说法正确的是A.奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B.燃烧等质量的正丁烷、异丁烷放热更多的是异丁烷
C.正丁烷比异丁烷稳定
(2)根据丙烷的燃烧热
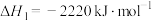 ,
,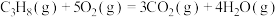

 ,则a
,则a(3)用
 催化还原氮氧化物可以消除氮氧化物的污染。已知:
催化还原氮氧化物可以消除氮氧化物的污染。已知:①
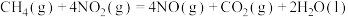
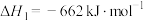
②

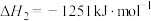
则
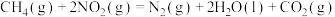

(4)已知
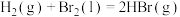
 ,其他相关数据如下表:
,其他相关数据如下表:| 物质 |  (g) (g) |  (l) (l) | HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 230 | a |
(5)
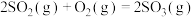 反应过程的能量变化如图所示。
反应过程的能量变化如图所示。
已知:1mol
 (g)氧化为1mol
(g)氧化为1mol  (g)的
(g)的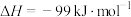 。请回答下列问题:
。请回答下列问题:①图中

②根据上述计算的焓变值,阐述热化学方程式:
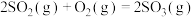
 代表的含义
代表的含义
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】物质在发生化学变化的同时,还在发生能量的变化。
(1)C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有0.5mol水生成时,放出650kJ的热量。则C2H2燃烧热的热化学方程式为_____ 。
(2)火箭发射时可以用肼(N2H4,液态)作燃料,NO2作氧化剂,二者反应生成N2和水蒸气。
已知:
①N2(g)+2O2(g)=2NO2(g) △H1=+66.4kJ•mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) △H2=-662kJ•mol-1
请写出N2H4(l)与NO2反应的热化学方程式_____ 。
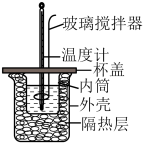
(3)利用如图所示装置测定盐酸与氢氧化钠溶液中和反应的反应热,下列说法正确的是_____ 。
(4)已知:H2(g)+ O2(g)=H2O(g) △H=-242kJ•mol-1,且氧气中1molO=O完全断裂时吸收热量496kJ,水蒸气中1molH-O形成时放出热量463kJ,则氢气中1molH-H断裂时吸收的热量为
O2(g)=H2O(g) △H=-242kJ•mol-1,且氧气中1molO=O完全断裂时吸收热量496kJ,水蒸气中1molH-O形成时放出热量463kJ,则氢气中1molH-H断裂时吸收的热量为_____ kJ。
(5)强酸与强碱稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ•mol-1。
①向NaOH溶液中加入稀醋酸
②向Ba(OH)2溶液中加入稀盐酸
③向NaOH溶液中加入稀硝酸
当反应均生成1mol水时的热效应△H1、△H2、△H3由大到小的关系_____ 。
(1)C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有0.5mol水生成时,放出650kJ的热量。则C2H2燃烧热的热化学方程式为
(2)火箭发射时可以用肼(N2H4,液态)作燃料,NO2作氧化剂,二者反应生成N2和水蒸气。
已知:
①N2(g)+2O2(g)=2NO2(g) △H1=+66.4kJ•mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) △H2=-662kJ•mol-1
请写出N2H4(l)与NO2反应的热化学方程式
(3)利用如图所示装置测定盐酸与氢氧化钠溶液中和反应的反应热,下列说法正确的是

| A.向盐酸中加入氢氧化钠溶液时沿玻璃棒缓慢倒入 |
| B.揭开杯盖,用玻璃棒搅拌,让溶液混合均匀 |
| C.用环形铜丝搅拌棒代替环形玻璃搅拌棒,不影响实验结果 |
| D.改用等浓度的氨水代替氢氧化钠溶液测出的△H偏大 |
 O2(g)=H2O(g) △H=-242kJ•mol-1,且氧气中1molO=O完全断裂时吸收热量496kJ,水蒸气中1molH-O形成时放出热量463kJ,则氢气中1molH-H断裂时吸收的热量为
O2(g)=H2O(g) △H=-242kJ•mol-1,且氧气中1molO=O完全断裂时吸收热量496kJ,水蒸气中1molH-O形成时放出热量463kJ,则氢气中1molH-H断裂时吸收的热量为(5)强酸与强碱稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ•mol-1。
①向NaOH溶液中加入稀醋酸
②向Ba(OH)2溶液中加入稀盐酸
③向NaOH溶液中加入稀硝酸
当反应均生成1mol水时的热效应△H1、△H2、△H3由大到小的关系
您最近一年使用:0次



