(1)依据事实,写出下列反应的热化学方程式。
①在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为:___________________________________________ 。
②若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ热量__________________ 。
③已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为:________________________________ 。
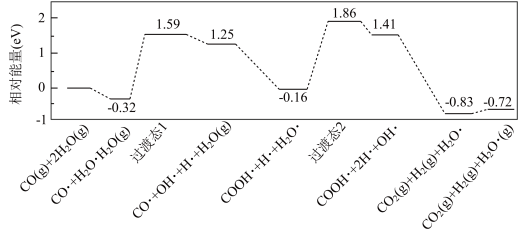
(2)氢气是一种清洁能源。用甲烷制取氢气的两步反应的能量变化如下图所示:
①甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是____________ 。
②第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为____ ,CO的平衡转化率为_____ 。
①在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为:
②若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ热量
③已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为:
(2)氢气是一种清洁能源。用甲烷制取氢气的两步反应的能量变化如下图所示:

①甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是
②第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为
更新时间:2018-11-04 09:08:40
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】(1)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气, 已知
N2(g)+2O2(g)=2NO2(g) ⊿ H1 = + 67.7kJ/mol;
N2H4(g)+O2(g)= N2(g)+2H2O(g) ⊿ H2 = - 534kJ/mol;
2H2(g)+ O2(g)= 2H2O (g) ⊿ H3 = - 484kJ/mol;
H2(g)+F2(g)=2HF(g) ⊿ H4 = - 538kJ/mol
①写出N2H4与 NO2反应的热化学方程式______________________ ,
②写出N2H4与F2反应的热化学方程式__________________________
(2)已知反应:Cl2+2HBr===Br2+2HCl。
Ⅰ.当有0.2 mol HCl生成时放出8.1 kJ的热量。
Ⅱ.其能量变化示意图如图:
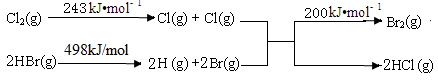
由上述数据判断断开1 mol H—Cl 键与断开 1 mol H—Br键所需能量相差约为________ kJ。
N2(g)+2O2(g)=2NO2(g) ⊿ H1 = + 67.7kJ/mol;
N2H4(g)+O2(g)= N2(g)+2H2O(g) ⊿ H2 = - 534kJ/mol;
2H2(g)+ O2(g)= 2H2O (g) ⊿ H3 = - 484kJ/mol;
H2(g)+F2(g)=2HF(g) ⊿ H4 = - 538kJ/mol
①写出N2H4与 NO2反应的热化学方程式
②写出N2H4与F2反应的热化学方程式
(2)已知反应:Cl2+2HBr===Br2+2HCl。
Ⅰ.当有0.2 mol HCl生成时放出8.1 kJ的热量。
Ⅱ.其能量变化示意图如图:
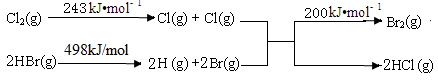
由上述数据判断断开1 mol H—Cl 键与断开 1 mol H—Br键所需能量相差约为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】硫单质及其化合物在工农生产中有着重要的应用,请回答下列问题:
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)=CaO(s)+SO2(g)+CO2(g) △H=+210.5kJ·mol-1
②1/4CaSO4(s)+CO(g)=1/4CaS(s)+CO2(g) △H=-47.3kJ·mol-1
反应:CaO(s)+3CO(g)+SO2(g)=CaS(s)+3CO2(g) △H=_____________ kJ·mol-1
(2)下图为密闭容器中H2S气体分解生产H2和S2(g)的平衡转化率与温度、压强的关系。
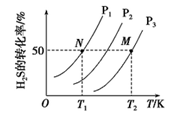
该反应平衡常数的大小关系为K(T1)____ K(T2)(填“>”、“=”或“<”),理由是____ 。用各物质的平衡分压代替平衡浓度表示反应的平衡常数,记为Kp,计算该反应在T1温度下的Kp=_________ (用p1表示)。
(3)在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g) 2SO3 (g)△H<0。据下图判断,反应进行至20min时,曲线发生变化的原因是
2SO3 (g)△H<0。据下图判断,反应进行至20min时,曲线发生变化的原因是________________ (用文字表达);10min到15min的曲线变化的原因可能是________ (填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO2的物质的量
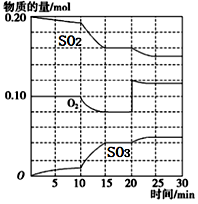
(4)烟气中SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=__________________ (用含硫微粒浓度的代数式表示)。
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)=CaO(s)+SO2(g)+CO2(g) △H=+210.5kJ·mol-1
②1/4CaSO4(s)+CO(g)=1/4CaS(s)+CO2(g) △H=-47.3kJ·mol-1
反应:CaO(s)+3CO(g)+SO2(g)=CaS(s)+3CO2(g) △H=
(2)下图为密闭容器中H2S气体分解生产H2和S2(g)的平衡转化率与温度、压强的关系。

该反应平衡常数的大小关系为K(T1)
(3)在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g)
 2SO3 (g)△H<0。据下图判断,反应进行至20min时,曲线发生变化的原因是
2SO3 (g)△H<0。据下图判断,反应进行至20min时,曲线发生变化的原因是a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO2的物质的量

(4)烟气中SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】研究化学反应时,既要关注物质变化,又要关注能量变化。请回答以下问题:
(1)下列反应中能量变化与如图一致的是___________(填字母)。
(2)如图是1mol  (g)和1mol CO(g)反应生成1mol
(g)和1mol CO(g)反应生成1mol  (g)和1mol NO(g)过程中能量变化示意图。
(g)和1mol NO(g)过程中能量变化示意图。
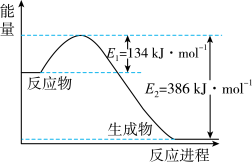
①该反应是___________ (填“吸热”或“放热”)反应。
②请写出该反应的热化学方程式:___________ 。
③若在该反应体系中加入催化剂,则对反应热___________ (填“有”或“没有”)影响。
(3)化学反应的焓变与反应物和生成物的键能有关。
已知:
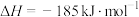
则H-Cl的键能为___________  。
。
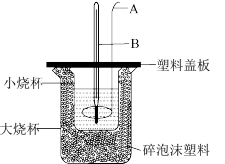
(4)实验小组设计用盐酸与氢氧化钠溶液在如图装置中进行中和反应。图中仪器A的作用是___________ ;碎泡沫塑料的作用是___________ 。
(1)下列反应中能量变化与如图一致的是___________(填字母)。

| A.甲烷燃烧 | B.生石灰与水反应 |
| C.镁与稀硫酸的反应 | D.氢氧化钡晶体和氯化铵晶体反应 |
 (g)和1mol CO(g)反应生成1mol
(g)和1mol CO(g)反应生成1mol  (g)和1mol NO(g)过程中能量变化示意图。
(g)和1mol NO(g)过程中能量变化示意图。
①该反应是
②请写出该反应的热化学方程式:
③若在该反应体系中加入催化剂,则对反应热
(3)化学反应的焓变与反应物和生成物的键能有关。
已知:

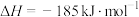
| 共价键 | H-H | Cl-Cl |
键能/( ) ) | 436 | 247 |
 。
。(4)实验小组设计用盐酸与氢氧化钠溶液在如图装置中进行中和反应。图中仪器A的作用是

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】按要求填空:
(1)13gC2H2(g)完全燃烧生成CO2(g)和H2O(l)时,放出659kJ的热量,写出该反应的热化学方程式_____ 。
(2)试写出镁粉投入NH4Cl溶液中反应的离子方程式_____ 。
(3)AlCl3水溶液的pH值_____ 7(填“>”、“<”或“=”),原因是(用离子方程式表示)______ 。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_____ 。
(4)在配制Na2S溶液时,为了防止发生水解,可以加入少量的_____ 。
(5)常温下,测得CH3COONH4溶液的pH=7,则说明CH3COO-的水解程度______ (填“>”、“<”或“=”)NH 的水解程度,CH3COO-与NH
的水解程度,CH3COO-与NH 浓度的大小关系是:c(CH3COO-)
浓度的大小关系是:c(CH3COO-)______ c(NH )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。
(1)13gC2H2(g)完全燃烧生成CO2(g)和H2O(l)时,放出659kJ的热量,写出该反应的热化学方程式
(2)试写出镁粉投入NH4Cl溶液中反应的离子方程式
(3)AlCl3水溶液的pH值
(4)在配制Na2S溶液时,为了防止发生水解,可以加入少量的
(5)常温下,测得CH3COONH4溶液的pH=7,则说明CH3COO-的水解程度
 的水解程度,CH3COO-与NH
的水解程度,CH3COO-与NH 浓度的大小关系是:c(CH3COO-)
浓度的大小关系是:c(CH3COO-) )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】随着化石能源的减少,新能源的开发利用日益迫切。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
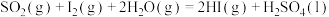
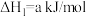
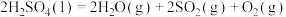
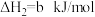
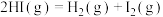
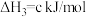
则: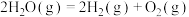

___________ kJ/mol。
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为
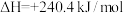 ,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程
,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程___________ (填“吸收”或“放出”)的热量是___________ kJ。
(3)甲醇是一种新型的汽车动力燃料。
①以 和
和 为原料合成甲醇,反应的能量变化如下图所示,则图中A处应填写的内容为
为原料合成甲醇,反应的能量变化如下图所示,则图中A处应填写的内容为___________ 。

②工业上利用CO和 来制备甲醇气体。已知某些化学键的键能数据如下表:
来制备甲醇气体。已知某些化学键的键能数据如下表:
设CO以 键构成,则工业制备甲醇的热化学方程式为
键构成,则工业制备甲醇的热化学方程式为___________ 。
(4)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示:
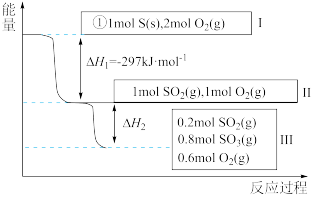
已知: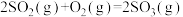

①表示硫的燃烧热的热化学方程式为___________ 。
②图中
___________ kJ/mol。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
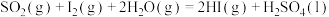
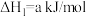
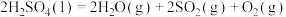
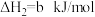
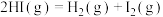
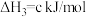
则:
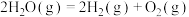

(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为

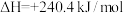 ,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程
,若将生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应,则此制备纯硅反应过程(3)甲醇是一种新型的汽车动力燃料。
①以
 和
和 为原料合成甲醇,反应的能量变化如下图所示,则图中A处应填写的内容为
为原料合成甲醇,反应的能量变化如下图所示,则图中A处应填写的内容为
②工业上利用CO和
 来制备甲醇气体。已知某些化学键的键能数据如下表:
来制备甲醇气体。已知某些化学键的键能数据如下表:| 化学键 |  |  |  |  |  |  |
键能/ | 348 | 413 | 436 | 358 | 1072 | 463 |
 键构成,则工业制备甲醇的热化学方程式为
键构成,则工业制备甲醇的热化学方程式为(4)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示:

已知:
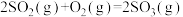

①表示硫的燃烧热的热化学方程式为
②图中

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】化学反应过程中伴随着能量变化,请回答下列问题:
(1)下列反应中,属于放热反应的是___________ (填序号,下同),属于吸热反应的是___________ 。
①物质燃烧 ②二氧化碳通过炽热的碳 ③生石灰溶于水的过程 ④炸药爆炸 ⑤碳酸钙高温分解
(2)某实验小组同学进行如图所示实验,以检验化学反应中的能量变化。

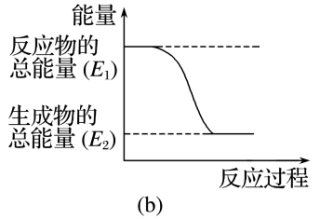
实验发现,反应后①中的温度升高,②中的温度降低。由此判断铝条与盐酸的反应是___________ 反应(填“放出”或“吸收”,下同),Ba(OH)2·8H2O与NH4Cl的反应是___________ 反应。反应___________ (填①或②)的能量变化可用图(b)表示。
(3)一定量的氢气在氧气中充分燃烧并放出热量。若生成气态水放出的热量为Q1,生成液态水放出的热量为Q2,那么Q1___________ (填大于、小于或等于)Q2。
(4)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。
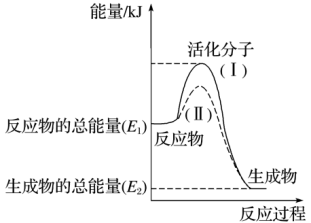
图中所示反应是___________ (填“吸热”或“放热”)反应。
(5)已知拆开1molH-H键、1molI-I键、1molH-I键分别需要吸收的能量为436kJ、151kJ、299kJ。则反应掉1mol氢气和1mol碘,生成HI会___________ (填“放出”或“吸收”)___________ kJ的热量。
(6)已知:4HCl+O2=2Cl2+2H2O,该反应中,4 mol HCl被氧化,放出115.6 kJ的热量,则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为___________ kJ。
(1)下列反应中,属于放热反应的是
①物质燃烧 ②二氧化碳通过炽热的碳 ③生石灰溶于水的过程 ④炸药爆炸 ⑤碳酸钙高温分解
(2)某实验小组同学进行如图所示实验,以检验化学反应中的能量变化。


实验发现,反应后①中的温度升高,②中的温度降低。由此判断铝条与盐酸的反应是
(3)一定量的氢气在氧气中充分燃烧并放出热量。若生成气态水放出的热量为Q1,生成液态水放出的热量为Q2,那么Q1
(4)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。

图中所示反应是
(5)已知拆开1molH-H键、1molI-I键、1molH-I键分别需要吸收的能量为436kJ、151kJ、299kJ。则反应掉1mol氢气和1mol碘,生成HI会
(6)已知:4HCl+O2=2Cl2+2H2O,该反应中,4 mol HCl被氧化,放出115.6 kJ的热量,则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为

您最近一年使用:0次
填空题
|
适中
(0.65)
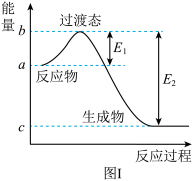
【推荐2】请参考题中图表,根据要求回答问题:
(1)图I是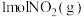 和
和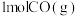 反应生成
反应生成 和
和 过程中的能量变化示意图,已知
过程中的能量变化示意图,已知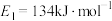 、
、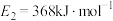 ,若在反应体系中加入催化剂,反应速率增大,
,若在反应体系中加入催化剂,反应速率增大, 的变化是
的变化是___________ (填“增大”、“减小”或“不变”,下同), 的变化是
的变化是___________ 。请写出 和
和 反应的热化学方程式:
反应的热化学方程式:___________ 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①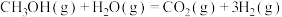
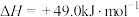
②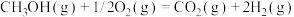
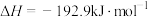
又知③
 ,则甲醇蒸汽燃烧为液态水的热化学方程式为
,则甲醇蒸汽燃烧为液态水的热化学方程式为___________ 。
(3)如表所示是部分化学键的键能参数:
已知白磷的燃烧热为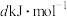 ,白磷及其完全燃烧的产物的结构如图II所示,
,白磷及其完全燃烧的产物的结构如图II所示,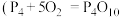 )则表中x=
)则表中x=___________  (用含a、b、c、d的代数式表示)。
(用含a、b、c、d的代数式表示)。
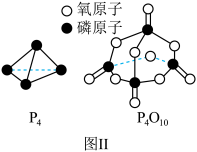
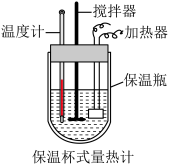
(4)某实验小组通过如图所示的量热计中,向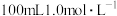 稀盐酸加
稀盐酸加 稀
稀 溶液(碱稍过量),测得中和热
溶液(碱稍过量),测得中和热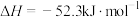 ,理论值为
,理论值为 ,造成这一结果的原因可能是
,造成这一结果的原因可能是___________ 。
a.用量筒量取盐酸时仰视读数
b.分多次将 溶液倒入量热计中
溶液倒入量热计中
c.温度计测量完盐酸的温度再次测量 溶液温度时,残留的酸液末用水冲洗干净
溶液温度时,残留的酸液末用水冲洗干净
d.错把同浓度的醋酸当成盐酸溶液与 溶液反应
溶液反应
(1)图I是
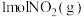 和
和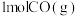 反应生成
反应生成 和
和 过程中的能量变化示意图,已知
过程中的能量变化示意图,已知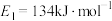 、
、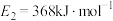 ,若在反应体系中加入催化剂,反应速率增大,
,若在反应体系中加入催化剂,反应速率增大, 的变化是
的变化是 的变化是
的变化是 和
和 反应的热化学方程式:
反应的热化学方程式:
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①
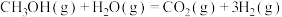
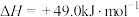
②
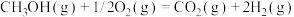
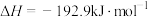
又知③

 ,则甲醇蒸汽燃烧为液态水的热化学方程式为
,则甲醇蒸汽燃烧为液态水的热化学方程式为(3)如表所示是部分化学键的键能参数:
| 化学键 |  |  |  | 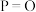 |
键能 |  |  |  |  |
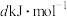 ,白磷及其完全燃烧的产物的结构如图II所示,
,白磷及其完全燃烧的产物的结构如图II所示,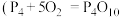 )则表中x=
)则表中x= (用含a、b、c、d的代数式表示)。
(用含a、b、c、d的代数式表示)。
(4)某实验小组通过如图所示的量热计中,向
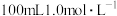 稀盐酸加
稀盐酸加 稀
稀 溶液(碱稍过量),测得中和热
溶液(碱稍过量),测得中和热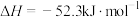 ,理论值为
,理论值为 ,造成这一结果的原因可能是
,造成这一结果的原因可能是
a.用量筒量取盐酸时仰视读数
b.分多次将
 溶液倒入量热计中
溶液倒入量热计中c.温度计测量完盐酸的温度再次测量
 溶液温度时,残留的酸液末用水冲洗干净
溶液温度时,残留的酸液末用水冲洗干净d.错把同浓度的醋酸当成盐酸溶液与
 溶液反应
溶液反应
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】宇宙中所有的一切都是能量的变化,研究化学反应中的能量变化意义重大。
(1)奥运会火炬常用的燃料为丙烷、丁烷等。已知:丙烷的燃烧热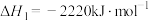 ,正丁烷的燃烧热
,正丁烷的燃烧热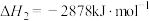 ;异丁烷的燃烧热
;异丁烷的燃烧热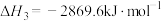 。下列有关说法正确的是
。下列有关说法正确的是_______ (填字母)。
A.奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B.异丁烷分子中的碳氢键比正丁烷的多
C.正丁烷比异丁烷稳定
(2)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。键能也可以用于估算化学反应的反应热( )。下表是部分化学键的键能数据:
)。下表是部分化学键的键能数据:

已知白磷的燃烧热为2378.0kJ·mol-1,白磷和白磷完全燃烧的产物结构如图所示,则上表中X=___ 。
(3)研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
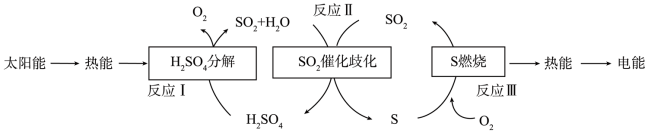
反应I:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g)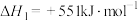
反应III:S(s)+O2(g)=SO2(g)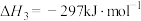
反应II的热化学方程式:_______ 。
(4)热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的生成热( )。如图为VIA族元素(包括氧、硫、硒、碲)氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
)。如图为VIA族元素(包括氧、硫、硒、碲)氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
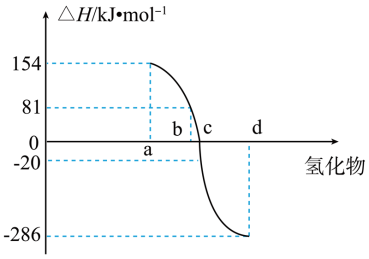
①图中d对应的氢化物是_______ (填化学式),结合元素周期律归纳非金属元素氢化物的稳定性与氢化物的生成热 的关系:
的关系:_______ 。
②硒化氢在上述条件下发生分解反应的热化学方程式为____ 。(沸点:硒化氢-41.3℃;硒684.9℃)
(1)奥运会火炬常用的燃料为丙烷、丁烷等。已知:丙烷的燃烧热
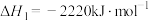 ,正丁烷的燃烧热
,正丁烷的燃烧热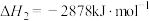 ;异丁烷的燃烧热
;异丁烷的燃烧热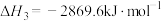 。下列有关说法正确的是
。下列有关说法正确的是A.奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B.异丁烷分子中的碳氢键比正丁烷的多
C.正丁烷比异丁烷稳定
(2)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。键能也可以用于估算化学反应的反应热(
 )。下表是部分化学键的键能数据:
)。下表是部分化学键的键能数据:| 化学键 | P-P | P-O | O=O | P=O |
| 键能/(kJ/mol) | 172 | 335 | 498 | X |

已知白磷的燃烧热为2378.0kJ·mol-1,白磷和白磷完全燃烧的产物结构如图所示,则上表中X=
(3)研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:

反应I:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g)
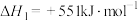
反应III:S(s)+O2(g)=SO2(g)
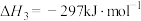
反应II的热化学方程式:
(4)热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的生成热(
 )。如图为VIA族元素(包括氧、硫、硒、碲)氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
)。如图为VIA族元素(包括氧、硫、硒、碲)氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
①图中d对应的氢化物是
 的关系:
的关系:②硒化氢在上述条件下发生分解反应的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】下图是工业生产硝酸铵的流程。
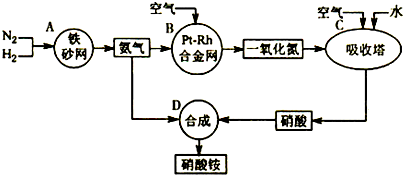
(1)吸收塔C中通入空气的目的是_________________________________ 。
A、B、C、D四个容器中的反应,属于氧化还原反应的是_______ (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H = -1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式:_______ ,氨催化氧化反应的化学平衡常数表达式K=_____ 。
(3)已知:N2(g)+3H2(g) 2NH3(g) △H= -92 kJ/mol。为提高氢气的转化率,宜采取的措施有
2NH3(g) △H= -92 kJ/mol。为提高氢气的转化率,宜采取的措施有_______ 。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为________ 。

(1)吸收塔C中通入空气的目的是
A、B、C、D四个容器中的反应,属于氧化还原反应的是
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H = -1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式:
(3)已知:N2(g)+3H2(g)
 2NH3(g) △H= -92 kJ/mol。为提高氢气的转化率,宜采取的措施有
2NH3(g) △H= -92 kJ/mol。为提高氢气的转化率,宜采取的措施有A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g)△H
CH3OH(g)△H
(1)该反应的平衡常数表达式为_______ ;
(2)如表所列数据是反应在不同温度下的化学平衡常数(K)
①由表中数据判断该反应的△H______ 0(填“>”、“=”或“<”);
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10s后达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为____ ,用H2表示反应速率为_____ ,此时的温度为______ ;
(3)要提高CO的转化率,可以采取的措施是______ ;
a.升温 b.加入催化剂 c.增加CO的浓度
d.恒容充入H2 e.恒压充入惰性气体 f.分离出甲醇
 CH3OH(g)△H
CH3OH(g)△H(1)该反应的平衡常数表达式为
(2)如表所列数据是反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10s后达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为
(3)要提高CO的转化率,可以采取的措施是
a.升温 b.加入催化剂 c.增加CO的浓度
d.恒容充入H2 e.恒压充入惰性气体 f.分离出甲醇
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】利用I2O5消除CO污染的反应为5CO(g)+I2O5(s) 5CO2(g)+I2(s) △H,已知在不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2的气体体积分数φ(CO2)随时间t的变化曲线如图所示(b,c点都已经达平衡)。回答下列问题:
5CO2(g)+I2(s) △H,已知在不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2的气体体积分数φ(CO2)随时间t的变化曲线如图所示(b,c点都已经达平衡)。回答下列问题:_______ mol•L-1•min-1。
(2)b点时CO的转化率为_____ ,T1温度下该反应的平衡常数K=______ 。
(3)T1______ T2(填“>”或“<”或“=”,下同),b点的平衡常数_______ c点的平衡常数。
(4)反应达到平衡后,保持温度和体积不变再充入一定量的CO气体,则平衡_______ (填“正向”“逆向”或“不”)移动,达到新平衡后CO转化率______ (填“增大”“减小”或“不变”)。
(5)若在T1温度下,起始时改为向装有足量I2O5固体的2L恒容密闭容器中通入3molCO和5molCO2气体,反应达平衡时的能量变化的绝对值为bkJ,则2CO(g)+I2O5(s) 2CO2(g)+I2(s)的△H=
2CO2(g)+I2(s)的△H=______ kJ•mol-1(用含b的代数式表示)。
 5CO2(g)+I2(s) △H,已知在不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2的气体体积分数φ(CO2)随时间t的变化曲线如图所示(b,c点都已经达平衡)。回答下列问题:
5CO2(g)+I2(s) △H,已知在不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2的气体体积分数φ(CO2)随时间t的变化曲线如图所示(b,c点都已经达平衡)。回答下列问题: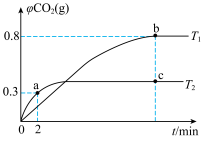
(2)b点时CO的转化率为
(3)T1
(4)反应达到平衡后,保持温度和体积不变再充入一定量的CO气体,则平衡
(5)若在T1温度下,起始时改为向装有足量I2O5固体的2L恒容密闭容器中通入3molCO和5molCO2气体,反应达平衡时的能量变化的绝对值为bkJ,则2CO(g)+I2O5(s)
 2CO2(g)+I2(s)的△H=
2CO2(g)+I2(s)的△H=
您最近一年使用:0次

 标注。
标注。