(1)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气, 已知
N2(g)+2O2(g)=2NO2(g) ⊿ H1 = + 67.7kJ/mol;
N2H4(g)+O2(g)= N2(g)+2H2O(g) ⊿ H2 = - 534kJ/mol;
2H2(g)+ O2(g)= 2H2O (g) ⊿ H3 = - 484kJ/mol;
H2(g)+F2(g)=2HF(g) ⊿ H4 = - 538kJ/mol
①写出N2H4与 NO2反应的热化学方程式______________________ ,
②写出N2H4与F2反应的热化学方程式__________________________
(2)已知反应:Cl2+2HBr===Br2+2HCl。
Ⅰ.当有0.2 mol HCl生成时放出8.1 kJ的热量。
Ⅱ.其能量变化示意图如图:
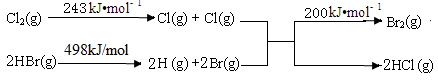
由上述数据判断断开1 mol H—Cl 键与断开 1 mol H—Br键所需能量相差约为________ kJ。
N2(g)+2O2(g)=2NO2(g) ⊿ H1 = + 67.7kJ/mol;
N2H4(g)+O2(g)= N2(g)+2H2O(g) ⊿ H2 = - 534kJ/mol;
2H2(g)+ O2(g)= 2H2O (g) ⊿ H3 = - 484kJ/mol;
H2(g)+F2(g)=2HF(g) ⊿ H4 = - 538kJ/mol
①写出N2H4与 NO2反应的热化学方程式
②写出N2H4与F2反应的热化学方程式
(2)已知反应:Cl2+2HBr===Br2+2HCl。
Ⅰ.当有0.2 mol HCl生成时放出8.1 kJ的热量。
Ⅱ.其能量变化示意图如图:
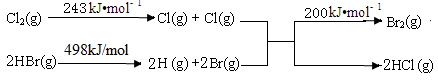
由上述数据判断断开1 mol H—Cl 键与断开 1 mol H—Br键所需能量相差约为
更新时间:2018-11-07 21:08:55
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】(1)对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。
CO还原法:一定条件下,由SO2和CO反应生成S和CO2的能量变化如图所示,每生成16gS(s),该反应___ (填“放出”或“吸收”)的热量为__ 。

(2)汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。已知:
①
②
③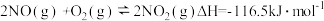
Ⅰ.CO的燃烧热为___ 。若1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收946kJ、498kJ的能量,则1molNO(g)分子中化学键断裂时需吸收的能量为___ kJ。
Ⅱ.CO将NO2还原为单质的热化学方程式为___ 。
CO还原法:一定条件下,由SO2和CO反应生成S和CO2的能量变化如图所示,每生成16gS(s),该反应

(2)汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。已知:
①

②

③
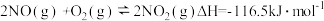
Ⅰ.CO的燃烧热为
Ⅱ.CO将NO2还原为单质的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】回答下列问题
(1)氨是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如图所示。

①实验室制备氨气的化学方程式:_______
②设备1中发生反应的化学方程式为:_______
③设备2中通入的物质A是:_______
④ 跟NaClO反应来制得肼(
跟NaClO反应来制得肼( )。该反应的化学方程式为:
)。该反应的化学方程式为:______
(2)利用甲烷催化还原氮氧化物,可以消除氮氧化物的污染。已知:
①

②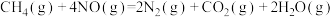

③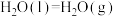

写出 将
将 还原为
还原为 并生成液态水时的热化学方程式:
并生成液态水时的热化学方程式:_______
(3)科研人员设想用如图原电池装置生产硫酸,则负极的电极反应式为_______ 为稳定持续生产,硫酸溶液的浓度应维持不变,则通入 和水的质量比为
和水的质量比为_______

(1)氨是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如图所示。

①实验室制备氨气的化学方程式:
②设备1中发生反应的化学方程式为:
③设备2中通入的物质A是:
④
 跟NaClO反应来制得肼(
跟NaClO反应来制得肼( )。该反应的化学方程式为:
)。该反应的化学方程式为:(2)利用甲烷催化还原氮氧化物,可以消除氮氧化物的污染。已知:
①


②
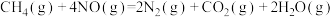

③

写出
 将
将 还原为
还原为 并生成液态水时的热化学方程式:
并生成液态水时的热化学方程式:(3)科研人员设想用如图原电池装置生产硫酸,则负极的电极反应式为
 和水的质量比为
和水的质量比为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】工业制硝酸的主要反应为:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(l)△H
(1)已知氢气的燃烧热为△H=﹣285.8kJ/mol.
N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol;
N2(g)+O2(g)═2NO(g)△H=+180.6kJ/mol.
则上述工业制硝酸的主要反应的△H=_____ 。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如表:
①反应在第2min到第4min时,O2的平均反应速率为_____ 。
②反应在第6min时改变了条件,改变的条件可能是_____ (填序号).
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)达到平衡状态的是_____ (填序号).
A.单位时间内生成n mol NO的同时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
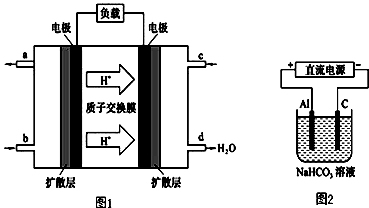
(3)某研究所组装的CH2=CH2﹣O2燃料电池的工作原理如图1所示.
①该电池工作时,b口通入的物质为_____ 。
②该电池负极的电极反应式为:_____ 。
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图2所示)的过程中,发现阳极周围变浑浊并有气泡产生,其原因可能是:_____ (用相关的离子方程式表示)。
(1)已知氢气的燃烧热为△H=﹣285.8kJ/mol.
N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol;
N2(g)+O2(g)═2NO(g)△H=+180.6kJ/mol.
则上述工业制硝酸的主要反应的△H=
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如表:
| 浓度 | c(NH3)(mol/L) | c(O2)(mol/L) | c(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
①反应在第2min到第4min时,O2的平均反应速率为
②反应在第6min时改变了条件,改变的条件可能是
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)达到平衡状态的是
A.单位时间内生成n mol NO的同时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
(3)某研究所组装的CH2=CH2﹣O2燃料电池的工作原理如图1所示.
①该电池工作时,b口通入的物质为
②该电池负极的电极反应式为:
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图2所示)的过程中,发现阳极周围变浑浊并有气泡产生,其原因可能是:

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】(1) 已知: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 = akJ/mol;
CO(g) + H2O (g)=CO2(g) + H2 (g) △H2 = bkJ/mol;
2CO(g) + O2(g)= 2CO2(g) △H3 = ckJ/mol;
反应CO2(g)+ CH4(g)=2CO(g) + 2H2(g) 的△H =_____ kJ/mol;
(2) 科学家用氮化镓材料与铜组装如图10的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。

①写出铜电极表面的电极反应式_____________ 。
②为提高该人工光合系统的工作效率,可向装置中加入少量_______ (选填“盐酸”或“硫酸”)。
(3) 天然气中的H2S 杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS 溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式___________ 。
(4) 将甲烷和硫反应可以制备CS2,其流程如图11所示:
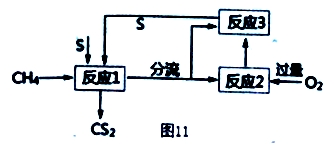
①写出发生反应1的化学反应方程式___________ 。
②反应1产生两种含硫的物质,为了提高CS2的产率,设计反应2和3实现硫单质循环利用,实验时需对反应1出来的气体分流,则进入反应2 和反应3 的气体物质的量之比为___________ 。
③当反应1中每有1molCS2生成时,反应2中需要消耗O2的物质的量为___________ 。
CO(g) + H2O (g)=CO2(g) + H2 (g) △H2 = bkJ/mol;
2CO(g) + O2(g)= 2CO2(g) △H3 = ckJ/mol;
反应CO2(g)+ CH4(g)=2CO(g) + 2H2(g) 的△H =
(2) 科学家用氮化镓材料与铜组装如图10的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。

①写出铜电极表面的电极反应式
②为提高该人工光合系统的工作效率,可向装置中加入少量
(3) 天然气中的H2S 杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS 溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式
(4) 将甲烷和硫反应可以制备CS2,其流程如图11所示:

①写出发生反应1的化学反应方程式
②反应1产生两种含硫的物质,为了提高CS2的产率,设计反应2和3实现硫单质循环利用,实验时需对反应1出来的气体分流,则进入反应2 和反应3 的气体物质的量之比为
③当反应1中每有1molCS2生成时,反应2中需要消耗O2的物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】填空
(1)已知: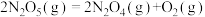
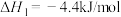

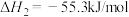
则反应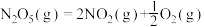

_______ kJ/mol。
(2)已知相关的化学键键能数据如下:
则

_______ kJ/mol。
(3)下图是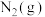 和
和 反应生成
反应生成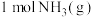 过程中能量变化示意图,合成氨反应的热化学方程式为
过程中能量变化示意图,合成氨反应的热化学方程式为_______ 。
(4)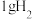 燃烧生成
燃烧生成 放热121 kJ,
放热121 kJ, 蒸发吸热44 kJ,
蒸发吸热44 kJ, 燃烧热的热化学方程式为
燃烧热的热化学方程式为_______ 。
(5)①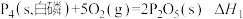
②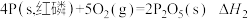
常温时红磷比白磷稳定,则
_______  (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
(1)已知:
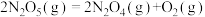
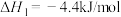

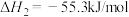
则反应
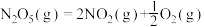

(2)已知相关的化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | 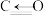 |
键能/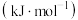 | 413 | 745 | 436 | 1075 |


(3)下图是
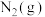 和
和 反应生成
反应生成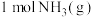 过程中能量变化示意图,合成氨反应的热化学方程式为
过程中能量变化示意图,合成氨反应的热化学方程式为
(4)
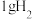 燃烧生成
燃烧生成 放热121 kJ,
放热121 kJ, 蒸发吸热44 kJ,
蒸发吸热44 kJ, 燃烧热的热化学方程式为
燃烧热的热化学方程式为(5)①
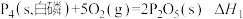
②
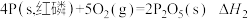
常温时红磷比白磷稳定,则

 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
您最近一年使用:0次
【推荐3】回答下列问题
(1)有机物M经过太阳光光照可转化成N,转化过程为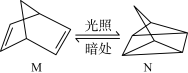
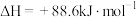 ,则M、N相比,较稳定的是
,则M、N相比,较稳定的是______ 。
(2)已知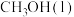 的摩尔燃烧焓为
的摩尔燃烧焓为 ,
,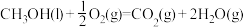
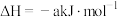 ,则a
,则a______ (填“>”“<”或“=”)726.5。
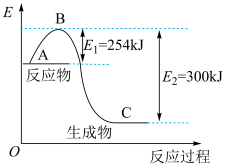
(3)反应 过程中的能量变化如图所示,回答下列问题。
过程中的能量变化如图所示,回答下列问题。
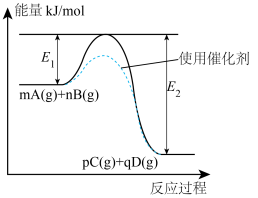
该反应
______ kJ/mol(用含E1、E2式子表示);
在反应体系中加入催化剂,该反应的∆H______ (填增大、减小、不变)。
(4)已知常温时红磷比白磷稳定,
已知:①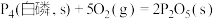 ∆H1
∆H1
②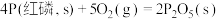 ∆H2
∆H2
比较反应中 的大小:∆H1 ∆H2(填“>”、“<”或“=”)。
的大小:∆H1 ∆H2(填“>”、“<”或“=”)。
(5)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①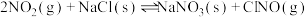 ∆H1
∆H1
②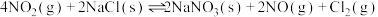 ∆H2
∆H2
③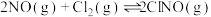 ∆H3
∆H3
则∆H3= (用∆H1和∆H2表示)。
(6)已知断裂1mol某些共价键需要的能量如下表:
N2与O2合成NO的热化学方程式可以表示为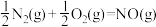
 ,则∆H=
,则∆H=______ .
(1)有机物M经过太阳光光照可转化成N,转化过程为

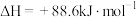 ,则M、N相比,较稳定的是
,则M、N相比,较稳定的是(2)已知
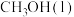 的摩尔燃烧焓为
的摩尔燃烧焓为 ,
,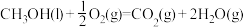
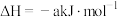 ,则a
,则a(3)反应
 过程中的能量变化如图所示,回答下列问题。
过程中的能量变化如图所示,回答下列问题。
该反应

在反应体系中加入催化剂,该反应的∆H
(4)已知常温时红磷比白磷稳定,
已知:①
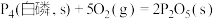 ∆H1
∆H1②
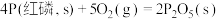 ∆H2
∆H2比较反应中
 的大小:∆H1 ∆H2(填“>”、“<”或“=”)。
的大小:∆H1 ∆H2(填“>”、“<”或“=”)。(5)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①
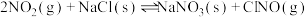 ∆H1
∆H1②
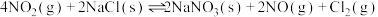 ∆H2
∆H2③
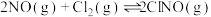 ∆H3
∆H3则∆H3= (用∆H1和∆H2表示)。
(6)已知断裂1mol某些共价键需要的能量如下表:
断裂的共价键 |
|
|
|
需要的能量/kJ | 498 | 945 | 630 |
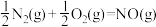
 ,则∆H=
,则∆H=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】化学键的键能是指气态原子间形成1 mol化学键时释放的能量。如H(g)+I(g) H—I(g)放出297 kJ的能量,即H—I键的键能为297 kJ·mol-1,也可以理解为破坏1 mol H—I键需要吸收297 kJ的热量。下表是一些键能的数据(单位:kJ·mol-1)。
H—I(g)放出297 kJ的能量,即H—I键的键能为297 kJ·mol-1,也可以理解为破坏1 mol H—I键需要吸收297 kJ的热量。下表是一些键能的数据(单位:kJ·mol-1)。
回答下列问题:
(1)一个化学反应的反应热(设反应物、生成物均为气态)与反应物和生成物中的键能之间有密切的关系。由表中数据计算下列热化学方程式中的热效应:H2(g)+Cl2(g) 2HCl(g) ΔH=
2HCl(g) ΔH=____ 。
(2)共价键的极性强弱对化学反应有很大的影响。卤代烃RX在同样条件下发生碱性水解反应(RX+NaOH R—OH+NaX)时,RF、RCl、RBr、RI(R相同)的反应活性由小到大的顺序是
R—OH+NaX)时,RF、RCl、RBr、RI(R相同)的反应活性由小到大的顺序是_______ 。
(3)根据表中数据判断CCl4的稳定性____ (填“大于”或“小于”)CF4的稳定性。
(4)试预测C—Br键的键能范围(填具体数值):___ <C—Br键的键能<____ 。
 H—I(g)放出297 kJ的能量,即H—I键的键能为297 kJ·mol-1,也可以理解为破坏1 mol H—I键需要吸收297 kJ的热量。下表是一些键能的数据(单位:kJ·mol-1)。
H—I(g)放出297 kJ的能量,即H—I键的键能为297 kJ·mol-1,也可以理解为破坏1 mol H—I键需要吸收297 kJ的热量。下表是一些键能的数据(单位:kJ·mol-1)。| 共价键 | 键能 | 共价键 | 键能 | 共价键 | 键能 | 共价键 | 键能 |
| H—H | 436 | Cl—Cl | 243 | H—Cl | 431 | H—O | 467 |
S S S | 255 | H—S | 339 | C—F | 427 | C—O | 358 |
| C—Cl | 330 | C—I | 218 | H—F | 565 | N≡N | 945 |
(1)一个化学反应的反应热(设反应物、生成物均为气态)与反应物和生成物中的键能之间有密切的关系。由表中数据计算下列热化学方程式中的热效应:H2(g)+Cl2(g)
 2HCl(g) ΔH=
2HCl(g) ΔH=(2)共价键的极性强弱对化学反应有很大的影响。卤代烃RX在同样条件下发生碱性水解反应(RX+NaOH
 R—OH+NaX)时,RF、RCl、RBr、RI(R相同)的反应活性由小到大的顺序是
R—OH+NaX)时,RF、RCl、RBr、RI(R相同)的反应活性由小到大的顺序是(3)根据表中数据判断CCl4的稳定性
(4)试预测C—Br键的键能范围(填具体数值):
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】(1)如图是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应,比较E1、E2、E3的大小:_____ 。

(2)已知2mol氢气燃烧生成液态水时放出572kJ的热量,反应方程式是2H2(g)+O2(g)═2H2O(l)。请回答下列问题:
①该反应的生成物能量总和____ (填“大于”、“小于”或“等于”)反应物能量总和。
②若2mol氢气完全燃烧生成水蒸气,则放出的热量____ (填“大于”、“小于”或“等于”)572kJ。
(3)已知拆开1molN﹣N键、1molN﹣H键、1molN≡N键、O=O键需要的能量分别是3akJ、2.5akJ、8akJ、4akJ,完全燃烧1mol火箭燃料肼(N2H4)生成氮气和水蒸气放出能量为5akJ,则1molH2O(g)完全断键时共吸收____ kJ的能量。
(4)已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,反应物的总键能_____ (填“大于”、“小于”或“等于”)生成物的总键能。


(2)已知2mol氢气燃烧生成液态水时放出572kJ的热量,反应方程式是2H2(g)+O2(g)═2H2O(l)。请回答下列问题:
①该反应的生成物能量总和
②若2mol氢气完全燃烧生成水蒸气,则放出的热量
(3)已知拆开1molN﹣N键、1molN﹣H键、1molN≡N键、O=O键需要的能量分别是3akJ、2.5akJ、8akJ、4akJ,完全燃烧1mol火箭燃料肼(N2H4)生成氮气和水蒸气放出能量为5akJ,则1molH2O(g)完全断键时共吸收
(4)已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,反应物的总键能

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】能量是人类生存基础,因此化学反应与能量关系一直是研究热点,贯穿于生活和生产各个领域 .
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为_______
(2)化学反应中放出的热能(焓变),△H与反应物和生成物的键能E有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=-185kJ/mol, E(H-H)=436kJ/mol,E(Cl-Cl)=243kJ/mol。
则E(H-Cl)=___________
(3)纳米级Cu2O由于具有优良的催化性能而受到关注,已知:
2Cu(s)+ O2(g)=CuO(s) △H=-169kJ.mol-1.
O2(g)=CuO(s) △H=-169kJ.mol-1.
C(s)+ O2(g)=CO(g) △H=-110.5kJ.mol-1
O2(g)=CO(g) △H=-110.5kJ.mol-1
2Cu(s)+O2(g)=2CuO(s) △H=-314kJ.mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu和CO的热化学方程__________
(4)如图是N2和H2反应生成2molNH3过程中能量变化示意图
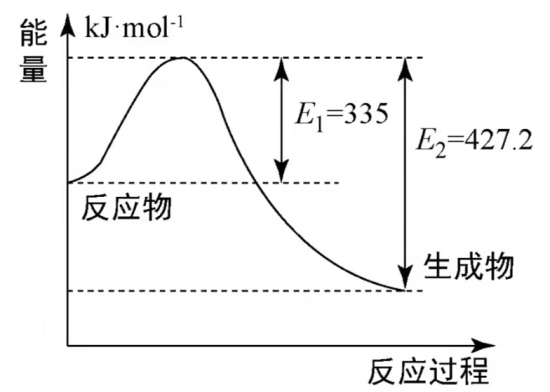
①请计算每生成1moNH3放出热量为___________
②若起始时向容器内放入1moN2和3molH2达平衡后N2的反应体积分数为20%,则反应放出的热量为Q1kJ,则Q1的数值为___________
(5)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是_______
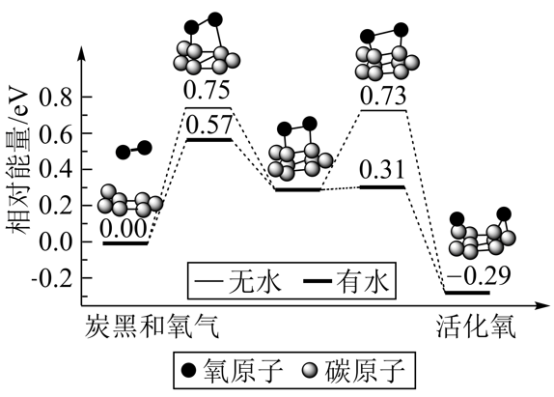
A.氧分子的活化包括O-O键的断裂与C-O键的生成
B.每活化一个氧分子放出0.29eV的能量
C.水可使氧分子活化反应的活化能降低0.42eV
D.炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为
(2)化学反应中放出的热能(焓变),△H与反应物和生成物的键能E有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=-185kJ/mol, E(H-H)=436kJ/mol,E(Cl-Cl)=243kJ/mol。
则E(H-Cl)=
(3)纳米级Cu2O由于具有优良的催化性能而受到关注,已知:
2Cu(s)+
 O2(g)=CuO(s) △H=-169kJ.mol-1.
O2(g)=CuO(s) △H=-169kJ.mol-1.C(s)+
 O2(g)=CO(g) △H=-110.5kJ.mol-1
O2(g)=CO(g) △H=-110.5kJ.mol-12Cu(s)+O2(g)=2CuO(s) △H=-314kJ.mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu和CO的热化学方程
(4)如图是N2和H2反应生成2molNH3过程中能量变化示意图

①请计算每生成1moNH3放出热量为
②若起始时向容器内放入1moN2和3molH2达平衡后N2的反应体积分数为20%,则反应放出的热量为Q1kJ,则Q1的数值为
(5)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是

A.氧分子的活化包括O-O键的断裂与C-O键的生成
B.每活化一个氧分子放出0.29eV的能量
C.水可使氧分子活化反应的活化能降低0.42eV
D.炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
您最近一年使用:0次