目前新能源技术被不断利用,高铁电池技术就是科研机构着力研究的一个方向。
(1)高铁酸钾—锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是___________ 。
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中性和酸性条件下不稳定。反应原理为:
Ⅰ.在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O
Ⅱ.Na2FeO4与KOH反应生成K2FeO4,主要的生产流程如下:
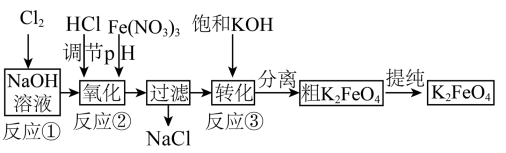
①写出反应①的离子方程式___________ 。
②请写出生产流程中“转化”(反应③)的化学方程式___________ 。
③该反应是在低温下进行的,说明此温度下Ksp(K2FeO4)___________ Ksp(Na2FeO4)(填“>”“<”或“=”)。
④“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用___________ 溶液。
a.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
(3)已知K2FeO4在水溶液中可以发生:4 +10H2O
+10H2O 4Fe(OH)3+8OH-+3O2↑,则K2FeO4可以在水处理中的作用是
4Fe(OH)3+8OH-+3O2↑,则K2FeO4可以在水处理中的作用是___________ 。
(4) 在水溶液中的存在形态图如图所示。
在水溶液中的存在形态图如图所示。
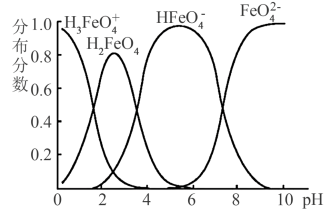
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO 的分布分数的变化情况是
的分布分数的变化情况是___________ 。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,___________ 转化为___________ 。(填化学式)
(1)高铁酸钾—锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中性和酸性条件下不稳定。反应原理为:
Ⅰ.在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O
Ⅱ.Na2FeO4与KOH反应生成K2FeO4,主要的生产流程如下:

①写出反应①的离子方程式
②请写出生产流程中“转化”(反应③)的化学方程式
③该反应是在低温下进行的,说明此温度下Ksp(K2FeO4)
④“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
a.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
(3)已知K2FeO4在水溶液中可以发生:4
 +10H2O
+10H2O 4Fe(OH)3+8OH-+3O2↑,则K2FeO4可以在水处理中的作用是
4Fe(OH)3+8OH-+3O2↑,则K2FeO4可以在水处理中的作用是(4)
 在水溶液中的存在形态图如图所示。
在水溶液中的存在形态图如图所示。
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO
 的分布分数的变化情况是
的分布分数的变化情况是②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,
更新时间:2021-11-03 18:26:35
|
相似题推荐
填空题
|
适中
(0.64)
【推荐1】在反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O中,氧化剂___________ (填化学式,下同),氧化产物___________ ,氧化产物与还原产物物质的量之比___________ ,被氧化与未被氧化的HCl的质量之比为___________ ,若有7.3gHCl被氧化,转移的电子数为___________ mol。
您最近一年使用:0次
【推荐2】(1)实验室可以利用高锰酸钾和浓盐酸制备氯气,请写出该反应的化学方程式并用“双线桥法”表示反应中电子转移的方向和数目:______
(2)饮用水中的NO 对人类健康会产生危害,为了降低饮用水中NO
对人类健康会产生危害,为了降低饮用水中NO 的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO
的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO 还原为N2,请配平以下方程式: Al+ NO
还原为N2,请配平以下方程式: Al+ NO + = AIO
+ = AIO + N2↑+ 。
+ N2↑+ 。_______ ,若反应过程中转移5mole-,则生成标准状况下N2的体积为______ L。
(3)①147g H2SO4含有H2SO4分子个数____ 与____ mol HNO3所含氧原子数相等。
②同温、同压下等质量的SO2和CO,它们所占的体积比为_____ 所含氧元素的物质的量之比为________ ;
③2molO2与1molO3的摩尔质量之比是________ 。
(2)饮用水中的NO
 对人类健康会产生危害,为了降低饮用水中NO
对人类健康会产生危害,为了降低饮用水中NO 的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO
的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO 还原为N2,请配平以下方程式: Al+ NO
还原为N2,请配平以下方程式: Al+ NO + = AIO
+ = AIO + N2↑+ 。
+ N2↑+ 。(3)①147g H2SO4含有H2SO4分子个数
②同温、同压下等质量的SO2和CO,它们所占的体积比为
③2molO2与1molO3的摩尔质量之比是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】水合肼(N2H4·H2O)又称水合联氨,其纯净物为无色透明的油状液体,具有强碱性和吸湿性。将水合肼通入CuO胶体中,可发生如图所示的转化。
(1)图示的转化中,②属于_____________ (填“非氧化还原反应”或“氧化还原反应”)。
(2)转化①中,氧化剂与还原剂的物质的量之比为4: l ,则X的化学式为_____ 。
(3)转化②中,反应一段时间后,溶液中n(OH-)____________ (填“增大”“ 减小” 或“不变”)。
(4)若①中参加反应的CuO物质的量为0.4mol,按图示转化过程进行后,④中生成的CuO物质的量也等于0.4mol,则③中参加反应的O2的物质的量与④中今加反应的NaClO的物质的量之比为_________ 。

(1)图示的转化中,②属于
(2)转化①中,氧化剂与还原剂的物质的量之比为4: l ,则X的化学式为
(3)转化②中,反应一段时间后,溶液中n(OH-)
(4)若①中参加反应的CuO物质的量为0.4mol,按图示转化过程进行后,④中生成的CuO物质的量也等于0.4mol,则③中参加反应的O2的物质的量与④中今加反应的NaClO的物质的量之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】阅读下面两条科普信息,回答问题:
(1)一个体重50kg的健康人含铁2g,这2g铁在人体中不是以单质金属的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(2)在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物甲醛(甲醛化学式:CH2O)。
这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。
这说明亚铁离子具有______________ 性,铁离子具有________________ 性,(1)中的维生素C是__________ 剂,(2)中的CO2 是__________ 剂,写出(2)中的离子方程式___________
(1)一个体重50kg的健康人含铁2g,这2g铁在人体中不是以单质金属的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(2)在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物甲醛(甲醛化学式:CH2O)。
这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。
这说明亚铁离子具有
您最近一年使用:0次
【推荐2】I.已知铜在常温下能被稀HNO3溶解,反应为:3Cu+8HNO3=3Cu(NO3)2+2NO↑十4H2O。
(1)请将上述反应改写成离子方程式________________________ 。
(2)上述反应中,氧化剂是___________ (填化学式),氧化产物是___________ (填化学式)。
(3)用双线桥法 标出该反应的电子转移情况。
(4)若反应中转移了6mol电子,则生成的NO气体的体积在标准状况下为___________ L 。
II. 某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是_________________ 。
(2)该反应中,发生还原反应的过程是________ →__________ 。(从上述五种物质中选取两种)
(3)根据上述反应可推知_________________ (填字母)
a. 氧化性:Cr(OH)3> H2CrO4 b. 氧化性:H2CrO4>O2
c. 还原性:H2O>H2O2 d. 还原性:H2O2>Cr(OH)3
(1)请将上述反应改写成离子方程式
(2)上述反应中,氧化剂是
(3)用
(4)若反应中转移了6mol电子,则生成的NO气体的体积在标准状况下为
II. 某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是
(2)该反应中,发生还原反应的过程是
(3)根据上述反应可推知
a. 氧化性:Cr(OH)3> H2CrO4 b. 氧化性:H2CrO4>O2
c. 还原性:H2O>H2O2 d. 还原性:H2O2>Cr(OH)3
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】海水提溴过程中溴元素的变化如下图所示:
(2)过程II中,用热空气将溴赶出,再用浓 (aq)吸收。将该过程中反应的化学方程式补充完整,并用单线桥标出电子转移的方向和数目。
(aq)吸收。将该过程中反应的化学方程式补充完整,并用单线桥标出电子转移的方向和数目。___________

向盛有KI(aq)的试管中加入少许 后滴加氯水,振荡、静置后,
后滴加氯水,振荡、静置后, 层变成紫色,如果继续向试管中滴加氯水,振荡,
层变成紫色,如果继续向试管中滴加氯水,振荡, 层会逐渐变浅,最后变成无色。
层会逐渐变浅,最后变成无色。
(3)写出 层由紫色变成无色(生成
层由紫色变成无色(生成 )的化学方程式:
)的化学方程式:___________ 。
(4)整个过程两步反应的还原剂分别是:第一步___________ 、第二步___________ 。
(5)把KI换成KBr,则 层变为
层变为___________ 色,继续滴加氯水, 层的颜色没有变化。向用硫酸酸化的NaI(aq)中逐滴加入
层的颜色没有变化。向用硫酸酸化的NaI(aq)中逐滴加入 (aq),当加入2.6mol
(aq),当加入2.6mol  时,测得反应后溶液中溴和碘的存在形式及物质的量(n)如下表。则原溶液中NaI的物质的量是
时,测得反应后溶液中溴和碘的存在形式及物质的量(n)如下表。则原溶液中NaI的物质的量是___________ mol。
 、
、 、
、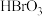 氧化性由强到弱的顺序合理的是
氧化性由强到弱的顺序合理的是___________ 。
A.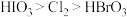 B.
B.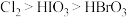
C. D.
D.

A. | B.HCl | C. | D. |
(2)过程II中,用热空气将溴赶出,再用浓
 (aq)吸收。将该过程中反应的化学方程式补充完整,并用单线桥标出电子转移的方向和数目。
(aq)吸收。将该过程中反应的化学方程式补充完整,并用单线桥标出电子转移的方向和数目。
向盛有KI(aq)的试管中加入少许
 后滴加氯水,振荡、静置后,
后滴加氯水,振荡、静置后, 层变成紫色,如果继续向试管中滴加氯水,振荡,
层变成紫色,如果继续向试管中滴加氯水,振荡, 层会逐渐变浅,最后变成无色。
层会逐渐变浅,最后变成无色。(3)写出
 层由紫色变成无色(生成
层由紫色变成无色(生成 )的化学方程式:
)的化学方程式:(4)整个过程两步反应的还原剂分别是:第一步
(5)把KI换成KBr,则
 层变为
层变为 层的颜色没有变化。向用硫酸酸化的NaI(aq)中逐滴加入
层的颜色没有变化。向用硫酸酸化的NaI(aq)中逐滴加入 (aq),当加入2.6mol
(aq),当加入2.6mol  时,测得反应后溶液中溴和碘的存在形式及物质的量(n)如下表。则原溶液中NaI的物质的量是
时,测得反应后溶液中溴和碘的存在形式及物质的量(n)如下表。则原溶液中NaI的物质的量是| 粒子 |  |  | 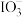 |
| n/mol | 0.5 | 1.3 | 未知 |
 、
、 、
、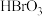 氧化性由强到弱的顺序合理的是
氧化性由强到弱的顺序合理的是A.
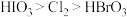 B.
B.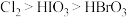
C.
 D.
D.
您最近一年使用:0次



