向Cr2(SO4)3的水溶液中加入NaOH溶液,当pH =4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多;但当pH>13时,沉淀消失,出现亮绿色的亚铬酸根离子( )。其平衡关系如下:
)。其平衡关系如下:
Cr3++3OH- Cr(OH)3
Cr(OH)3
 + H+ + H2O
+ H+ + H2O
(紫色) (灰绿色) (亮绿色)
向0. 05mol·L-1 Cr2(SO4)3溶液50mL中,加入1.0mol·L-1NaOH溶液50mL,充分反应后,溶液中可观察到的现象是 (lg2=0.3)
 )。其平衡关系如下:
)。其平衡关系如下:Cr3++3OH-
 Cr(OH)3
Cr(OH)3
 + H+ + H2O
+ H+ + H2O(紫色) (灰绿色) (亮绿色)
向0. 05mol·L-1 Cr2(SO4)3溶液50mL中,加入1.0mol·L-1NaOH溶液50mL,充分反应后,溶液中可观察到的现象是 (lg2=0.3)
| A.溶液为紫色 | B.溶液中有灰绿色沉淀 |
| C.溶液为亮绿色 | D.无法判断 |
9-10高二下·浙江宁波·期中 查看更多[7]
天津市部分区2022-2023学年高二上学期期中练习化学试题内蒙古鄂尔多斯市第一中学2021-2022学年高二上学期第一次月考化学试题第28届(2014年)全国高中生化学竞赛河南省预赛试题人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 章末综合检测卷(已下线)2010年浙江省慈溪中学高二第二学期期中考试(普通班)化学试题(已下线)2012-2013学年福建省罗源县第一中学高二第二次月考化学试卷(已下线)2012-2013学年河北省衡水中学高二第一次调研考试化学试卷
更新时间:2016-12-09 03:59:49
|
【知识点】 酸碱中和滴定原理的应用解读
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】滴定分数是指滴定过程中标准溶液与待测溶液中溶质的物质的量之比。用0.10 mol·L-1 NaOH溶液滴定0.10 mol·L1 H2C2O4(草酸)溶液的滴定曲线如图所示。下列说法不正确的是
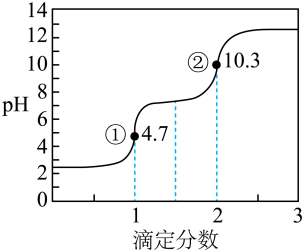

| A.H2C2O4属于二元弱酸 |
| B.若用NaOH标准溶液滴定NaHC2O4溶液,可用酚酞作指示剂 |
| C.图中①处:c(H2C2O4)+c(H+)=c(OH-) |
| D.图中②处:c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+) |
您最近半年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】298K时用0.05mol·L-1氨水滴定20mL0.05mol·L-1的叠氮酸(HN3)溶液,滴定过程中混合溶液的电阻率变化情况如图所示,已知NH3·H2O的电离常数Kb=1.7×10-5,HN3的电离常数Ka=1.9×10-5.下列说法中错误的是


| A.电阻率与离子浓度和离子所带电荷有关 |
| B.a、b、c、d四点中,水的电离程度最大的是c |
| C.c~d之间可能存在:c(N3-)=c(NH4+)>c(H+)=c(OH-) |
| D.若用0.05mol·L-1HN3溶液滴定20mL0.05mol·L-1氨水,则所得曲线完全相同 |
您最近半年使用:0次

 )样品的纯度(杂质不反应);称取
)样品的纯度(杂质不反应);称取 g胆矾样品溶于蒸馏水,加入足量KI溶液,充分反应后,过滤把滤液配制成250mL溶液,准确量取配制液25.00mL,于锥形瓶中,滴加2滴溶液X,用c
g胆矾样品溶于蒸馏水,加入足量KI溶液,充分反应后,过滤把滤液配制成250mL溶液,准确量取配制液25.00mL,于锥形瓶中,滴加2滴溶液X,用c 
 溶液滴定至终点,消耗滴定液V mL。已知:
溶液滴定至终点,消耗滴定液V mL。已知: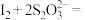
 。下列叙述错误的是
。下列叙述错误的是



