二氧化氯(ClO2)是一种绿色消毒剂,常温常压下为黄绿色气体,易溶于水。常见的化学合成方法有氧化法和还原法。
(1)过硫酸盐氧化法:用原料亚氯酸钠(NaClO2)和过硫酸钠(Na2S2O8)直接反应,操作简单,同时可得到副产品Na2SO4。
制备时发生反应的离子方程式为___________ 。
(2)盐酸还原法:此法制得的二氧化氯消毒液中常含有ClO2和Cl2两种主要成分。为测定某二氧化氯消毒液中ClO2的浓度,进行如下实验:
量取5.00mL二氧化氯消毒液于锥形瓶中,加蒸馏水稀释到25.00mL,再向其中加入过量KI溶液,充分振荡;用0.10mol/LNa2S2O3标准溶液滴定至浅黄色后,加入指示剂,继续滴定至终点,消耗Na2S2O3标准溶液5.50mL;加入稀H2SO4调节溶液pH=3,再用0.10mol/LNa2S2O3标准溶液滴定,滴至浅黄色时加入指示剂,继续滴定至终点,第二次滴定消耗Na2S2O3溶液20.00mL。
已知:2ClO2+2KI=2KClO2+I2
KClO2+4KI+2H2SO4=KCl+2K2SO4+2I2+2H2O
2Na2S2O3+I2=Na2S4O6+2NaI
计算该二氧化氯消毒液中ClO2的物质的量浓度___________ 。(写出计算过程)
(1)过硫酸盐氧化法:用原料亚氯酸钠(NaClO2)和过硫酸钠(Na2S2O8)直接反应,操作简单,同时可得到副产品Na2SO4。
制备时发生反应的离子方程式为
(2)盐酸还原法:此法制得的二氧化氯消毒液中常含有ClO2和Cl2两种主要成分。为测定某二氧化氯消毒液中ClO2的浓度,进行如下实验:
量取5.00mL二氧化氯消毒液于锥形瓶中,加蒸馏水稀释到25.00mL,再向其中加入过量KI溶液,充分振荡;用0.10mol/LNa2S2O3标准溶液滴定至浅黄色后,加入指示剂,继续滴定至终点,消耗Na2S2O3标准溶液5.50mL;加入稀H2SO4调节溶液pH=3,再用0.10mol/LNa2S2O3标准溶液滴定,滴至浅黄色时加入指示剂,继续滴定至终点,第二次滴定消耗Na2S2O3溶液20.00mL。
已知:2ClO2+2KI=2KClO2+I2
KClO2+4KI+2H2SO4=KCl+2K2SO4+2I2+2H2O
2Na2S2O3+I2=Na2S4O6+2NaI
计算该二氧化氯消毒液中ClO2的物质的量浓度
21-22高二·全国·课时练习 查看更多[2]
(已下线)3.2.3 酸碱中和滴定-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)专题22 酸碱中和滴定原理的拓展应用-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
更新时间:2021-12-07 15:12:32
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】某实验小组测定产品中水合肼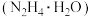 的含量,步骤如下:称取产品
的含量,步骤如下:称取产品 ,加入适量
,加入适量 固体(滴定过程中,调节溶液的
固体(滴定过程中,调节溶液的 保持在6.5左右),加水配成
保持在6.5左右),加水配成 溶液,移取
溶液,移取 置于锥形瓶中,并滴加2~3滴淀粉溶液,用
置于锥形瓶中,并滴加2~3滴淀粉溶液,用 的碘标准溶液滴定(已知:
的碘标准溶液滴定(已知: )。实验测得消耗碘标准溶液的平均值为
)。实验测得消耗碘标准溶液的平均值为 ,产品中水合肼的质量分数为
,产品中水合肼的质量分数为_______ 。
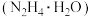 的含量,步骤如下:称取产品
的含量,步骤如下:称取产品 ,加入适量
,加入适量 固体(滴定过程中,调节溶液的
固体(滴定过程中,调节溶液的 保持在6.5左右),加水配成
保持在6.5左右),加水配成 溶液,移取
溶液,移取 置于锥形瓶中,并滴加2~3滴淀粉溶液,用
置于锥形瓶中,并滴加2~3滴淀粉溶液,用 的碘标准溶液滴定(已知:
的碘标准溶液滴定(已知: )。实验测得消耗碘标准溶液的平均值为
)。实验测得消耗碘标准溶液的平均值为 ,产品中水合肼的质量分数为
,产品中水合肼的质量分数为
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】已知:ClNO与H2O反应生成HNO2和HCl。通过以下实验测定ClNO样品的纯度。取m g ClNO样品溶于水,配制成250 mL溶液;取出25.00 mL样品于锥形瓶中,以K2CrO4溶液作为指示剂,用c mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00 mL。达到滴定终点的现象是___________ ,亚硝酰氯(ClNO)的质量分数为___________ 。[已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=3.5×10-11]
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】取27.4 g 由 Na2CO3和NaHCO3组成的固体混合物,加热至质量不再减少,冷却后称得剩余固体质量为21.2 g;再将该剩余固体加入到 500 mL足量稀盐酸中,充分反应。(忽略溶液体积变化)
(1)加热时,生成H2O的质量是___________ g。
(2)原混合物中Na2CO3的物质的量是___________ mol。
(3)所得溶液中Na+的物质的量浓度是___________ mol/L。
(4)整个过程中,生成CO2的总体积是___________ L(标准状况)。
(1)加热时,生成H2O的质量是
(2)原混合物中Na2CO3的物质的量是
(3)所得溶液中Na+的物质的量浓度是
(4)整个过程中,生成CO2的总体积是
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】测定CrCl3产品的纯度,实验如下:
①取mg CrCl3产品,在强碱性条件下,加入过量30%H2O2溶液,小火加热使CrCl3完全转化为CrO ,继续加热一段时间;
,继续加热一段时间;
②冷却后,滴入适量的稀硫酸和浓磷酸,使CrO 转化为Cr2O
转化为Cr2O ,加适量的蒸馏水配成250.00mL溶液;
,加适量的蒸馏水配成250.00mL溶液;
③取25.00mL溶液,用新配制的 的NH4)2Fe(SO4)2标准溶液滴定至终点,重复3次,平均消耗NH4)2Fe(SO4)2标准溶液VmL(已知Cr2O
的NH4)2Fe(SO4)2标准溶液滴定至终点,重复3次,平均消耗NH4)2Fe(SO4)2标准溶液VmL(已知Cr2O 被
被 还原为Cr3+)。
还原为Cr3+)。
则样品中CrCl3 (摩尔质量为M g·molˉ1)的质量分数为___________ %;若步骤③中所用标准溶液已变质,将导致CrCl3质量分数测定值___________ (填“偏高”、“偏低”或“无影响”)。
①取mg CrCl3产品,在强碱性条件下,加入过量30%H2O2溶液,小火加热使CrCl3完全转化为CrO
 ,继续加热一段时间;
,继续加热一段时间;②冷却后,滴入适量的稀硫酸和浓磷酸,使CrO
 转化为Cr2O
转化为Cr2O ,加适量的蒸馏水配成250.00mL溶液;
,加适量的蒸馏水配成250.00mL溶液;③取25.00mL溶液,用新配制的
 的NH4)2Fe(SO4)2标准溶液滴定至终点,重复3次,平均消耗NH4)2Fe(SO4)2标准溶液VmL(已知Cr2O
的NH4)2Fe(SO4)2标准溶液滴定至终点,重复3次,平均消耗NH4)2Fe(SO4)2标准溶液VmL(已知Cr2O 被
被 还原为Cr3+)。
还原为Cr3+)。则样品中CrCl3 (摩尔质量为M g·molˉ1)的质量分数为
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】实验室利用四氯化钛气相氧化法制备二氧化钛。
测定产品中TiO2 (产品中其他杂质不发生下述化学反应)的纯度的方法是:精确称取0.2000g产品放入锥形瓶中,加入热的硫酸和硫酸铵的混合溶液,使其溶解。冷却,稀释,得到含TiO2+的溶液。加入金属铝,将TiO2+全部转化为Ti3+加入指示剂,用0.1000mol·L-1NH4Fe(SO4)2溶液滴定至终点。重复操作3次,平均消耗0.1000mol·L-1NH4Fe(SO4)2溶液20.00mL(已知:Ti3++ Fe 3++H2O=TiO2++Fe2++2H+)
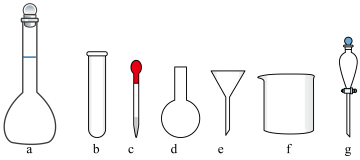
(1)配制NH4Fe(SO4)2标准溶液时,需使用的仪器除玻璃棒、托盘天平、药匙、量筒外,还需要下图中的___________ (填标号)。
(2)滴定时用到的指示剂为___________ ,实验所得产品的纯度为___________ 。(保留两位有效数字)
测定产品中TiO2 (产品中其他杂质不发生下述化学反应)的纯度的方法是:精确称取0.2000g产品放入锥形瓶中,加入热的硫酸和硫酸铵的混合溶液,使其溶解。冷却,稀释,得到含TiO2+的溶液。加入金属铝,将TiO2+全部转化为Ti3+加入指示剂,用0.1000mol·L-1NH4Fe(SO4)2溶液滴定至终点。重复操作3次,平均消耗0.1000mol·L-1NH4Fe(SO4)2溶液20.00mL(已知:Ti3++ Fe 3++H2O=TiO2++Fe2++2H+)
(1)配制NH4Fe(SO4)2标准溶液时,需使用的仪器除玻璃棒、托盘天平、药匙、量筒外,还需要下图中的

(2)滴定时用到的指示剂为
您最近一年使用:0次

 产品中
产品中 元素含量,实验步骤如下:
元素含量,实验步骤如下: 产品于锥形瓶中,加入足量
产品于锥形瓶中,加入足量 溶液,再加稀硝酸至酸性;
溶液,再加稀硝酸至酸性; 的
的 溶液
溶液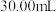 ,使
,使 完全沉淀;
完全沉淀;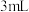 硝基苯,用力摇动,其目的是
硝基苯,用力摇动,其目的是 溶液滴定过量
溶液滴定过量 至终点,记下所用体积
至终点,记下所用体积 。
。 是白色沉淀,
是白色沉淀,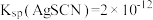 。
。



