无水FeCl2是重要的污水处理剂,不溶于C6H5Cl、C6H4Cl2,易溶于乙醇,易吸水和易被氧化。某实验小组利用无水FeCl3和C6H5Cl(氯苯,无色液体,沸点132℃)制备少量无水FeCl2。实验原理:2FeCl3+C6H5Cl 2FeCl2+C6H4Cl2+HCl↑,回答以下问题:
2FeCl2+C6H4Cl2+HCl↑,回答以下问题:
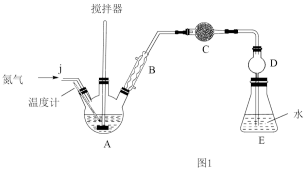
(1)先按图1所示组装好装置,再___________ 后,最后向三颈烧瓶A中加入一定量的无水FeCl3和氯苯(加热装置略去)。
(2)工业氮气中常含有H2O、O2、CO2,需用下图仪器和试剂提纯后才可通入三颈烧瓶A中进行相关反应。
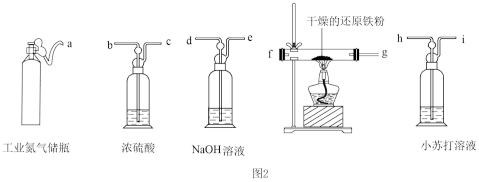
①请从图2中选择必要的装置,按气流方向其合理的连接顺序:a→___________ →j。
②在反应开始之前先通二段时间N2的目的是___________ 。
(3)装置C中的试剂是___________ (填试剂名称),其作用是___________ 。
(4)控制温度在128~139℃条件下对三颈烧瓶A加热2h,混合物颜色逐渐变浅,黏度降低。该步骤中加热温度已经接近或超过C6H5Cl沸点,但氯苯实际损失量却非常小,其原因是___________ 。
(5)下列装置中与D的作用相同的是___________ 。
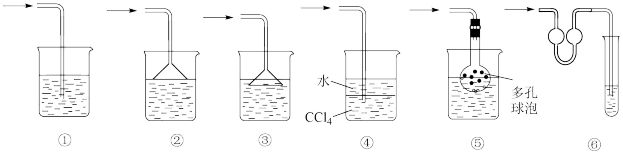
(6)冷却后,将三颈瓶内物质经过滤、洗涤干燥后,得到粗产品。简述回收滤液中C6H5Cl的实验方案___________ 。
 2FeCl2+C6H4Cl2+HCl↑,回答以下问题:
2FeCl2+C6H4Cl2+HCl↑,回答以下问题:
(1)先按图1所示组装好装置,再
(2)工业氮气中常含有H2O、O2、CO2,需用下图仪器和试剂提纯后才可通入三颈烧瓶A中进行相关反应。

①请从图2中选择必要的装置,按气流方向其合理的连接顺序:a→
②在反应开始之前先通二段时间N2的目的是
(3)装置C中的试剂是
(4)控制温度在128~139℃条件下对三颈烧瓶A加热2h,混合物颜色逐渐变浅,黏度降低。该步骤中加热温度已经接近或超过C6H5Cl沸点,但氯苯实际损失量却非常小,其原因是
(5)下列装置中与D的作用相同的是

(6)冷却后,将三颈瓶内物质经过滤、洗涤干燥后,得到粗产品。简述回收滤液中C6H5Cl的实验方案
更新时间:2022-01-14 10:42:57
|
相似题推荐
解答题-有机推断题
|
适中
(0.65)
【推荐1】已知A是石油化工发展水平的重要标志,常在汽油中加入适量B作为汽车燃料,可以节约石油资源,并减少汽车尾气对空气的污染。根据下面的转化关系回答下列问题:
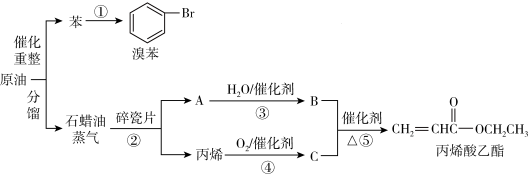
(1)已知溴苯是重要的医药中间体,反应①的反应类型为___________ 。
(2)A的结构简式为___________ ,C中含有官能团的名称为___________ 、___________ 。
(3)鉴别苯和丙烯酸乙酯,可选用的试剂是___________ 。
(4)已知丙烯酸乙酯(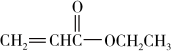 )具有刺鼻的辛辣气味,可用作制造涂料黏合剂、纺织助剂等。某实验小组用以下装置制备丙烯酸乙酯:
)具有刺鼻的辛辣气味,可用作制造涂料黏合剂、纺织助剂等。某实验小组用以下装置制备丙烯酸乙酯:
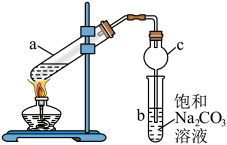
①球形干燥管c除起冷凝作用外,它的另一重要作用是___________ 。
②分离试管b中的液体混合物,采用的方法为___________ 。
③B+C生成丙烯酸乙酯的原理类似于乙醇和乙酸反应生成乙酸乙酯,请写出反应⑤的化学方程式___________ 。

(1)已知溴苯是重要的医药中间体,反应①的反应类型为
(2)A的结构简式为
(3)鉴别苯和丙烯酸乙酯,可选用的试剂是
(4)已知丙烯酸乙酯(
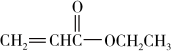 )具有刺鼻的辛辣气味,可用作制造涂料黏合剂、纺织助剂等。某实验小组用以下装置制备丙烯酸乙酯:
)具有刺鼻的辛辣气味,可用作制造涂料黏合剂、纺织助剂等。某实验小组用以下装置制备丙烯酸乙酯:
①球形干燥管c除起冷凝作用外,它的另一重要作用是
②分离试管b中的液体混合物,采用的方法为
③B+C生成丙烯酸乙酯的原理类似于乙醇和乙酸反应生成乙酸乙酯,请写出反应⑤的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图及有关数据如下:

实验步骤:
用如图所示装置制取乙酸异戊酯。首先在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片,然后缓慢加热A,回流50分钟,待反应液冷却至室温后,倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃的馏分,得乙酸异戊酯3.9g。

回答下列问题:
(1)仪器B的名称是____________ 。
(2)在洗涤操作中,第一次水洗的主要目的是_____________ ;第二次水洗的主要目的是 _____________ 。
(3)本实验中加入过量乙酸的目的是________________________ 。
(4)实验中加入少量无水硫酸镁的目的是________________________ 。
(5)在蒸馏操作中,仪器选择及安装都正确的是____________ (填标号)。
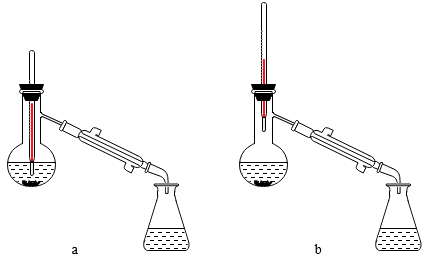
(6)本实验中乙酸异戊酯的产率是____________ (填标号)。
a.30% b.40% c.50% d.60%
(7)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏____________ (填“高”或者“低”),原因是 ________________________ 。

相对分子质量 | 密度/( | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
用如图所示装置制取乙酸异戊酯。首先在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片,然后缓慢加热A,回流50分钟,待反应液冷却至室温后,倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃的馏分,得乙酸异戊酯3.9g。

回答下列问题:
(1)仪器B的名称是
(2)在洗涤操作中,第一次水洗的主要目的是
(3)本实验中加入过量乙酸的目的是
(4)实验中加入少量无水硫酸镁的目的是
(5)在蒸馏操作中,仪器选择及安装都正确的是


(6)本实验中乙酸异戊酯的产率是
a.30% b.40% c.50% d.60%
(7)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
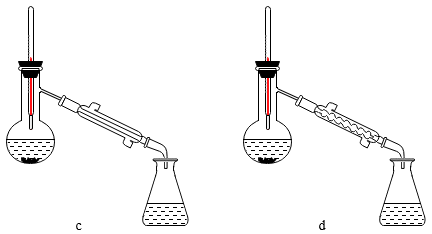
【推荐3】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,不溶于水,易溶于醇等有机溶剂。实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH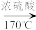 CH2=CH2↑+H2O、CH2=CH2+Br2→BrCH2CH2Br
CH2=CH2↑+H2O、CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚:2CH3CH2OH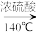 CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,

现用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
有关数据列表如下:
回答下列问题:
(1)a仪器的名称是___________ ,在此制备实验中,A中按最佳体积比3﹕1加入乙醇与浓硫酸后,A中还要加入几粒碎瓷片,其作用是___________ ,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ___________ 。
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是___________ 。
(3)在装置C中应加入NaOH溶液,其目的是___________ 。
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法___________ 。
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置分层、分液后,若产物中有少量未反应的Br2,最好用___________ 洗涤除去;若产物中有少量副产物乙醚,可用___________ (填操作方法名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是___________ 。
(7)若实验结束后得到9.4g产品,1,2-二溴乙烷的产率为___________ (保留一位小数)。
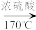 CH2=CH2↑+H2O、CH2=CH2+Br2→BrCH2CH2Br
CH2=CH2↑+H2O、CH2=CH2+Br2→BrCH2CH2Br已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚:2CH3CH2OH
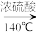 CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,

现用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
有关数据列表如下:
| 类别 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)a仪器的名称是
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是
(3)在装置C中应加入NaOH溶液,其目的是
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置分层、分液后,若产物中有少量未反应的Br2,最好用
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是
(7)若实验结束后得到9.4g产品,1,2-二溴乙烷的产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某中学化学兴趣小组利用如下实验装置(部分加热装置已省略)探究 与
与 的反应及
的反应及 的某些性质。据此回答相关问题:
的某些性质。据此回答相关问题:
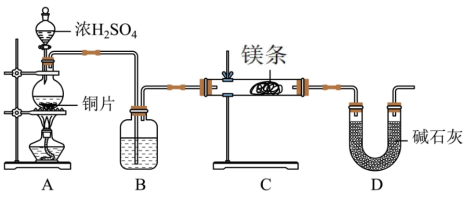
(1)A中盛装铜片的仪器名称为______ ,A装置中产生的 可能混有少量的
可能混有少量的 ,B装置中的试剂可以是
,B装置中的试剂可以是______ 。(填写序号)
a. 溶液 b.浓硫酸 c.饱和
溶液 b.浓硫酸 c.饱和 溶液
溶液
(2)类比分析、模型认知与证据推理是中学化学学习的重要方法之一。从物质分类上分析, 和
和 都是酸性氧化物,从化合价态角度分析,
都是酸性氧化物,从化合价态角度分析, 和
和 都具有
都具有______ ,(填具体的化学性质)。
(3)实验小组查阅相关资料整理出硫及其部分化合物的性质:①S单质难溶于水、非氧化性的酸溶液,微溶于酒精、易溶于 ;②
;② 在冷水中易水解生成
在冷水中易水解生成 、
、 、热水中易水解生成
、热水中易水解生成 、
、 ;③
;③ 是一种具有特殊臭味的气体。
是一种具有特殊臭味的气体。
实验1:取少量装置 的剩余固体样品加入稀盐酸,样品部分溶解,有黄色固体剩余,并伴有刺激性气味气体产生。
的剩余固体样品加入稀盐酸,样品部分溶解,有黄色固体剩余,并伴有刺激性气味气体产生。
实验小组结合实验1现象,认为剩余固体中一定有 单质、
单质、 和
和 ,
, 产生的原因点燃是:
产生的原因点燃是: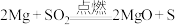 ;
;_______________________ (用化学方程式表示)。并对实验1产生气体的组成提出以下猜想:
猜想1:气体为
猜想2:气体为
猜想3:气体为 、
、 的混合气体
的混合气体
写出实验1中产生刺激性气味气体的化学方程式______ ;由实验1现象可知______ 不成立(填“猜想1”、或“猜想2”、或“猜想3”);
实验2:取少量装置 的剩余固体样品加入热水溶解、过滤,并往洗涤过后的滤渣加入足量稀盐酸,无气泡产生。由实验2现象可知
的剩余固体样品加入热水溶解、过滤,并往洗涤过后的滤渣加入足量稀盐酸,无气泡产生。由实验2现象可知______ 不成立(填“猜想1”、或“猜想2”、或“猜想3”)。
 与
与 的反应及
的反应及 的某些性质。据此回答相关问题:
的某些性质。据此回答相关问题:
(1)A中盛装铜片的仪器名称为
 可能混有少量的
可能混有少量的 ,B装置中的试剂可以是
,B装置中的试剂可以是a.
 溶液 b.浓硫酸 c.饱和
溶液 b.浓硫酸 c.饱和 溶液
溶液(2)类比分析、模型认知与证据推理是中学化学学习的重要方法之一。从物质分类上分析,
 和
和 都是酸性氧化物,从化合价态角度分析,
都是酸性氧化物,从化合价态角度分析, 和
和 都具有
都具有(3)实验小组查阅相关资料整理出硫及其部分化合物的性质:①S单质难溶于水、非氧化性的酸溶液,微溶于酒精、易溶于
 ;②
;② 在冷水中易水解生成
在冷水中易水解生成 、
、 、热水中易水解生成
、热水中易水解生成 、
、 ;③
;③ 是一种具有特殊臭味的气体。
是一种具有特殊臭味的气体。实验1:取少量装置
 的剩余固体样品加入稀盐酸,样品部分溶解,有黄色固体剩余,并伴有刺激性气味气体产生。
的剩余固体样品加入稀盐酸,样品部分溶解,有黄色固体剩余,并伴有刺激性气味气体产生。实验小组结合实验1现象,认为剩余固体中一定有
 单质、
单质、 和
和 ,
, 产生的原因点燃是:
产生的原因点燃是: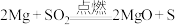 ;
;猜想1:气体为

猜想2:气体为

猜想3:气体为
 、
、 的混合气体
的混合气体写出实验1中产生刺激性气味气体的化学方程式
实验2:取少量装置
 的剩余固体样品加入热水溶解、过滤,并往洗涤过后的滤渣加入足量稀盐酸,无气泡产生。由实验2现象可知
的剩余固体样品加入热水溶解、过滤,并往洗涤过后的滤渣加入足量稀盐酸,无气泡产生。由实验2现象可知
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O)
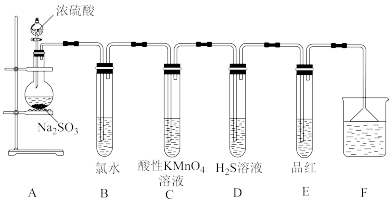
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是___________ 。
(2)反应后,装置B中发生反应的离子方程式为___________ ,装置C中的现象是___________ ,表现了SO2的___________ ;装置D中现象是___________ ,发生反应的化学方程式为___________ 。
(3)F装置的作用是___________ ,漏斗的作用是___________ 。
(4)将足量的SO2通入BaCl2溶液中,下列说法正确的是___________ (填标号)。
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入Cl2或NH3,则溶液中均会出现白色沉淀
(5)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象___________ 。

请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是
(2)反应后,装置B中发生反应的离子方程式为
(3)F装置的作用是
(4)将足量的SO2通入BaCl2溶液中,下列说法正确的是
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入Cl2或NH3,则溶液中均会出现白色沉淀
(5)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某学习小组设计实验验证 能与
能与 反应,实验装置如图。
反应,实验装置如图。
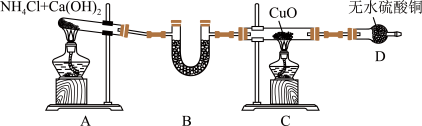
(1)装置D的仪器名称是___________ 。
(2)装置A试管中发生反应的化学方程式为___________ 。
(3)装置B的作用是干燥 ,可选择的试剂是___________(填字母)。
,可选择的试剂是___________(填字母)。
(4)实验中装置C的试管中有红色单质生成,还能收集到一种气体单质,且D装置中无水硫酸铜变蓝。则该反应说明 具有
具有___________ (填“氧化性”或“还原性”),氧化剂和还原剂的物质的量之比为___________ 。
(5)已知 难溶于
难溶于 。下列能用来吸收该实验尾气的装置是
。下列能用来吸收该实验尾气的装置是___________ (填字母)。
A.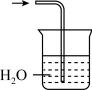 B.
B.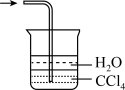 C.
C.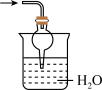
(6) 与
与 的反应受
的反应受 的用量和反应温度影响,有时会生成副产物
的用量和反应温度影响,有时会生成副产物 (砖红色固体),易对实验结论产生干扰。已知
(砖红色固体),易对实验结论产生干扰。已知 在酸性溶液中不稳定:
在酸性溶液中不稳定: 。请设计实验方案验证
。请设计实验方案验证 完全反应后的红色固体产物中是否含有
完全反应后的红色固体产物中是否含有 :
:___________ 。
 能与
能与 反应,实验装置如图。
反应,实验装置如图。
(1)装置D的仪器名称是
(2)装置A试管中发生反应的化学方程式为
(3)装置B的作用是干燥
 ,可选择的试剂是___________(填字母)。
,可选择的试剂是___________(填字母)。| A.浓硫酸 | B.碱石灰 | C. 固体 固体 | D.无水 固体 固体 |
 具有
具有(5)已知
 难溶于
难溶于 。下列能用来吸收该实验尾气的装置是
。下列能用来吸收该实验尾气的装置是A.
 B.
B. C.
C.
(6)
 与
与 的反应受
的反应受 的用量和反应温度影响,有时会生成副产物
的用量和反应温度影响,有时会生成副产物 (砖红色固体),易对实验结论产生干扰。已知
(砖红色固体),易对实验结论产生干扰。已知 在酸性溶液中不稳定:
在酸性溶液中不稳定: 。请设计实验方案验证
。请设计实验方案验证 完全反应后的红色固体产物中是否含有
完全反应后的红色固体产物中是否含有 :
:
您最近一年使用:0次

 )
)

