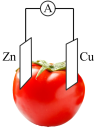
完成下列问题:
(1)实验探究
结论:化学反应除了有新物质生成以外,还总会伴随着能量变化,通常主要表现为热能的变化,有的___________ 热量,有的___________ 热量。
(2)放热反应和吸热反应
(1)概念
①放热反应:___________ 热量的化学反应。
②吸热反应:___________ 热量的化学反应。
(2)常见的放热反应和吸热反应
(1)实验探究
| 实验操作 | 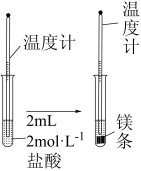 | 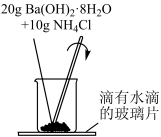 |
| 实验现象 | 有 | 闻到 |
| 实验结论 | 该反应产生 | 该反应产生NH3和H2O, |
| 化学方程式 |
(2)放热反应和吸热反应
(1)概念
①放热反应:
②吸热反应:
(2)常见的放热反应和吸热反应
| 放热反应 | 吸热反应 |
| ①所有燃烧反应 ②酸碱中和反应 ③大多数化合反应 ④活泼金属跟水或酸的反应 ⑤物质的缓慢氧化 | ①大多数分解反应 ②铵盐与碱的反应,如Ba(OH)2·8H2O或Ca(OH)2与NH4Cl反应 ③以C、H2、CO为还原剂的氧化还原反应,如C与H2O(g)反应,C与CO2反应 ④NaHCO3与盐酸的反应 |
更新时间:2022-03-02 20:09:10
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
【推荐1】放热反应在生产、生活中用途广泛。回答下列问题:
(1)前期的火箭曾用液态肼( )与双氧水反应来提供能量。已知0.4mol
)与双氧水反应来提供能量。已知0.4mol (l)与足量的双氧水反应,生成氮气和水蒸气,放出256.7kJ的热量。
(l)与足量的双氧水反应,生成氮气和水蒸气,放出256.7kJ的热量。
①此反应的化学方程式为_____ 。
②16g液态肼与足量的双氧水发生上述反应,放出_____ kJ热量。
(2)甲烷可以消除氮氧化物污染: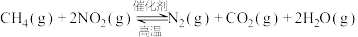 。温度为800℃的条件下,向恒容密闭的容器中通入
。温度为800℃的条件下,向恒容密闭的容器中通入 (g)和
(g)和 (g),使
(g),使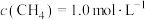 ,
,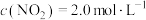 ,在不同催化剂作用下进行反应,测得
,在不同催化剂作用下进行反应,测得 随时间的变化情况如下表:
随时间的变化情况如下表:
实验1中,在10~20min内,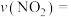
_____ ,40min时v(正)_____ (填“大于”“小于”或“等于”)v(逆)。
(3)催化效率:实验1_____ (填“>”“<”或“=”)实验2.
(4)乙醇( )应用于燃料电池,该电池采用可传导
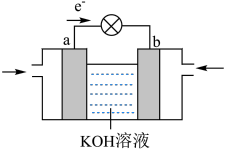
)应用于燃料电池,该电池采用可传导 的固体氧化物为电解质,其工作原理如图所示。a极为原电池的
的固体氧化物为电解质,其工作原理如图所示。a极为原电池的_____ (填“正”或“负”)极;b极电极反应式为_____ 。_____ (填“催化剂”或“中间产物”)。
(1)前期的火箭曾用液态肼(
 )与双氧水反应来提供能量。已知0.4mol
)与双氧水反应来提供能量。已知0.4mol (l)与足量的双氧水反应,生成氮气和水蒸气,放出256.7kJ的热量。
(l)与足量的双氧水反应,生成氮气和水蒸气,放出256.7kJ的热量。①此反应的化学方程式为
②16g液态肼与足量的双氧水发生上述反应,放出
(2)甲烷可以消除氮氧化物污染:
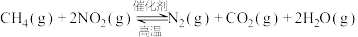 。温度为800℃的条件下,向恒容密闭的容器中通入
。温度为800℃的条件下,向恒容密闭的容器中通入 (g)和
(g)和 (g),使
(g),使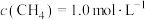 ,
,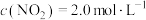 ,在不同催化剂作用下进行反应,测得
,在不同催化剂作用下进行反应,测得 随时间的变化情况如下表:
随时间的变化情况如下表:| 实验序号 |
| 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
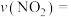
(3)催化效率:实验1
(4)乙醇(
 )应用于燃料电池,该电池采用可传导
)应用于燃料电池,该电池采用可传导 的固体氧化物为电解质,其工作原理如图所示。a极为原电池的
的固体氧化物为电解质,其工作原理如图所示。a极为原电池的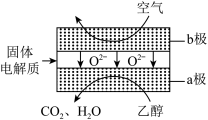
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】化学反应在发生物质变化的同时伴随有能量的变化,是人类获取能量的重要途径,而许多能量的利用与化学反应中的能量变化密切相关。
I.(1)H2+Cl2=2HCl的反应过程如图所示:

①根据如图填写下表:
②该反应为___________ 反应(填“放热”或“吸热”)。
(2)硅是太阳能电池的重要材料。工业冶炼纯硅的原理是:
粗硅冶炼:(a)SiO2+2C Si+2CO↑;
Si+2CO↑;
精炼硅:(b)Si+3HCl SiHCl3+H2;
SiHCl3+H2;
(c)SiHCl3+H2 Si+3HCl
Si+3HCl
化学反应与能量变化如图所示,回答下列问题:
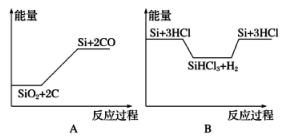
①(a)是___________ 反应,(b)是___________ 反应;(c)是___________ 反应(填“吸热"或“放热”)。
②反应(b)破坏反应物中的化学键所吸收的能量___________ (填“大于”或“小于”)形成生成物中化学键所放出的能量。
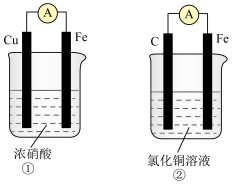
II.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是___________ ,电解质溶液是___________ 。
(2)正极上出现的现象是___________ 。
(3)若导线上转移电子lmol,则生成银___________ g。
I.(1)H2+Cl2=2HCl的反应过程如图所示:

①根据如图填写下表:
| 化学键 | 断裂或形成1mol化学键时能量变化 | 反应中能量变化 |
| Cl-Cl | 吸收243kJ | 共吸收679kJ |
| H-H | 吸收436kJ | |
| H-Cl | 放出431kJ | 共放出 |
(2)硅是太阳能电池的重要材料。工业冶炼纯硅的原理是:
粗硅冶炼:(a)SiO2+2C
 Si+2CO↑;
Si+2CO↑;精炼硅:(b)Si+3HCl
 SiHCl3+H2;
SiHCl3+H2;(c)SiHCl3+H2
 Si+3HCl
Si+3HCl化学反应与能量变化如图所示,回答下列问题:

①(a)是
②反应(b)破坏反应物中的化学键所吸收的能量
II.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是
(2)正极上出现的现象是
(3)若导线上转移电子lmol,则生成银
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐3】研究化学反应中能量变化,能更好地利用化学反应为生产和生活服务。
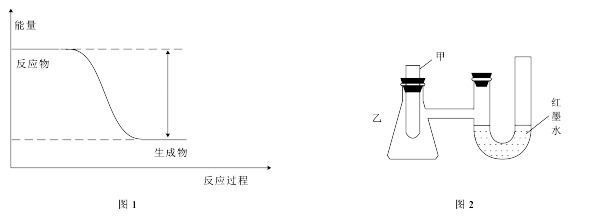
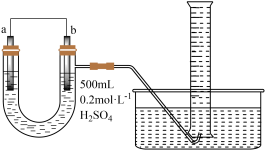
(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。
①该反应为__________ (填“吸热”或“放热”)反应。
②为了探究化学能与热能的转化,某实验小组设计了图2实验装置,在甲试管里先加入适量铁片,再加入稀硫酸,U形管中可观察到的现象是__________ 。
③若要使该反应的反应速率加快,下列措施可行的是__________ (填字母)。
A.铁片改为铁粉B.稀硫酸改为98%的浓硫酸C.升高温度
(2)若将上述反应设计成原电池,装置如图3所示。
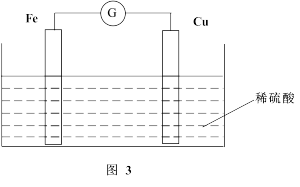
①铜为__________ (填“正”或“负”)极;负极的电极反应式为______ 。
②若该电池反应过程中共转移0.3 mol电子,则生成的H2在标准状况下的体积是__________ L。

(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。
①该反应为
②为了探究化学能与热能的转化,某实验小组设计了图2实验装置,在甲试管里先加入适量铁片,再加入稀硫酸,U形管中可观察到的现象是
③若要使该反应的反应速率加快,下列措施可行的是
A.铁片改为铁粉B.稀硫酸改为98%的浓硫酸C.升高温度
(2)若将上述反应设计成原电池,装置如图3所示。

①铜为
②若该电池反应过程中共转移0.3 mol电子,则生成的H2在标准状况下的体积是
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐1】化学反应同时伴随着能量变化,是人类获取能量的重要途径。以下是常见的化学反应,回答(1)和(2)。 晶体与
晶体与 晶体反应
晶体反应
c.氢氧化钠与盐酸反应 d.盐酸与碳酸氢钠反应
(1)以上化学反应中能用上图表示其能量变化的是______ (填字母),此类反应中有能量变化的原因是:断开反应物的化学键吸收的总能量______ (填“>”或“<”)形成生成物的化学键释放的总能量。
(2)从以上反应中选择一个反应设计原电池。
①将如图原电池装置补充完整______ 。
②证实化学能转化为电能的实验现象是______ .
③正极的电极反应式是______ .______ .
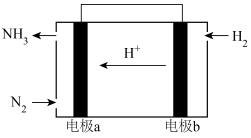
(4) 还原
还原 电化学法制备
电化学法制备 (甲醇)的工作原理如图所示。通入
(甲醇)的工作原理如图所示。通入 的一端是电池的
的一端是电池的______ 极(填“正”或“负”),通入 的一端发生的电极反应式为
的一端发生的电极反应式为______ 。生成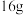 甲醇时,转移
甲醇时,转移______  电子。
电子。
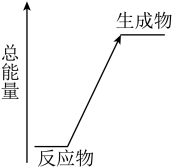
 晶体与
晶体与 晶体反应
晶体反应c.氢氧化钠与盐酸反应 d.盐酸与碳酸氢钠反应
(1)以上化学反应中能用上图表示其能量变化的是
(2)从以上反应中选择一个反应设计原电池。
①将如图原电池装置补充完整
②证实化学能转化为电能的实验现象是
③正极的电极反应式是
(4)
 还原
还原 电化学法制备
电化学法制备 (甲醇)的工作原理如图所示。通入
(甲醇)的工作原理如图所示。通入 的一端是电池的
的一端是电池的 的一端发生的电极反应式为
的一端发生的电极反应式为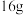 甲醇时,转移
甲醇时,转移 电子。
电子。
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐2】任何化学反应都伴随着能量的变化,化学能可转化为热能、电能等。回答下列有关问题:
(1) 的反应过程如图所示:
的反应过程如图所示:___________ (填“放热”或“吸热”)反应,生成2molHCl(g)吸收或放出的热量为___________ 。
(2)下列变化中属于吸热反应的是___________ (填标号)。
①液态水汽化 ②生石灰与水反应
③ ④
④ 与固体
与固体 混合
混合
(3)用如图装置推算铜锌原电池工作时产生的电流量。供选择的电极材料有纯铜片和纯锌片。则 a 电极的电极反应式为___________ ,当量筒中收集到 336mL(标准状况下)气体时,通过导线的电子的物质的量为___________ 。___________ 极(填“正”或“负”)。___________ (填“①”或“②”)该装置中的正极的电极反应式为___________ ;电子从___________ (填电极材料)流向___________ (填电极材料)
(1)
 的反应过程如图所示:
的反应过程如图所示: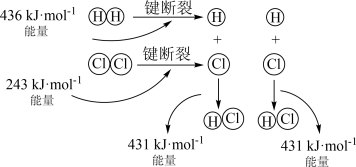
(2)下列变化中属于吸热反应的是
①液态水汽化 ②生石灰与水反应
③
 ④
④ 与固体
与固体 混合
混合(3)用如图装置推算铜锌原电池工作时产生的电流量。供选择的电极材料有纯铜片和纯锌片。则 a 电极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
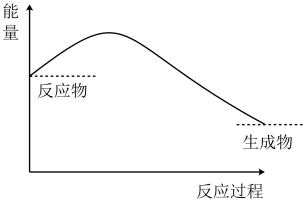
【推荐3】Ⅰ.锌片与稀硫酸反应的能量变化特征如图所示,回答下列问题。___________ 反应(填“吸热”或“放热”)。
(2)锌片和铜片用导线相连后,若将锌片和铜片浸泡在稀硫酸溶液中,可观察到铜片处的现象___________ 。
Ⅱ.以相同大小铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:
(3)该实验目的是研究水果种类和___________ 对水果电池电流大小的影响。
(4)该实验装置中,正极的材料是___________ ,负极的电极反应式是___________ 。
(5)当有 参与反应,转移的电子数目为
参与反应,转移的电子数目为___________ 。
Ⅲ.某温度下,体积为 恒容密闭容器中,X、Y两种气体参与反应,物质的量随时间的变化曲线如图所示。请回答下列问题:
恒容密闭容器中,X、Y两种气体参与反应,物质的量随时间的变化曲线如图所示。请回答下列问题:___________ 。
(7)在 内,用Y表示的反应速率为
内,用Y表示的反应速率为___________ 。
(2)锌片和铜片用导线相连后,若将锌片和铜片浸泡在稀硫酸溶液中,可观察到铜片处的现象
Ⅱ.以相同大小铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:
| 实验编号 | 水果种类 | 电极间距离/cm | 电流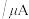 |
|
| 1 | 番茄 | 1 | 98.7 | |
| 2 | 番茄 | 2 | 72.5 | |
| 3 | 苹果 | 2 | 27.2 |
(3)该实验目的是研究水果种类和
(4)该实验装置中,正极的材料是
(5)当有
 参与反应,转移的电子数目为
参与反应,转移的电子数目为Ⅲ.某温度下,体积为
 恒容密闭容器中,X、Y两种气体参与反应,物质的量随时间的变化曲线如图所示。请回答下列问题:
恒容密闭容器中,X、Y两种气体参与反应,物质的量随时间的变化曲线如图所示。请回答下列问题: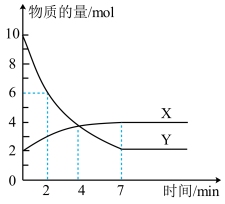
(7)在
 内,用Y表示的反应速率为
内,用Y表示的反应速率为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐1】为验证木炭与浓硫酸反应生成物中有二氧化硫和二氧化碳,选用下图仪器(含所盛物质),组装成套实验装置,试回答下列问题。
(1)在实验进行中,按气流方向从左到右顺序,A、B、C、D各装置的连接应该(用字母符号)是:___________ 。
(2)试管B、C、D中各有什么现象,才能表示已检出二氧化碳、二氧化硫?
B中为___________ 。 C中为________________ D中为_____________ 。
(3)写出A装置中反应化学方程式:___________________________ 。

(1)在实验进行中,按气流方向从左到右顺序,A、B、C、D各装置的连接应该(用字母符号)是:
(2)试管B、C、D中各有什么现象,才能表示已检出二氧化碳、二氧化硫?
B中为
(3)写出A装置中反应化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐2】二氧化氮是主要的大气污染物之一,工业上在一定条件下用NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略),回答:
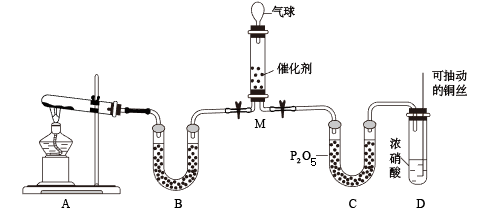
(1)用装置A制备NH3,其中发生反应的化学方程式为____ ,装置B内的试剂是____ 。
(2)装置C的作用的___ ,铜丝可抽动的优点是___ ,装置D中发生反应的离子方程式是____ 。
(3)NH3和NO2在M中充分反应,产生两种对环境友好的物质,该反应的化学方程式为___ 。M中可观察到的现象是____ 。

(1)用装置A制备NH3,其中发生反应的化学方程式为
(2)装置C的作用的
(3)NH3和NO2在M中充分反应,产生两种对环境友好的物质,该反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐3】同学们课外探究酸的性质活动中将以下8个实验分为三组进行(如下图所示)。
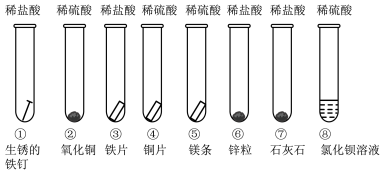
(1)将这8个实验进行分组:第一组①②;第二组③④⑤⑥;第三组⑦⑧。你认为如此分组的依据是:_______________ 。
(2)写出试管④⑤的实验现象:④_______ ,⑤_________ 。
(3)请作为课外活动小组成员,根据实验及现象的分析、比较,归纳出相应的结论(至少答3条):
例:酸能与某些金属氧化物反应;
①_____________ ;②_____________ ;③_____________ ;④_____________ 。

(1)将这8个实验进行分组:第一组①②;第二组③④⑤⑥;第三组⑦⑧。你认为如此分组的依据是:
(2)写出试管④⑤的实验现象:④
(3)请作为课外活动小组成员,根据实验及现象的分析、比较,归纳出相应的结论(至少答3条):
例:酸能与某些金属氧化物反应;
①
您最近一年使用:0次