下列实验所用主要仪器合理的是
| A.除去粗盐中的少量泥沙——分液漏斗 |
| B.实验室用自来水制取蒸馏水——冷凝管 |
| C.配制一定质量分数的NaCl溶液——容量瓶 |
| D.用酸性KMnO4标准溶液滴定草酸溶液——碱式滴定管 |
2022·北京东城·一模 查看更多[6]
北京市东城区2022届高三一模化学试题(已下线)押全国卷理综第9题 化学实验基础-备战2022年高考化学临考题号押题(课标全国卷)(已下线)化学-2022年高考押题预测卷02(山东卷)天津市新华中学2023届高三下学期第一次统一练习化学试题天津市新华中学2022-2023学年高三第一次模拟考试化学试题北京市第一○一中学2023-2024学年高三下学期统练三化学试卷
更新时间:2022-04-09 13:51:51
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】氨基酸分子中含有—NH2和COOH两种官能团,氨基酸分子表面不带电荷时的pH称为等电点,等电点时甘氨酸( H3NCH2COO- )记作HA.已知H2A
H3NCH2COO- )记作HA.已知H2A
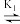 HA
HA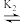 A- ,pK= -1g K。25℃时用NaOH溶液滴定。pH=0的甘氨酸,甘氨酸被滴定的百分数[被滴定的百分数=
A- ,pK= -1g K。25℃时用NaOH溶液滴定。pH=0的甘氨酸,甘氨酸被滴定的百分数[被滴定的百分数=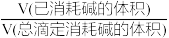 ×100%]与溶液pH的关系如图所示,下列说法错误的是
×100%]与溶液pH的关系如图所示,下列说法错误的是

 H3NCH2COO- )记作HA.已知H2A
H3NCH2COO- )记作HA.已知H2A
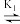 HA
HA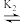 A- ,pK= -1g K。25℃时用NaOH溶液滴定。pH=0的甘氨酸,甘氨酸被滴定的百分数[被滴定的百分数=
A- ,pK= -1g K。25℃时用NaOH溶液滴定。pH=0的甘氨酸,甘氨酸被滴定的百分数[被滴定的百分数=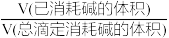 ×100%]与溶液pH的关系如图所示,下列说法错误的是
×100%]与溶液pH的关系如图所示,下列说法错误的是
| A.X点时,c(HA) =c(A- ) |
| B.Y点的pH=(pK1+ pK2)/2 |
| C.从Y点到Z点的过程中发生的反应为HA +OH-= A- +H2O |
| D.—COO- 结合H+的能力比—NH2的弱 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】25℃时,0.10 L某二元弱酸H2A用1.00 mol·L-1NaOH溶液调节其pH,溶液中H2A、HA-及A2-的物质的量浓度变化如图所示:
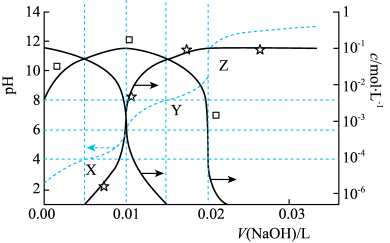
下列说法错误的是

下列说法错误的是
| A.H2A的Ka1=1 ×10-4 |
| B.溶液在X点和Z点时水的电离程度不相同 |
| C.在Y点时,c(Na+)> 3c(A2-) |
| D.0.1 mol·L-1NaHA溶液中: c(Na+)> c(HA-)> c(H2A)> c(A2-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】做化学实验时,必须十分重视安全和环保问题。下列操作方法不符合上述要求的是
| A.有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 |
| B.金属钠着火燃烧时,用泡沫灭火器灭火 |
| C.CO气体有毒,处理CO尾气的方法一般是将其点燃,转化成无毒的CO2 |
| D.在气体发生装置上点燃氢气等气体时,必须先检验气体的纯度 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】某小组利用如图装置探究 和
和 溶液的反应原理,下列错误的是
溶液的反应原理,下列错误的是

 和
和 溶液的反应原理,下列错误的是
溶液的反应原理,下列错误的是
A.装置B中若产生白色沉淀,说明 能将 能将 氧化成 氧化成 |
B.实验室中配制加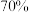 的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒,胶头滴管 的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒,胶头滴管 |
C.三颈烧瓶中通入 的操作应在滴加浓硫酸之前,目的是排尽装置内的空气 的操作应在滴加浓硫酸之前,目的是排尽装置内的空气 |
| D.装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列数据的测定,正确的是
| A.用广泛pH试纸测得某盐酸的pH=2.3 |
| B.用滴定管量取20mL的溶液 |
| C.用容量瓶配制了190mL 0.1 mol∙L-1的NaCl溶液 |
| D.用托盘天平称量了9.8g某固体 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
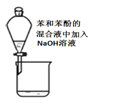
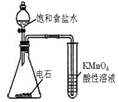
【推荐2】下列实验装置或操作与实验目的不相符的是
|
|  |
|
| A.证明Cl2氧化性强于Br2 | B.除去乙醇中的乙酸 | C.用海水制取蒸馏水 | D.配制100mL0.1mol/LNaCl溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列实验操作中正确的是
| A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B.蒸馏操作时,应使温度计水银球浸没在所蒸馏的液体混合物中 |
| C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D.向FeCl3饱和溶液中滴入NaOH溶液可制取Fe (OH)3胶体 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】通过下列装置进行相应实验,不能达到实验目的的是
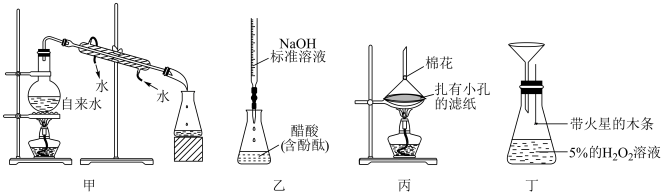

| A.甲装置可用于实验室制取蒸馏水 |
| B.乙装置可用于测定醋酸的浓度 |
| C.丙装置可用于分离Al(OH)3和I2的固体混合物 |
| D.可从丁装置的漏斗处向锥形瓶内添加少量MnO2,探究催化剂对化学反应速率的影响 |
您最近一年使用:0次







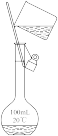
 等杂质制取蒸馏水
等杂质制取蒸馏水 溶液和NaOH溶液制
溶液和NaOH溶液制


