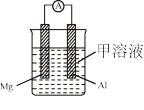
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片做电极,但甲同学将电极放入6mol·L-1的硫酸溶液中,乙同学将电极放入6mol·L-1的NaOH溶液中,如图所示。
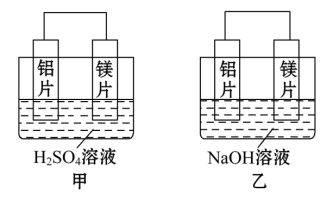
(1)写出甲中正极的电极反应式_______ 。
(2)乙中负极为_______ ,总反应的化学方程式_______ 。
(3)甲与乙同学均认为“如果构成原电池的电极材料都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出_______ 活动性更强,而乙会判断出_______ 活动性更强(填写元素符号)。
(4)由此实验得出的下列结论中,正确的有_______。

(1)写出甲中正极的电极反应式
(2)乙中负极为
(3)甲与乙同学均认为“如果构成原电池的电极材料都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出
(4)由此实验得出的下列结论中,正确的有_______。
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动性顺序表已过时,没有实用价值了 |
| D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析 |
更新时间:2022-05-09 21:26:29
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】电化学技术是有效解决 CO、SO2、NOx 等大气污染的重要方法,某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下 :
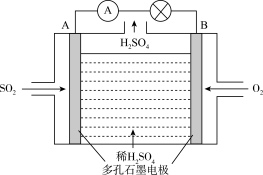
(1)电解质溶液中 离子向
离子向_______ (填“A极”或“B极” )移动。
(2)请写出负极电极反应式_______ 。
(3)用该原电池做电源,石墨做电极电解2L AgNO3和KNO3混合溶液,通电一段时间,两极均产生2.24 L(标准状况)气体,假设电解前后溶液体积不变,则电解过程中阴极先发生电极反应式:_______ ,阴极后发生电极反应式_______ ,析出银的物质的量_______ mol。

(1)电解质溶液中
 离子向
离子向(2)请写出负极电极反应式
(3)用该原电池做电源,石墨做电极电解2L AgNO3和KNO3混合溶液,通电一段时间,两极均产生2.24 L(标准状况)气体,假设电解前后溶液体积不变,则电解过程中阴极先发生电极反应式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】二氯化钒(VCl2)有强还原性和吸湿性,熔点为425°C、沸点为900°C,是制备多种医药、催化剂、含钒化合物的中间体。学习小组在实验室制备VCl2并进行相关探究。回答下列问题:
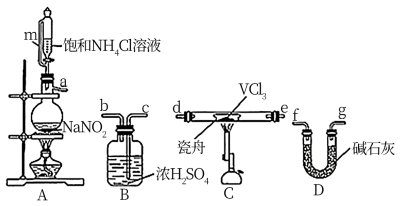
(1)小组同学通过VCl3分解制备VCl2。
①按气流方向,图中装置合理的连接顺序为_______ (用小写字母填空)。
②A中盛放NaNO2的仪器名称为_______ , 其中发生反应的离子方程式为_______ 。
③实验前需通入N2,其作用为_______ 。
(2)测定产品纯度:实验后产品中混有少量VCl3杂质。称量2.795g样品,溶于水充分水解,调pH后滴加Na2CrO4作指示剂,用0.5000mol/LAgNO3标准溶液滴定Cl-,达到滴定终点时消耗标准液体积为100.00mL(Ag2CrO4为砖红色沉淀,杂质不参加反应)。
①滴定终点的现象为_______ 。
②产品中VCl3与VCl2的物质的量之比为_______ 。
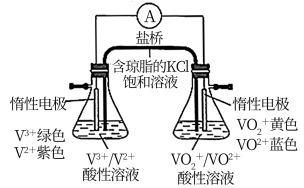
(3)小组同学进一步用如图所示装置比较含钒离子的还原性。接通电路后,观察到右侧锥形瓶中溶液蓝色逐渐变深,发生的电极反应式为_______ ,则VO2+、V2+的还原性较强的是_______ 。

(1)小组同学通过VCl3分解制备VCl2。
①按气流方向,图中装置合理的连接顺序为
②A中盛放NaNO2的仪器名称为
③实验前需通入N2,其作用为
(2)测定产品纯度:实验后产品中混有少量VCl3杂质。称量2.795g样品,溶于水充分水解,调pH后滴加Na2CrO4作指示剂,用0.5000mol/LAgNO3标准溶液滴定Cl-,达到滴定终点时消耗标准液体积为100.00mL(Ag2CrO4为砖红色沉淀,杂质不参加反应)。
①滴定终点的现象为
②产品中VCl3与VCl2的物质的量之比为
(3)小组同学进一步用如图所示装置比较含钒离子的还原性。接通电路后,观察到右侧锥形瓶中溶液蓝色逐渐变深,发生的电极反应式为

您最近一年使用:0次
【推荐3】完成下列小题
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是_____
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
(2)氮是重要的化工原料,已知NH3在纯氧中燃烧的能量变化如图。
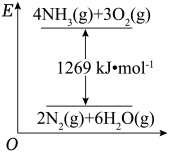
已知:H2O(l)=H2O(g) △H=+44kJ∙mol-1,则NH3(g)的摩尔燃烧焓的热化学方程式为_____ 。
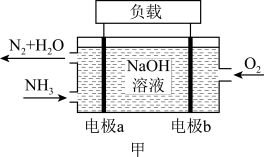
(3)NH3的燃烧反应可设计成燃料电池,工作原理如图甲所示。电极a为_____ (填“正极”或“负极”);电极b上的电极反应为_____ 。当共消耗1.568L(标准状况)气体时,通过负载的电子的物质的量为_____ mol。
(4)一种肼N2H4燃料电池的工作原理如图乙所示。
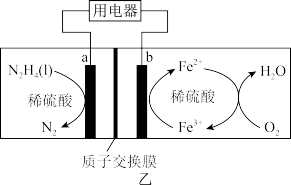
①a极的电极反应式为_____ ;电池中Fe2+→Fe3+的离子方程式为_____ 。
②若利用该电池给铅酸蓄电池充电,当消耗3.2gN2H4时,PbO2电极质量_____ (填“增加”或“减少”)_____ g。
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是_____
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ | C.③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |

已知:H2O(l)=H2O(g) △H=+44kJ∙mol-1,则NH3(g)的摩尔燃烧焓的热化学方程式为
(3)NH3的燃烧反应可设计成燃料电池,工作原理如图甲所示。电极a为

(4)一种肼N2H4燃料电池的工作原理如图乙所示。

①a极的电极反应式为
②若利用该电池给铅酸蓄电池充电,当消耗3.2gN2H4时,PbO2电极质量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】根据要求,回答下列问题:
I.把化学能转化为电能的装置叫做原电池。_______ 。
(2)装置④中,正极材料是_______ ;负极的电极反应式为_______ ;电池工作时,总反应的离子方程式为_______ ;烧杯中 向
向_______ 电极移动(填“Cu”或“Ag”);导线中电子的流动方向为_______ (填“Cu到Ag”或“Ag到Cu”)。
II.某同学利用铁与盐酸的反应,探究影响反应速率的因素(实验所用铁的质量相等且铁块的形状相同,盐酸均过量),实验设计如下:
(1)若四组实验均以收集到448mL(标准状况)氢气为标准,则上述实验中还需要测定的数据是_______ 。
(2)实验1和2是探究_______ 对该反应速率的影响。实验_______ 和_______ 是探究温度对该反应速率的影响。
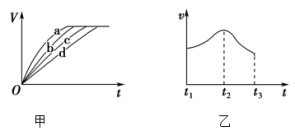
(3)不同时间t产生的氢气体积V如图甲所示,曲线c对应的实验编号是_______ 。每一组实验中产生氢气的速率v随时间t变化的曲线如图乙所示,其中t1~t2速率变化的主要原因是_______ 。______ 。
I.把化学能转化为电能的装置叫做原电池。
(2)装置④中,正极材料是
 向
向II.某同学利用铁与盐酸的反应,探究影响反应速率的因素(实验所用铁的质量相等且铁块的形状相同,盐酸均过量),实验设计如下:
| 实验编号 | 盐酸浓度/( ) ) | 铁的状态 | 温度/K |
| 1 | 2.00 | 块状 | 293 |
| 2 | 4.00 | 块状 | 293 |
| 3 | 4.00 | 粉末 | 293 |
| 4 | 4.00 | 块状 | 313 |
(2)实验1和2是探究
(3)不同时间t产生的氢气体积V如图甲所示,曲线c对应的实验编号是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】近年来,我国化工技术获得重大突破,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇(CH3OH)是其中的一个研究项目。该研究发生的主要反应如下:
I.CO与H2反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)
II.CO2与H2反应合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
(1)上述反应不符合原子经济性的是反应_______ (I或II)。
(2)在某一时刻采取下列措施,能使反应I的反应速率减小的措施是_______。
(3)一定温度下,在容积固定的密闭容器中发生反应II,下列说法可以表明反应达到化学平衡状态的是_______。
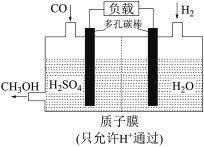
(4)H2还原CO电化学法制备甲醇(CO+2H2=CH3OH)的工作原理如图所示:_______ 极(填“正”或“负”),电池工作过程中H+通过质子膜向_______ (填“左”或者“右”)移动,通入CO的一端发生的电极反应式为_______ 。
I.CO与H2反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)
II.CO2与H2反应合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
(1)上述反应不符合原子经济性的是反应
(2)在某一时刻采取下列措施,能使反应I的反应速率减小的措施是_______。
| A.恒温恒容下,再充入CO | B.升高温度 |
| C.恒温恒容下,向其中充入Ar | D.恒温恒压下,向其中充入Ar |
| A.单位时间内消耗3molH2,同时生成lmol的CH3OH |
| B.CH3OH的体积分数不再发生变化 |
| C.3v(CO2)=v(H2) |
| D.容器内气体密度不再改变 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】(一)甲烷和氯气在光照条件下发生卤代反应,其反应机理如下:
反应①: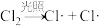 △H=242.7kJ·mol-1
△H=242.7kJ·mol-1
反应②: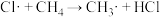 △H=7.5kJ·mol-1
△H=7.5kJ·mol-1
反应③: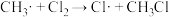 △H=-112.9kJ·mol-1
△H=-112.9kJ·mol-1
反应②、③反复循环,反应物浓度逐渐降低,自由基逐渐消失,反应停止。
(1)在该反应条件下断裂1mol CH3Cl中C—Cl键,需要吸收的能量为______ 。
(2)反应②与反应③的反应过程,如下图所示:

则该条件下,反应②的速率______ 反应③的速率(填“>”、“<”或“=”)。
(3)根据以上的反应机理,我们可以推测甲烷和氯气在光照条件下反应,除生成CH3Cl、CH2Cl2、CHCl3、CCl4外,还会有乙烷等有机物,原因是______ 。
(二)煤燃烧排放的SO2和NO2可形成严重的大气污染,某兴趣小组提出利用反应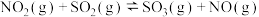 来处理。
来处理。
(4)在一定温度下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,达到平衡时NO2和SO2的体积之比为1:5,则该温度下平衡常数K为______ 。
(5)若向绝热恒容密闭容器中通入SO2和NO2,v正随时间变化如下图。下列结论正确的是______ 。
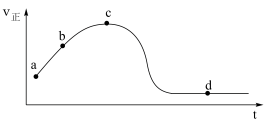
A. a点颜色比b点深
B. c点正反应速率等于逆反应速率
C. 若升高温度,d点SO2的转化率将增大
D. 反应的过程中,容器内气体压强保持不变
E. 若外界条件不发生改变,d点NO2和NO的体积比将保持不变
(6)若用一定浓度的NaClO2溶液(已调节其初始pH为5)充分吸收煤燃烧排放的烟气后,测得溶液中各物质的浓度如下表所示:
其中 NaClO2溶液吸收SO2的主要离子反应方程式为______ 。
(7)为消除NOx,科学家开发了一种能传导O2-的固态高温陶瓷电池,一极通氨气,另一极通NOx,生成无污染的常见气体和液体。写出该电池的正极反应式:______ 。
反应①:
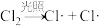 △H=242.7kJ·mol-1
△H=242.7kJ·mol-1反应②:
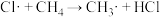 △H=7.5kJ·mol-1
△H=7.5kJ·mol-1反应③:
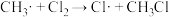 △H=-112.9kJ·mol-1
△H=-112.9kJ·mol-1反应②、③反复循环,反应物浓度逐渐降低,自由基逐渐消失,反应停止。
(1)在该反应条件下断裂1mol CH3Cl中C—Cl键,需要吸收的能量为
(2)反应②与反应③的反应过程,如下图所示:

则该条件下,反应②的速率
(3)根据以上的反应机理,我们可以推测甲烷和氯气在光照条件下反应,除生成CH3Cl、CH2Cl2、CHCl3、CCl4外,还会有乙烷等有机物,原因是
(二)煤燃烧排放的SO2和NO2可形成严重的大气污染,某兴趣小组提出利用反应
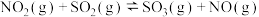 来处理。
来处理。(4)在一定温度下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,达到平衡时NO2和SO2的体积之比为1:5,则该温度下平衡常数K为
(5)若向绝热恒容密闭容器中通入SO2和NO2,v正随时间变化如下图。下列结论正确的是

A. a点颜色比b点深
B. c点正反应速率等于逆反应速率
C. 若升高温度,d点SO2的转化率将增大
D. 反应的过程中,容器内气体压强保持不变
E. 若外界条件不发生改变,d点NO2和NO的体积比将保持不变
(6)若用一定浓度的NaClO2溶液(已调节其初始pH为5)充分吸收煤燃烧排放的烟气后,测得溶液中各物质的浓度如下表所示:
| 物质 |  |  |  |  | Cl- | ClO- |
| 浓度/mg ·L-1 | 80.35 | 0.55 | 9.00 | 0.77 | 120.49 | 55.69 |
其中 NaClO2溶液吸收SO2的主要离子反应方程式为
(7)为消除NOx,科学家开发了一种能传导O2-的固态高温陶瓷电池,一极通氨气,另一极通NOx,生成无污染的常见气体和液体。写出该电池的正极反应式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某化学兴趣小组为了探究铝电极在原电池中的作用,在常温下,设计并进行了以下一系列实验,实验结果记录如下:
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同___________ (填“是”或“否”)。
(2)由实验3完成下列填空:
铝为___________ 极,电极反应式____________________________________________ ,电池总反应的化学方程式:____________________________________________ 。
(3)实验4中铝作___________ 极,判断依据除了镁不与NaOH溶液反应外,还可以根据其他组实验得出的结论:电流计指针偏向的电极为___________ (填“正”或“负”)极。
(4)根据实验结果总结出影响铝在原电池中作正极或负极的因素:①另一电极材料的性质;②____________________________________________ 。
编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
1 | Al、Mg | 稀盐酸 | 偏向Al |
2 | Al、Cu | 稀盐酸 | 偏向Cu |
3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
4 | Al、Mg | NaOH溶液 | 偏向Mg |
5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1、2中Al所作的电极(正极或负极)是否相同
(2)由实验3完成下列填空:
铝为
(3)实验4中铝作
(4)根据实验结果总结出影响铝在原电池中作正极或负极的因素:①另一电极材料的性质;②
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】有甲、乙两位同学均想利用原电池反应检测金属的活动性强弱,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如下图所示:

(1)写出甲池中负极的电极反应式:___ 。
(2)写出乙池中负极的电极反应式和总反应的离子方程式:负极___ ;总反应的离子方程式_____ 。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出__ 活动性更强,而乙会判断出__ 活动性更强。(填写元素符号)
(4)由此实验,可得到如下哪些正确结论__ 。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂,反应受条件的影响较大,因此应具体问题具体分析
(5)丙同学依据甲、乙同学的思路,设计如下实验:
将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入稀NaOH溶液中,分别形成了原电池。
①在这两个原电池中,负极分别为__ 。
A.铝片、铜片 B.铜片、铝片C.铝片、铝片 D.铜片、铜片
②写出插入浓硝酸中形成原电池的电极反应式___ 。

(1)写出甲池中负极的电极反应式:
(2)写出乙池中负极的电极反应式和总反应的离子方程式:负极
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出
(4)由此实验,可得到如下哪些正确结论
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂,反应受条件的影响较大,因此应具体问题具体分析
(5)丙同学依据甲、乙同学的思路,设计如下实验:
将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入稀NaOH溶液中,分别形成了原电池。
①在这两个原电池中,负极分别为
A.铝片、铜片 B.铜片、铝片C.铝片、铝片 D.铜片、铜片
②写出插入浓硝酸中形成原电池的电极反应式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某大学开发出纸一样薄的可生物降解锌电池,一化学兴趣小组受到启发,设计出如图所示装置用于探究原电池构成条件。回答下列问题:
(1)甲同学设计了下列实验探究原电池的构成条件。
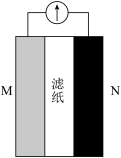
①实验1中电流计指针发生偏转的原因为_______ (填标号)。
A.铝与铜的活泼性不同 B.稀硫酸为电解质
C.整个装置形成了闭合回路 D.铜不与稀硫酸反应
②实验1中电流计发生偏转的原因之一是溶液中有自由移动的_______ (填“分子”、“离子”或“电子”);实验4中,原电池的负极为_______ (填“铝箔”或“铜箔”)。
(2)乙同学设计了下列实验探究原电池的构成条件。
①实验5、6中,所用稀H2SO4的物质的量的浓度相同,N极均观察到有气泡产生,产生气泡较快的是实验_______ (填“5”或“6”),原因是_______ 。
②实验7中的未知溶液可能为_______ (填标号)。
a.浓盐酸 b.浓硝酸 c.NaOH溶液 d.稀硫酸
(3)丙同学按下列材料设计了一原电池,该电池工作时, 移向
移向_______ (填“M”或“N”)极,该电池的正极表面发生的电极反应为_______ 。
(1)甲同学设计了下列实验探究原电池的构成条件。

| 试验编号 | M极材料 | N极材料 | 滤纸浸泡物质 | 电流计指针是否偏转 |
| 1 | 铝箔 | 铜箔 | 稀H2SO4 | 是 |
| 2 | 铝箔 | 铜箔 | 乙醇 | 否 |
| 3 | 铝箔 | 铜箔 | 蔗糖溶液 | 否 |
| 4 | 铝箔 | 铜箔 | 番茄汁(pH≈4) | 是 |
A.铝与铜的活泼性不同 B.稀硫酸为电解质
C.整个装置形成了闭合回路 D.铜不与稀硫酸反应
②实验1中电流计发生偏转的原因之一是溶液中有自由移动的
(2)乙同学设计了下列实验探究原电池的构成条件。
| 试验编号 | M极材料 | N极材料 | 滤纸浸泡物质 | 电流计指针是否偏转及偏转方向 |
| 5 | 铝箔 | 铜箔 | 稀H2SO4 | 偏向铝箔 |
| 6 | 铝箔 | 铝箔 | 稀H2SO4 | 不偏转 |
| 7 | 铜箔 | 铝箔 | 未知溶液 | 偏向铜箔 |
②实验7中的未知溶液可能为
a.浓盐酸 b.浓硝酸 c.NaOH溶液 d.稀硫酸
(3)丙同学按下列材料设计了一原电池,该电池工作时,
 移向
移向| M极材料 | N极材料 | 滤纸浸泡物质 |
| 铁箔 | 铜箔 | FeCl3稀溶液 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】由A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
(1)装置乙中正极的电极反应式是_______ 。
(2)四种金属活动性由强到弱的顺序是_______ 。
(3)Mg、Al设计成如图所示原电池装置:若电解液为盐酸,正极的电极反应为___ 。若电解液为氢氧化钠溶液,负极的电极反应为___ 。
| 装置 | 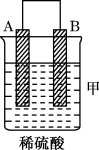 | 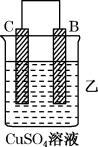 | 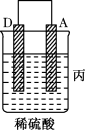 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置乙中正极的电极反应式是
(2)四种金属活动性由强到弱的顺序是
(3)Mg、Al设计成如图所示原电池装置:若电解液为盐酸,正极的电极反应为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】有A、B、C、D、E五块金属片,进行如下实验:
(1)A、B用导线相连后,同时浸入稀硫酸溶液中,A极为负极,活动性________________ ;
(2)C、D用导线相连后,同时浸入稀硫酸溶液中,电流由D→导线→C,活动性__________ ;
(3)A、C相连后,同时浸入稀硫酸溶液中,C极产生大量气泡,活动性________________ ;
(4)B、D相连后,同时浸入稀硫酸溶液中,D极发生氧化反应,活动性___________ ;
(5)用惰性电极电解含B离子和E离子的溶液,E先析出,活动性________________ ;综上所述,这五种金属的活动性从强到弱的顺序为________________________________ 。
(1)A、B用导线相连后,同时浸入稀硫酸溶液中,A极为负极,活动性
(2)C、D用导线相连后,同时浸入稀硫酸溶液中,电流由D→导线→C,活动性
(3)A、C相连后,同时浸入稀硫酸溶液中,C极产生大量气泡,活动性
(4)B、D相连后,同时浸入稀硫酸溶液中,D极发生氧化反应,活动性
(5)用惰性电极电解含B离子和E离子的溶液,E先析出,活动性
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】有甲、乙两位学生利用原电池反应检测金属的活动性顺序,两人都使用镁片与铝片作电极,但甲同学将电极放入6mol·L-1硫酸溶液中,乙同学将电极放入6mol·L-1的氢氧化钠溶液中,如图所示。
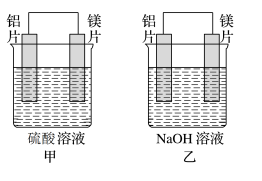
(1)写出甲池中正极的电极反应式__ 。
(2)写出乙池中负极的电极反应式__ 。
(3)写出乙池中总反应的离子方程式__ 。
(4)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出__ 活动性更强,而乙会判断出__ 活动性更强(填写元素符号)。
(5)由此实验,可得到如下哪些结论正确( )
A.利用原电池反应判断金属活动顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
(6)上述实验也反过来证明了“直接利用金属活动顺序判断原电池中的正负极”这种做法__ (可靠或不可靠)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案__ (如可靠,此空可不填)。

(1)写出甲池中正极的电极反应式
(2)写出乙池中负极的电极反应式
(3)写出乙池中总反应的离子方程式
(4)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出
(5)由此实验,可得到如下哪些结论正确
A.利用原电池反应判断金属活动顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
(6)上述实验也反过来证明了“直接利用金属活动顺序判断原电池中的正负极”这种做法
您最近一年使用:0次



