利用太阳能光解水,制备的H2用于还原CO2合成有机物,可实现资源的再利用。用H2还原CO2可以在一定条下合成CH3OH(不考虑副反应): ,某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol‧L-1和3 a mol‧L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为
,某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol‧L-1和3 a mol‧L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为_______ 。
 ,某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol‧L-1和3 a mol‧L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为
,某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol‧L-1和3 a mol‧L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为
2022高三·全国·专题练习 查看更多[1]
(已下线)专题5 K值专练
更新时间:2022-05-26 22:28:59
|
【知识点】 化学平衡常数的有关计算解读
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】(1)反应Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)  FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1.K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1.K2的值如下表:
①反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=
CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=_________________ (用ΔH1和ΔH2表示),K=________ (用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)  CO(g)+H2O(g)是
CO(g)+H2O(g)是___________________ 反应(填“吸热”或“放热”)。
②能判断CO2(g)+H2(g) CO(g)+H2O(g)达到化学平衡状态的依据是
CO(g)+H2O(g)达到化学平衡状态的依据是______ (填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g) FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

①用CO表示的化学反应速率为_________________ ,该条件下反应的平衡常数为______ ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为______ mol·L-1。
②下列措施中能使平衡时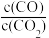 增大的是
增大的是________ (填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
 FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)  FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1.K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1.K2的值如下表: | 700 ℃ | 900 ℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
 CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=
CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH= CO(g)+H2O(g)是
CO(g)+H2O(g)是②能判断CO2(g)+H2(g)
 CO(g)+H2O(g)达到化学平衡状态的依据是
CO(g)+H2O(g)达到化学平衡状态的依据是A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
①用CO表示的化学反应速率为
②下列措施中能使平衡时
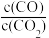 增大的是
增大的是A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数的测定。将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)=2NH3(g)+CO2(g),实验测得不同温度下的平衡数据列于下表:
(1)可以判断该分解反应已经达到平衡的是________ (填字母序号)。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)根据表中数据,列式计算25.0 ℃时的分解平衡常数:__________ 。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将________ (填“增加”“减少”或“不变”)。
(4)氨基甲酸铵分解反应的焓变ΔH____ 0(填“>”“=”或“<”,下同),熵变ΔS____ 0。
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
(1)可以判断该分解反应已经达到平衡的是
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)根据表中数据,列式计算25.0 ℃时的分解平衡常数:
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将
(4)氨基甲酸铵分解反应的焓变ΔH
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】碳的氧化物随意排放会对环境造成影响,而这些氧化物的合理利用既可以减少对环境的危害,又可以得到有用的化工产品。回答下列问题:
(1)在催化剂的作用下, 加氢合成乙烯的反应为
加氢合成乙烯的反应为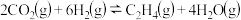
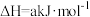 。压强为p时,按
。压强为p时,按 投料,测得达到平衡状态时,容器内各物质浓度的关系随温度的变化曲线如图1所示:
投料,测得达到平衡状态时,容器内各物质浓度的关系随温度的变化曲线如图1所示:
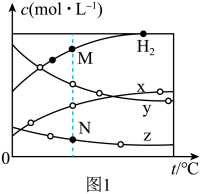
a_______ (填“>”“=”或“<”)0,曲线z代表的是_______ (写化学式)的平衡浓度的变化,M点和N点的 浓度:
浓度: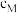
_______ (填“>”“=”或“<”) 。
。
(2)恒容密闭容器中进行反应: ,在甲、乙两个容积均为1 L的密闭容器中通入的
,在甲、乙两个容积均为1 L的密闭容器中通入的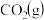 、
、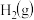 的物质的量如表:
的物质的量如表:
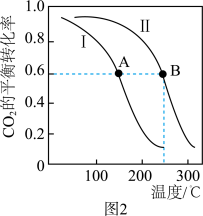
测得不同温度下两个容器内 的平衡转化率曲线如图2所示。曲线Ⅰ对应的是
的平衡转化率曲线如图2所示。曲线Ⅰ对应的是_______ (填“甲”或“乙”)容器,A、B两点的平衡常数之比即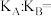
_______ 。
(1)在催化剂的作用下,
 加氢合成乙烯的反应为
加氢合成乙烯的反应为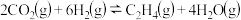
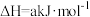 。压强为p时,按
。压强为p时,按 投料,测得达到平衡状态时,容器内各物质浓度的关系随温度的变化曲线如图1所示:
投料,测得达到平衡状态时,容器内各物质浓度的关系随温度的变化曲线如图1所示:
a
 浓度:
浓度: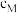
 。
。(2)恒容密闭容器中进行反应:
 ,在甲、乙两个容积均为1 L的密闭容器中通入的
,在甲、乙两个容积均为1 L的密闭容器中通入的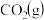 、
、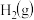 的物质的量如表:
的物质的量如表: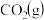 | 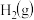 | |
| 甲容器 | 1 mol | 2 mol |
| 乙容器 | 2 mol | 4 mol |
 的平衡转化率曲线如图2所示。曲线Ⅰ对应的是
的平衡转化率曲线如图2所示。曲线Ⅰ对应的是

您最近一年使用:0次



