气体中微量的H2S,对工业生产和环境都有危害。通过以下实验装置利用20%脱硫剂三嗪(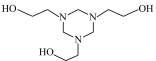 )水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。
)水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。

回答下列问题:
(1)仪器1的名称是_______ 。装置甲制取CO2,实验室制取CO2的离子方程式为_______ 。
(2)仪器2盛装0.001 mol·L-1H2S水溶液,三颈烧瓶丙中盛装溶液是_______ 。
(3)操作步骤:
①打开开关A、C,放入酸溶液产生CO2,目的是_______ ;
②一段时间后,关小开关C的出气量,打开压缩机开关,同时打开活塞放入H2S水溶液;逐渐减缓仪器1中酸溶液滴入速率并控制气压。使用CO2压缩机的作用是_______ 。
(4)通入二氧化碳所形成的混合气体中,经测量含H2S的量为1000 ×10-6mg·m-3,则该混合气体中c(H2S)计算式为_______ mol·L-1。
(5)三嗪( )水溶液吸收H2S,生成
)水溶液吸收H2S,生成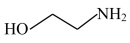 和
和 化学方程式为
化学方程式为_______ 。CuSO4溶液没有出现_______ (填现象), 证明三嗪吸收H2S的化学反应具有_______ 、_______ 等特征,20%三嗪水溶液是很好的脱硫剂。
 )水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。
)水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。
回答下列问题:
(1)仪器1的名称是
(2)仪器2盛装0.001 mol·L-1H2S水溶液,三颈烧瓶丙中盛装溶液是
(3)操作步骤:
①打开开关A、C,放入酸溶液产生CO2,目的是
②一段时间后,关小开关C的出气量,打开压缩机开关,同时打开活塞放入H2S水溶液;逐渐减缓仪器1中酸溶液滴入速率并控制气压。使用CO2压缩机的作用是
(4)通入二氧化碳所形成的混合气体中,经测量含H2S的量为1000 ×10-6mg·m-3,则该混合气体中c(H2S)计算式为
(5)三嗪(
 )水溶液吸收H2S,生成
)水溶液吸收H2S,生成 和
和 化学方程式为
化学方程式为
更新时间:2022-06-14 22:35:27
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】实验室配制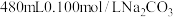 溶液回答下列问题,现有下列仪器:
溶液回答下列问题,现有下列仪器:
A.烧杯 B.100mL量筒 C.药匙 D.玻璃棒 E.天平
(1)配制时还缺少的仪器是_______ 。
(2)应用托盘天平称取十水碳酸钠晶体的质量为_______ 。
(3)若实验遇下列情况,溶液的浓度偏低的是_______。
(4)为探究Na2CO3和NaHCO3的性质,利用传感器继续做如下实验:
信息提示:溶液pH越小,OH-的浓度越小,溶液碱性越弱。
①实验A中,溶解时吸收热量的物质是_______ (填化学式)。
②实验B中,OH-未参与该反应的实验证据是_______ 。
③实验B中,滴加NaHCO3溶液的烧杯中溶液pH的变化与滴加Na2CO3溶液的pH有明显差异,写出反应初期的离子方程式:_______ 。
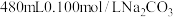 溶液回答下列问题,现有下列仪器:
溶液回答下列问题,现有下列仪器:A.烧杯 B.100mL量筒 C.药匙 D.玻璃棒 E.天平
(1)配制时还缺少的仪器是
(2)应用托盘天平称取十水碳酸钠晶体的质量为
(3)若实验遇下列情况,溶液的浓度偏低的是_______。
| A.溶解后没有冷却即进行定容 |
| B.定容时仰视容量瓶的标线 |
| C.容量瓶内壁附有水珠而未干燥处理 |
| D.向容量瓶中转移溶液时溶液流到容量瓶外面 |
| 编号 | 实验操作 | 实验数据 |
| A | 测量下面实验过程中温度的变化 | 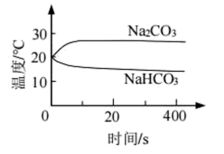 |
| B | 测量下面实验过程中溶液pH的变化 注:Na2CO3溶液和NaHCO3溶液的浓度相等 | 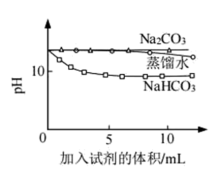 |
①实验A中,溶解时吸收热量的物质是
②实验B中,OH-未参与该反应的实验证据是
③实验B中,滴加NaHCO3溶液的烧杯中溶液pH的变化与滴加Na2CO3溶液的pH有明显差异,写出反应初期的离子方程式:
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】实验发现,溶液的酸碱性会影响物质的氧化性或者还原性.在化学实验中,经常将一定浓度的KMnO4溶液与一定浓度的硫酸混合使用.某实验需要480mLlmol/L的H2SO4和100g质量分数为25.2%的KMnO4溶液。要配制这两种溶液,进行了下列实验。请回答有关问题:
(1)实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:
该硫酸的物质的量浓度为_______ ,该实验中,应该取该硫酸_______ mL。
(2)要配制所需的两种溶液,下列仪器中需要使用的是烧杯、托盘天平和_______ (请填写仪器名称,下同),还需要的玻璃仪器有_______ 。

(3)下列关于仪器的说法正确的是______ 。
A. 使用前要检查容量瓶是否漏液
B. 容量瓶上标有容积、温度和浓度
C. 容量瓶和量筒用蒸馏水洗净后,需要烘干后再使用
D. 量筒在量取浓硫酸后,需要洗涤,且要将洗涤液转入容量瓶中
E. 该实验中多次使用玻璃棒,但是作用不同
(4)在两种溶液的配制过程中,下列操作中能使所配溶液的浓度偏低的有______ (填代号)。
①用量筒量取浓硫酸时仰视
②未等稀释后的硫酸溶液冷却到室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥称量KMnO4固体时托盘天平的左边放置砝码
⑦称取25.2gKMnO4,固体,溶解在74.8mL的水中配制KMnO4溶液
(1)实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:
| 【品名】硫酸 【化学式】H2SO4 【纯度】化学纯(CP) 【相对分子质量】98 【规格】500mL 【密度】  【质量分数】98% |
(2)要配制所需的两种溶液,下列仪器中需要使用的是烧杯、托盘天平和

(3)下列关于仪器的说法正确的是
A. 使用前要检查容量瓶是否漏液
B. 容量瓶上标有容积、温度和浓度
C. 容量瓶和量筒用蒸馏水洗净后,需要烘干后再使用
D. 量筒在量取浓硫酸后,需要洗涤,且要将洗涤液转入容量瓶中
E. 该实验中多次使用玻璃棒,但是作用不同
(4)在两种溶液的配制过程中,下列操作中能使所配溶液的浓度偏低的有
①用量筒量取浓硫酸时仰视
②未等稀释后的硫酸溶液冷却到室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥称量KMnO4固体时托盘天平的左边放置砝码
⑦称取25.2gKMnO4,固体,溶解在74.8mL的水中配制KMnO4溶液
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】实验室用密度为1.19 g/mL、质量分数为36.5%的浓盐酸配制500 mL 0.100 mol/L盐酸。回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为_______ 。
(2)①该实验中需要用量筒量取上述浓盐酸的体积为_______
②该配制实验中所需要的主要玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、_______ 。
③定容时,向容量瓶中加蒸馏水至液面接近刻度线_______ 处,改用_______ 逐滴滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
(3)配制过程中,下列操作中会导致结果偏高的是_______ (填序号)。
①量取浓盐酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时有少量水
③稀释后立即移液
④移液时不小心有少量液体溅出
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)已知软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) MnCl2+ Cl2↑+2H2O。现将一定量软锰矿石与200ml的浓盐酸反应(杂质不参加反应),制得标况下氯气5.6L。
MnCl2+ Cl2↑+2H2O。现将一定量软锰矿石与200ml的浓盐酸反应(杂质不参加反应),制得标况下氯气5.6L。
求①参加反应的HCl的质量_____
②反应后溶液中MnCl2的物质的量浓度_____ (反应前后溶液的体积不变)
(5)实验室为确定一瓶稀NaOH的浓度,用上述所配的盐酸溶液中和25.00mL该NaOH溶液,当酸与碱恰好完全反应时,消耗盐酸溶液22.50mL。试求该NaOH的物质的量浓度_____ 。
(1)该浓盐酸中HCl的物质的量浓度为
(2)①该实验中需要用量筒量取上述浓盐酸的体积为
②该配制实验中所需要的主要玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、
③定容时,向容量瓶中加蒸馏水至液面接近刻度线
(3)配制过程中,下列操作中会导致结果偏高的是
①量取浓盐酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时有少量水
③稀释后立即移液
④移液时不小心有少量液体溅出
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)已知软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)
 MnCl2+ Cl2↑+2H2O。现将一定量软锰矿石与200ml的浓盐酸反应(杂质不参加反应),制得标况下氯气5.6L。
MnCl2+ Cl2↑+2H2O。现将一定量软锰矿石与200ml的浓盐酸反应(杂质不参加反应),制得标况下氯气5.6L。求①参加反应的HCl的质量
②反应后溶液中MnCl2的物质的量浓度
(5)实验室为确定一瓶稀NaOH的浓度,用上述所配的盐酸溶液中和25.00mL该NaOH溶液,当酸与碱恰好完全反应时,消耗盐酸溶液22.50mL。试求该NaOH的物质的量浓度
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】胆矾(CuSO4⋅5H2O)是一种重要化工原料,某研究小组以生锈的铜屑为原料[主要成分是Cu,含有少量的油污、CuO、(CuCO3、Cu(OH)2]制备胆矾。流程如下。

回答问题:
(1)步骤①的目的是___________ 。
(2)步骤②中,溶解CuCO3的离子反应方程式为___________ ;在H2O2存在下Cu溶于稀H2SO4,反应的离子方程式为___________ 。
(3)步骤④中操作X的名称___________ ;用到玻璃仪器的名称是___________ ;得到的胆矾,不能用水洗涤的主要原因是___________ 。
(4)实验证明,滤液D能将I﹣氧化为I2。
甲同学认为不可能是步骤②中过量H2O2将I﹣氧化为I2,理由是___________ 。

回答问题:
(1)步骤①的目的是
(2)步骤②中,溶解CuCO3的离子反应方程式为
(3)步骤④中操作X的名称
(4)实验证明,滤液D能将I﹣氧化为I2。
甲同学认为不可能是步骤②中过量H2O2将I﹣氧化为I2,理由是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】按要求回答下列问题:
(1)加入双氧水能提高软锰矿(主要成分是MnO2)的浸出率,锰转化成Mn2+。写出酸性条件下双氧水提高软锰矿浸出率的离子方程式:_______ 。
(2)电镀污泥中的Cr2O3与加入的Na2CO3在空气中焙烧,Cr2O3被氧化为Na2CrO4,还有CO2逸出,写出该反应的化学方程式:_______ 。
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是:_______ 。
(4)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O也可制H2,其物质转化如图1所示。

①氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为:_______ 。
②CuFe2O4可用电化学方法得到,其原理如图2所示,则阳极的电极反应式为:_______ 。
(1)加入双氧水能提高软锰矿(主要成分是MnO2)的浸出率,锰转化成Mn2+。写出酸性条件下双氧水提高软锰矿浸出率的离子方程式:
(2)电镀污泥中的Cr2O3与加入的Na2CO3在空气中焙烧,Cr2O3被氧化为Na2CrO4,还有CO2逸出,写出该反应的化学方程式:
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是:
(4)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O也可制H2,其物质转化如图1所示。

①氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为:
②CuFe2O4可用电化学方法得到,其原理如图2所示,则阳极的电极反应式为:
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】研究不同价态硫元素之间的转化是合理利用硫元素的基本途径。回答下列问题:
I.以下是硫元素形成物质的“价—类二维图”及含硫物质相互转化的部分信息。________ ,其中氧化产物和还原产物的物质的量之比为________ 。
(2)工业上可利用D制备E,其中吸收D制备E时宜选用的吸收剂为________ (填“水”或“98.3%浓硫酸”)。
(3)G是一种由四种元素组成的钠盐,写出G与盐酸反应的离子方程式________ 。
Ⅱ.黄铁矿(主要成分为 ,杂质为
,杂质为 、
、 )是重要的矿产资源,以黄铁矿为原料制备绿矾
)是重要的矿产资源,以黄铁矿为原料制备绿矾 的工艺流程如下。
的工艺流程如下。
(4)“焙烧”时,为了提高焙烧效率,可以采用的措施有________ (写一条即可);尾气中的大气污染物可选用下列试剂中的________ 吸收(填标号)。
a.浓 b.稀
b.稀 c.NaOH溶液 d.氨水
c.NaOH溶液 d.氨水
(5)滤渣的主要成分为________ ;“除铝”需控制的pH范围是________ 。
(6)“系列操作”包括蒸发浓缩冷却结晶、过滤洗涤、干燥等,检验洗涤干净的实验操作是________ 。
I.以下是硫元素形成物质的“价—类二维图”及含硫物质相互转化的部分信息。
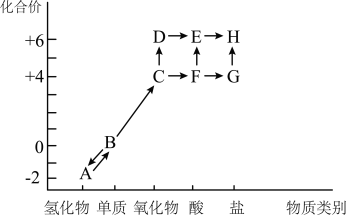
(2)工业上可利用D制备E,其中吸收D制备E时宜选用的吸收剂为
(3)G是一种由四种元素组成的钠盐,写出G与盐酸反应的离子方程式
Ⅱ.黄铁矿(主要成分为
 ,杂质为
,杂质为 、
、 )是重要的矿产资源,以黄铁矿为原料制备绿矾
)是重要的矿产资源,以黄铁矿为原料制备绿矾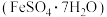 的工艺流程如下。
的工艺流程如下。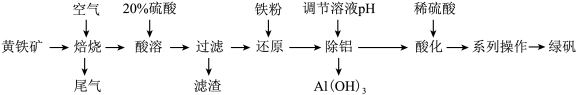
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| 1.5 | 3.2 |
| 3.0 | 5.0 |
| 6.3 | 8.3 |
a.浓
 b.稀
b.稀 c.NaOH溶液 d.氨水
c.NaOH溶液 d.氨水(5)滤渣的主要成分为
(6)“系列操作”包括蒸发浓缩冷却结晶、过滤洗涤、干燥等,检验洗涤干净的实验操作是
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】W为某短周期元素X的固态单质,E气体在标准状况下的密度为1.52g/L,A、B、C均为含X元素的酸式钠盐,它们在一定条件下有如图所示的转化关系,其中某些反应产物中的H2O已略去。
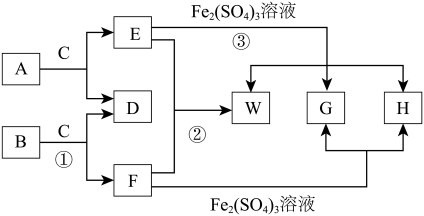
(1)画出X原子的原子结构示意图________ A的电子式可表示为___________ ;
(2)写出反应①的离子反应方程式___________ ;
(3)写出反应②的化学反应方程式_______________________________________ ;
(4)写出反应③的化学反应方程式_______________________________________ ;
(5)医学上常用含有H的糖衣片给患贫血的病人补铁,可检验该药片是否变质的化学试剂为_________ ,对于H来说,药片上糖衣可以起到________ 作用;
(6)有A、B与MgXO4组成的固体混合物中,测得X元素的质量分数为a,则O元素的质量分数为________ 。

(1)画出X原子的原子结构示意图
(2)写出反应①的离子反应方程式
(3)写出反应②的化学反应方程式
(4)写出反应③的化学反应方程式
(5)医学上常用含有H的糖衣片给患贫血的病人补铁,可检验该药片是否变质的化学试剂为
(6)有A、B与MgXO4组成的固体混合物中,测得X元素的质量分数为a,则O元素的质量分数为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】MnS(难溶于水)可应用于太阳能电池,实验室可利用如图所示装置制备MnS。
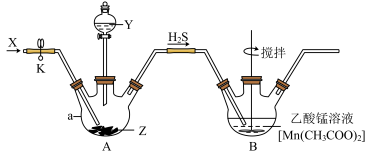
回答下列问题:
(1)仪器a的名称是___________ 。
(2)Y、Z两种试剂最恰当的成分是___________ (填字母)。
A.稀硫酸、FeS B.盐酸、FeS C.硝酸、CuS
(3)通入X的目的是赶走装置中的空气,并使装置A中的 进入装置B中反应,则X可以是
进入装置B中反应,则X可以是___________ (填化学式,任写1种)。
(4)上述实验装置中存在一个明显的缺陷,改正的方法是___________ 。
(5)装置B中发生反应的化学方程式为___________ 。理论上讲,从装置B中反应后的混合物中分离出MnS的操作是___________ 、___________ 干燥。

回答下列问题:
(1)仪器a的名称是
(2)Y、Z两种试剂最恰当的成分是
A.稀硫酸、FeS B.盐酸、FeS C.硝酸、CuS
(3)通入X的目的是赶走装置中的空气,并使装置A中的
 进入装置B中反应,则X可以是
进入装置B中反应,则X可以是(4)上述实验装置中存在一个明显的缺陷,改正的方法是
(5)装置B中发生反应的化学方程式为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】为充分利用资源,变废为宝,某研究小组采用废铁(主要成分为铁)制备硫酸铁,主要流程如下(部分 条件省略) :

回答问题:
(1)步骤①中适当加热,其目的是_______ 。
(2)步骤①中主要反应的离子方程式是_______ 。
(3)分离废渣与FeSO4溶液的操作是_______ (选填“过滤”或“蒸发”)。
(4)步骤②中加入H2O2溶液的目的是_______ 。
(5)废铁中含有少量硫化物,反应产生的副产物与H2S,可用_______ 吸收(填选项代号)。
A.稀硫酸 B.氢氧化钠溶液 C.硫酸铜溶液

回答问题:
(1)步骤①中适当加热,其目的是
(2)步骤①中主要反应的离子方程式是
(3)分离废渣与FeSO4溶液的操作是
(4)步骤②中加入H2O2溶液的目的是
(5)废铁中含有少量硫化物,反应产生的副产物与H2S,可用
A.稀硫酸 B.氢氧化钠溶液 C.硫酸铜溶液
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】碳、硅及其化合物的开发由来已久,在现代生活中有广泛应用。
(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是___ (用化学方程式表示)。
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:
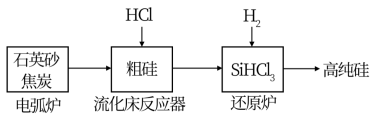
①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为___ 。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和___ 。
(3)某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验),实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2,关闭活塞a。
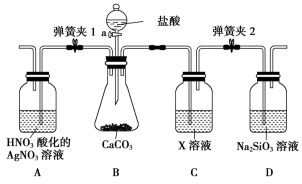
①通过步骤Ⅰ得知盐酸具有的性质是___ (填字母)。
A.挥发性 B.还原性 C.氧化性 D.酸性
②C装置中的试剂X是___ (写化学式)。
③碳、硅的非金属性逐渐减弱的原因:碳和硅___ 。
(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:

①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2,关闭活塞a。

①通过步骤Ⅰ得知盐酸具有的性质是
A.挥发性 B.还原性 C.氧化性 D.酸性
②C装置中的试剂X是
③碳、硅的非金属性逐渐减弱的原因:碳和硅
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】工业上,从有机催化剂(主要含钴和锌)回收金属的简易流程如下:
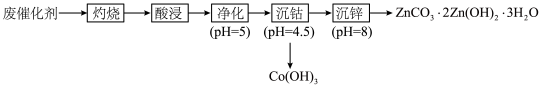
回答下列问题:
(1)“灼烧”的目的是___________________ 。“酸浸”时加入稀硫酸,浸出液含有Co2+、Zn2+、Mn2+、Fe3+、Fe2+等,检验Fe3+的试剂是____________________ (填化学式)。
(2)“净化”中加入KMnO4,生成Fe(OH)3和MnO2。配平下列方程式:________ +________Fe2++________H2O=________ MnO2+________ Fe(OH)3+________H+。
+________Fe2++________H2O=________ MnO2+________ Fe(OH)3+________H+。___________
(3)1mol (NH4)2S2O8中含1mol过氧键(—O—O—),“沉钴”中加入(NH4)2S2O8,还原产物为 。Co2+转化成1mol Co(OH)3,理论上消耗
。Co2+转化成1mol Co(OH)3,理论上消耗__________________ mol (NH4)2S2O8。
(4)“沉钴”中,依次用稀硫酸、水洗涤,“水洗”目的是_________ ,“沉钴”的pH不能太高,原因是_______ 。
(5)“沉锌”加入NH4HCO3,沉锌的温度不能太高,原因是_________ 。
(6)“沉钴”中,pH=4.5时c(Co3+)=1×10-15mol/L,Ksp[Co(OH)3]的数量级为____________ 。

回答下列问题:
(1)“灼烧”的目的是
(2)“净化”中加入KMnO4,生成Fe(OH)3和MnO2。配平下列方程式:________
 +________Fe2++________H2O=________ MnO2+________ Fe(OH)3+________H+。
+________Fe2++________H2O=________ MnO2+________ Fe(OH)3+________H+。(3)1mol (NH4)2S2O8中含1mol过氧键(—O—O—),“沉钴”中加入(NH4)2S2O8,还原产物为
 。Co2+转化成1mol Co(OH)3,理论上消耗
。Co2+转化成1mol Co(OH)3,理论上消耗(4)“沉钴”中,依次用稀硫酸、水洗涤,“水洗”目的是
(5)“沉锌”加入NH4HCO3,沉锌的温度不能太高,原因是
(6)“沉钴”中,pH=4.5时c(Co3+)=1×10-15mol/L,Ksp[Co(OH)3]的数量级为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】乙醇的沸点是78℃,能与水以任意比混溶。乙醚的沸点为34.6℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制乙醚的反应原理是:2CH3CH2OH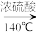 CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
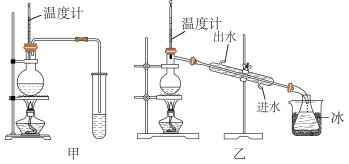
(1)图甲和乙是两套实验室制乙醚的装置,选装置_______ 较合适,理由是 _______ 。
(2)反应液中应加入沸石,其作用是_______ 。
(3)反应中温度计的位置是_______ 。
(4)用装置乙制得的乙醚中可能含有一定量的杂质,这杂质是_______ ,除去这种杂质的简易方法是 _______ 。
(5)请写出温度在170℃左右时发生反应的化学方程式_______ 。
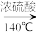 CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
(1)图甲和乙是两套实验室制乙醚的装置,选装置
(2)反应液中应加入沸石,其作用是
(3)反应中温度计的位置是
(4)用装置乙制得的乙醚中可能含有一定量的杂质,这杂质是
(5)请写出温度在170℃左右时发生反应的化学方程式
您最近半年使用:0次






