碱是一类重要的物质,氢氧化钠和氢氧化钙是常见的碱。
(1)我国古代劳动人民在生产、生活中就已经充分利用氢氧化钙。氢氧化钙的俗名是_______ ,请写出氢氧化钙的一种用途_______ 。
(2)为验证氢氧化钙和氢氧化钠的性质,进行如下图所示实验(装置气密性良好)。
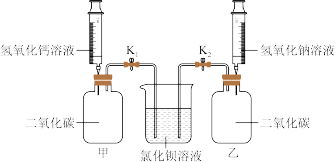
步骤:分别向充满二氧化碳的甲、乙两个容器中注入等体积的氢氧化钙饱和溶液、氢氧化钠饱和溶液;稍后打开弹簧夹K1、K2。
现象与结论:实验过程中甲、乙均有氯化钡溶液进入,进入乙中的液体量较多。从氢氧化钙和氢氧化钠性质的角度分析,产生上述现象的原因_______ 。乙中产生的白色沉淀的化学式是_______ 。
(3)在某15mL氢氧化钠溶液中滴入稀盐酸,稀盐酸的体积与溶液温度的变化关系如下图所示。

I.由上图可知,氢氧化钠溶液与盐酸反应会_______ (选填“放出”或“吸收”)热量;滴入稀盐酸的体积为_______ (选填“a”“b”“c”或“d”)mL时两者恰好完全反应。
II.设计实验,证明上述实验产生的热量来自酸碱中和反应,而不是溶液稀释所导致的。请写出实验方案。_______
(1)我国古代劳动人民在生产、生活中就已经充分利用氢氧化钙。氢氧化钙的俗名是
(2)为验证氢氧化钙和氢氧化钠的性质,进行如下图所示实验(装置气密性良好)。

步骤:分别向充满二氧化碳的甲、乙两个容器中注入等体积的氢氧化钙饱和溶液、氢氧化钠饱和溶液;稍后打开弹簧夹K1、K2。
现象与结论:实验过程中甲、乙均有氯化钡溶液进入,进入乙中的液体量较多。从氢氧化钙和氢氧化钠性质的角度分析,产生上述现象的原因
(3)在某15mL氢氧化钠溶液中滴入稀盐酸,稀盐酸的体积与溶液温度的变化关系如下图所示。

I.由上图可知,氢氧化钠溶液与盐酸反应会
II.设计实验,证明上述实验产生的热量来自酸碱中和反应,而不是溶液稀释所导致的。请写出实验方案。
21-22高一·全国·假期作业 查看更多[2]
(已下线)第03讲 放热反应与吸热反应-【寒假自学课】2022年高一化学寒假精品课(苏教版必修第二册)(已下线)第04讲 初中化学实验-【暑假自学课】2022年新高一化学暑假精品课(沪科版2020必修第一册)
更新时间:2022/06/17 11:11:46
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】甲醇(CH3OH)是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g);
CH3OH(g)+H2O(g);
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g);
CO(g)+H2O(g);
反应Ⅲ:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
回答下列问题:
(1)反应I进行的过程中体系内化学能减少,则反应I为______ (填“吸热”或“放热”)反应。
(2)已知反应Ⅱ为吸热反应,若反应Ⅱ在一绝热恒容密闭容器中进行,能说明反应已达到平衡状态的是______ (填字母)。
a.v(CO)=v(H2O)
b.温度不变
c.容器内CO2的体积分数保持不变
(3)250℃时,向体积为2L的恒容密闭容器中充入3molH2和1molCO2发生反应Ⅱ。经过5min达到平衡状态,平衡时测得CO2的转化率为50%。
①该温度下,反应开始至5min时,该反应的平均反应速率v(H2)=______ 。
②平衡时,H2的体积分数为_______ %,CO的物质的量浓度为______ mol•L-1。
(4)我国科学家研究Li-CO2电池,取得了重大科研成果。
①Li-CO2电池中,研究表明该电池反应产物为碳酸锂和单质碳,正极CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ中CO2与CO 反应的离子方程式。
反应的离子方程式。
I.2CO2+2e-=C2O
Ⅱ.C2O =CO2+CO
=CO2+CO
Ⅲ._______
Ⅳ.CO +2Li+=Li2CO3
+2Li+=Li2CO3
②根据①中反应步骤,可以判断Li-CO2电池中,在负极参与反应的物质为_______ (填“Li”或“CO2”)。
反应I:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g);
CH3OH(g)+H2O(g);反应Ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g);
CO(g)+H2O(g);反应Ⅲ:CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。回答下列问题:
(1)反应I进行的过程中体系内化学能减少,则反应I为
(2)已知反应Ⅱ为吸热反应,若反应Ⅱ在一绝热恒容密闭容器中进行,能说明反应已达到平衡状态的是
a.v(CO)=v(H2O)
b.温度不变
c.容器内CO2的体积分数保持不变
(3)250℃时,向体积为2L的恒容密闭容器中充入3molH2和1molCO2发生反应Ⅱ。经过5min达到平衡状态,平衡时测得CO2的转化率为50%。
①该温度下,反应开始至5min时,该反应的平均反应速率v(H2)=
②平衡时,H2的体积分数为
(4)我国科学家研究Li-CO2电池,取得了重大科研成果。
①Li-CO2电池中,研究表明该电池反应产物为碳酸锂和单质碳,正极CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ中CO2与CO
 反应的离子方程式。
反应的离子方程式。I.2CO2+2e-=C2O

Ⅱ.C2O
 =CO2+CO
=CO2+CO
Ⅲ.
Ⅳ.CO
 +2Li+=Li2CO3
+2Li+=Li2CO3②根据①中反应步骤,可以判断Li-CO2电池中,在负极参与反应的物质为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】 是工业上合成氨的重要反应。下图是该反应生成
是工业上合成氨的重要反应。下图是该反应生成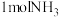 过程中的能量变化示意图。
过程中的能量变化示意图。
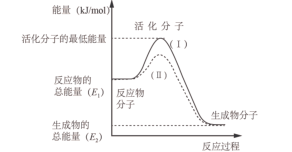
(1)曲线Ⅱ是通过改变化学反应中的___________ 条件,该条件___________ (填“可以”或“不可以”)改变反应放出或吸收的热量。
(2)合成氨的反应是___________ (填“吸热”或“放热”)反应,当生成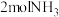 时,放出的热量为
时,放出的热量为___________ kJ(用 、
、 表示)。
表示)。
(3)若该反应在恒温恒容条件下进行,充入He,则化学反应速率___________ (填“增大”、“减小”或“不变”)。
(4)合成氨反应的速率v与时间t的关系,如图所示:
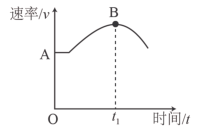
①图中 段反应速率加快的原因为
段反应速率加快的原因为___________ ;
②图中 时刻后速率变小的原因为
时刻后速率变小的原因为___________ 。
 是工业上合成氨的重要反应。下图是该反应生成
是工业上合成氨的重要反应。下图是该反应生成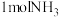 过程中的能量变化示意图。
过程中的能量变化示意图。
(1)曲线Ⅱ是通过改变化学反应中的
(2)合成氨的反应是
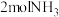 时,放出的热量为
时,放出的热量为 、
、 表示)。
表示)。(3)若该反应在恒温恒容条件下进行,充入He,则化学反应速率
(4)合成氨反应的速率v与时间t的关系,如图所示:

①图中
 段反应速率加快的原因为
段反应速率加快的原因为②图中
 时刻后速率变小的原因为
时刻后速率变小的原因为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】甲醇 作为清洁、高效的燃料,在航天、军事等方面有广阔的应用前景。
作为清洁、高效的燃料,在航天、军事等方面有广阔的应用前景。 和
和 可发生反应制取
可发生反应制取 :
: 。反应过程中能量变化如图1所示,该反应是
。反应过程中能量变化如图1所示,该反应是_____ 反应(填“放热”或“吸热”)。
(2)在 恒容密闭容器中加入
恒容密闭容器中加入 和
和 ,发生反应
,发生反应 。测得部分气体的物质的量随时间变化如图2所示。
。测得部分气体的物质的量随时间变化如图2所示。
①2min时,正反应速率_____ 逆反应速率(填“大于”“等于”或“小于”)。
②06̃min内,用 表示该反应的平均速率为
表示该反应的平均速率为_____  。
。
③保持其他条件不变时,下列措施中,能提高反应速率的是_____ (填字母)。
A.升高温度 B.增大容器体积 C.加入催化剂 D.充入惰性气体
④反应达平衡时, 的物质的量浓度为
的物质的量浓度为_____  。
。
(3)图3所示为甲醇燃料电池,电池总反应为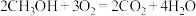 。
。 是
是_____ 极(填“正”或“负”)。
②负极的电极反应式为_____ 。
③若电路中转移了 电子,则理论上消耗的
电子,则理论上消耗的 在标准状况下的体积为
在标准状况下的体积为_____ L。
 作为清洁、高效的燃料,在航天、军事等方面有广阔的应用前景。
作为清洁、高效的燃料,在航天、军事等方面有广阔的应用前景。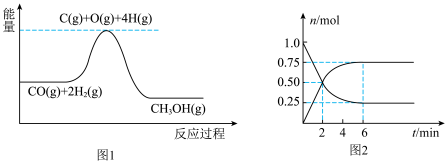
 和
和 可发生反应制取
可发生反应制取 :
: 。反应过程中能量变化如图1所示,该反应是
。反应过程中能量变化如图1所示,该反应是(2)在
 恒容密闭容器中加入
恒容密闭容器中加入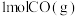 和
和 ,发生反应
,发生反应 。测得部分气体的物质的量随时间变化如图2所示。
。测得部分气体的物质的量随时间变化如图2所示。①2min时,正反应速率
②06̃min内,用
 表示该反应的平均速率为
表示该反应的平均速率为 。
。③保持其他条件不变时,下列措施中,能提高反应速率的是
A.升高温度 B.增大容器体积 C.加入催化剂 D.充入惰性气体
④反应达平衡时,
 的物质的量浓度为
的物质的量浓度为 。
。(3)图3所示为甲醇燃料电池,电池总反应为
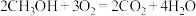 。
。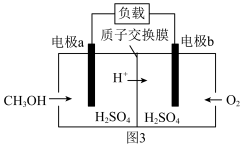
 是
是②负极的电极反应式为
③若电路中转移了
 电子,则理论上消耗的
电子,则理论上消耗的 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分,将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
[提出猜想]
猜想1:该气体为CO2;
猜想2:该气体为SO2;
猜想3:_________________________________________ 。
为了验证猜想,该小组设计实验加以探究:
[实验探究]该小组同学按如图所示装置,将气体从a端通入,则

(1)B中应该装下列________ 试剂(填编号)。
A.NaCl溶液 B.酸性KMnO4溶液 C.盐酸 D.澄清石灰水
(2)A中品红溶液的作用是____________________________________ 。
(3)D中澄清石灰水的作用是________________________________________ 。
通过该实验,该小组同学观察到以下三个实验现象:①A中品红溶液褪色;②C中品红溶液不褪色;③D中澄清石灰水变浑浊,由上述现象该小组同学确认该气体的成分为________________ 。
[提出猜想]
猜想1:该气体为CO2;
猜想2:该气体为SO2;
猜想3:
为了验证猜想,该小组设计实验加以探究:
[实验探究]该小组同学按如图所示装置,将气体从a端通入,则

(1)B中应该装下列
A.NaCl溶液 B.酸性KMnO4溶液 C.盐酸 D.澄清石灰水
(2)A中品红溶液的作用是
(3)D中澄清石灰水的作用是
通过该实验,该小组同学观察到以下三个实验现象:①A中品红溶液褪色;②C中品红溶液不褪色;③D中澄清石灰水变浑浊,由上述现象该小组同学确认该气体的成分为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某探究性实验小组的同学将打磨过的镁条投入到滴有酚酞的饱和NaHCO3溶液中,发现反应迅速,产生大量气泡和白色不溶物,溶液的浅红色加深。该小组同学对白色不溶物的成分进行了探究和确定。
Ⅰ、提出假设:
甲同学:可能只是MgCO3;
乙同学:可能只是Mg(OH)2;
丙同学:可能是xMgCO3·yMg(OH)2
Ⅱ、定性实验探究:
(1)取沉淀物少许于试管中,加入稀盐酸时固体溶解,产生大量气泡,则__________ 同学假设错误(选填“甲”、“乙”或“丙”)。
Ⅲ、定量实验探究:取一定量已干燥过的沉淀样品,利用下列装置测定其组成(部分固定夹持类装置未画出),经实验前后对比各装置的质量变化来分析沉淀的组成,得出丙同学的假设是正确的。请回答下列问题:______ → → → → → g→h(各装置只使用一次)。
(3)实验一段时间后,当B装置中______________ (填实验现象),停止加热,说明固体已分解完全;打开f处的活塞,缓缓通入空气数分钟的目的是__________________ ,
(4)指导老师认为在上述实验装置中末端还需再连接一个D装置,若无此装置,会使测出的x :y的值______ (选填“偏大”、“偏小”或“无影响”)。
(5)若改进实验后,最终装置B质量增加m克,装置D质量增加了n克,则x :y=___________ 。(用含m、n的代数式表示)
Ⅰ、提出假设:
甲同学:可能只是MgCO3;
乙同学:可能只是Mg(OH)2;
丙同学:可能是xMgCO3·yMg(OH)2
Ⅱ、定性实验探究:
(1)取沉淀物少许于试管中,加入稀盐酸时固体溶解,产生大量气泡,则
Ⅲ、定量实验探究:取一定量已干燥过的沉淀样品,利用下列装置测定其组成(部分固定夹持类装置未画出),经实验前后对比各装置的质量变化来分析沉淀的组成,得出丙同学的假设是正确的。请回答下列问题:

(3)实验一段时间后,当B装置中
(4)指导老师认为在上述实验装置中末端还需再连接一个D装置,若无此装置,会使测出的x :y的值
(5)若改进实验后,最终装置B质量增加m克,装置D质量增加了n克,则x :y=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某化学小组拟设计实验探究SO2与钙盐溶液的反应情况。
【文献资料】
①CaSO3是难溶于水、易溶于盐酸的白色固体;
②实验室用Na2SO3粉末和80%硫酸反应制备SO2;
③浓硫酸与水混合时放出大量的热,产生大量“酸雾”。
【设计实验】
实验Ⅰ:探究二氧化硫与氯化钙溶液反应。

(1)若气体从左至右流动,选择装置并排序为________ (填代号)。
(2)D装置作用是___________________________________________
(用离子方程式表示)。
(3)连接装置进行实验,发现C装置中产生白色沉淀。
①甲同学对白色沉淀成分提出如下假设:
假设1:白色固体是CaSO3;
假设2:白色固体是CaSO4;
假设3:白色固体是CaSO4和CaSO3。
②乙同学设计实验证明白色沉淀是CaSO4,他的实验方案是_____________________________________ 。
③丙同学认为C中生成硫酸钙的原因是装置内O2氧化了SO2。
排除装置内O2干扰采取的措施是:在启动B中反应之前,____________ (填实验步骤)
重新实验,C中无明显现象,所以SO2和CaCl2溶液不反应。
实验Ⅱ:探究SO2和Ca(ClO)2溶液反应。
丁同学仅将上述实验C装置中氯化钙溶液换成漂白精溶液,进行实验时产生了大量白色沉淀。
(4)化学反应有两种情况。
①若SO2过量,则发生反应为Ca(ClO)2+2SO2+2H2O===CaSO4↓+2HCl+H2SO4
②若SO2少量,则发生反应为_____________________________________________________ 。
(5)为了探究C中SO2是否过量,戊同学取少量C中上层清液于试管中,加入下列物质可以达到实验目的的是________ (填字母)。
a.NaHCO3溶液 b.品红溶液
c.AgNO3溶液 d.紫色石蕊溶液
【文献资料】
①CaSO3是难溶于水、易溶于盐酸的白色固体;
②实验室用Na2SO3粉末和80%硫酸反应制备SO2;
③浓硫酸与水混合时放出大量的热,产生大量“酸雾”。
【设计实验】
实验Ⅰ:探究二氧化硫与氯化钙溶液反应。

(1)若气体从左至右流动,选择装置并排序为
(2)D装置作用是
(用离子方程式表示)。
(3)连接装置进行实验,发现C装置中产生白色沉淀。
①甲同学对白色沉淀成分提出如下假设:
假设1:白色固体是CaSO3;
假设2:白色固体是CaSO4;
假设3:白色固体是CaSO4和CaSO3。
②乙同学设计实验证明白色沉淀是CaSO4,他的实验方案是
③丙同学认为C中生成硫酸钙的原因是装置内O2氧化了SO2。
排除装置内O2干扰采取的措施是:在启动B中反应之前,
重新实验,C中无明显现象,所以SO2和CaCl2溶液不反应。
实验Ⅱ:探究SO2和Ca(ClO)2溶液反应。
丁同学仅将上述实验C装置中氯化钙溶液换成漂白精溶液,进行实验时产生了大量白色沉淀。
(4)化学反应有两种情况。
①若SO2过量,则发生反应为Ca(ClO)2+2SO2+2H2O===CaSO4↓+2HCl+H2SO4
②若SO2少量,则发生反应为
(5)为了探究C中SO2是否过量,戊同学取少量C中上层清液于试管中,加入下列物质可以达到实验目的的是
a.NaHCO3溶液 b.品红溶液
c.AgNO3溶液 d.紫色石蕊溶液
您最近一年使用:0次



